多孔MgO晶体拥有特殊骨架型结构,具有无毒、 无味、 抗菌性、 热稳定性好等特征,而且独特的多孔结构赋予晶体材料高孔隙率、 大表面积、 高催化活性、 更多质量的传输通道等优点,因此应用领域广泛。在环境保护领域,可以用于去除废水中重金属离子、 有机染料治理、 饮用水除氟等,还可以用于有毒气体处理[1-2];在工业催化领域,可以用作敏感型高效催化剂及载体[3];在抗菌领域,可以用于抑制病原微生物[4];在食品卫生、 建筑、 阻燃材料等领域也运用广泛,因此,多孔MgO晶体具有极高的研究和经济价值。
目前,MgO制备方法主要包括沉淀法和水热法。 赵嘉莘等[5]和Zhao等[6]以MgCl2·6H2O为镁源, K2CO3为沉淀剂, 采用简单水热法制备碱式碳酸镁(4MgCO3·Mg(OH)2·4H2O), 以此为前驱体, 通过煅烧工艺, 制备性能优良、 比表面积为28.82 m2/g的多孔MgO绒球。 李录[7]以Mg(NO)3·6H2O和NaOH为原料, 采用沉淀预处理后, 采用煅烧法、 水热法制备比表面积为284 m2/g高活性MgO多孔材料, 对重金属Pb(II)和Cd(II)均具有较好的吸附作用。 Borgohain等[8]使用不同镁源和沉淀剂, 采用溶胶-凝胶法、 水热法合成多孔MgO纳米结构, 该多孔MgO在热力学温度为313 K时, Langmuir吸附量达到29 131 mg/g,对氟化物具有较好的吸附性。Ahmed等[9]以MgSO4为镁源, NH3为沉淀剂和造孔剂,采用简单沉淀法, 通过调整Mg2+、 NH3的物质的量比调控MgO比表面积,制得比表面积为121 m2/g的多孔MgO,对磷酸盐和甲基橙均具有良好的吸附作用。康宁[10]将CO(NH2)2和Mg(NO)3·6H2O以物质的量比为4.5∶1混合,加入质量分数为15%的聚乙二醇400(H(OCH2CH2)nOH),在温度为110 ℃、 烘焙时间为2.0 h时,成功制备出比表面积为65.19 m2/g的多孔MgO,该多孔MgO对氟化物具有较好的吸附能力。研究者大多以可溶性镁盐和沉淀剂等化学试剂为原料制备MgO,合成成本高,且生产过程中伴随着产生含盐废水,容易造成环境污染。
近年来, 部分研究者选择白云石、 水氯镁石等天然矿物为原料制备MgO。 何欣苪[11]以水氯镁石和无水碳酸钠为原料, 采用沉淀法和水热法制备4种具有不同形貌和高比表面积的MgO, 发现它们对水溶液中的刚果红染料表现出优异的吸附性能。 夏勇亮[12]以白云石为原料, 草酸钠和聚乙二醇作为添加剂, 采用碳化法制备不同形貌且拥有大比表面积的高纯MgO。 仇龙等[13]以轻烧粉和铵盐为原料, 氨水为沉淀剂, 通过煅烧前驱体, 制备比表面积为214.6 m2/g的MgO, 对甲基橙的饱和吸附量达169.2 mg/g。 综上所述, 以矿物原料制备MgO时, 均需要采用酸浸、 氨浸且添加各类辅助剂,工艺繁琐,成本高,且伴随毒性气体、 含氯废水、 强酸、 碱性废水等副产物,容易造成环境污染。
作者所在课题组以菱镁矿为原料, 采用低成本、 短流程工艺制备性能优异、 形貌可控的三水碳酸镁、 4MgCO3·Mg(OH)2·4H2O等镁质化工材料[14-17]。本研究中以菱镁矿为原料, 在无外加辅助剂作用下, 采用水化碳化-低温水溶液法制备前驱体4MgCO3·Mg(OH)2·4H2O, 通过焙烧前驱体制得多孔MgO, 考察焙烧温度、 时间对前驱体分解率、 MgO形貌和物相组成的影响, 同时探究4MgCO3·Mg(OH)2·4H2O热分解机制。
1 材料与方法
1.1 试剂材料和仪器设备
试剂材料: 天然菱镁矿(MgO质量分数为47.61 %, SiO2质量分数为0.66 %, CaO质量分数为0.50%, CO2质量分数为51.23%, 辽宁宽甸); 去离子水(实验室自制); CO2气体(工业纯, 吉林盛泰气体制造有限公司)。
仪器设备: Ultima Ⅳ型X射线衍射仪(XRD,日本理学Rigaku公司);S-3400N型扫描电子显微镜(SEM,日立公司);STA-449F3型综合热分析仪(TG-DSC,德国NETZSCH公司);NOVO 1000e型比表分析仪(深圳顺络电子股份公司)。
1.2 前驱体4MgCO3·Mg(OH)2·4H2O与MgO晶体的制备
在温度为750 ℃时, 将菱镁矿矿石煅烧时间为3.0 h后, 对煅烧产物进行过筛处理, 获得粒径为75 μm的轻烧镁粉。
去离子水和轻烧镁粉按质量比为40∶1的比例混合,在水浴温度为70 ℃、 反应时间为3.0 h条件下,制得Mg(OH)2悬浮液。悬浮液冷却后,通入CO2进行碳酸化。溶液pH为7.0~7.5时,抽滤,制得Mg(HCO3)2溶液。量取一定体积滤液搅拌时间为2.0 h热解,抽滤、 洗涤,将滤饼在温度为100 ℃下烘干,时间约为10 h,得到白色粉末,即为前驱体4MgCO3·Mg(OH)2·4H2O。
将前驱体4MgCO3·Mg(OH)2·4H2O在温度为650~800 ℃时焙烧2.5~4.0 h,得到MgO晶体。
4MgCO3·Mg(OH)2·4H2O的分解率x计算公式[18]为
(1)
式中: m1为4MgCO3·Mg(OH)2·4H2O的总质量; m2为样品剩余的质量。
2 结果与分析
2.1 前驱体4MgCO3·Mg(OH)2·4H2O的特征分析
前驱体4MgCO3·Mg(OH)2·4H2O的XRD检测结果如图1所示。由图可知,产物全部衍射峰与4MgCO3·Mg(OH)2·4H2O标准卡片(PDF#25-0513)的特征峰相对应, 表明所得前驱体为4MgCO3·Mg(OH)2·4H2O, 峰型尖锐且窄,表明所得样品为结晶度较好的晶体。
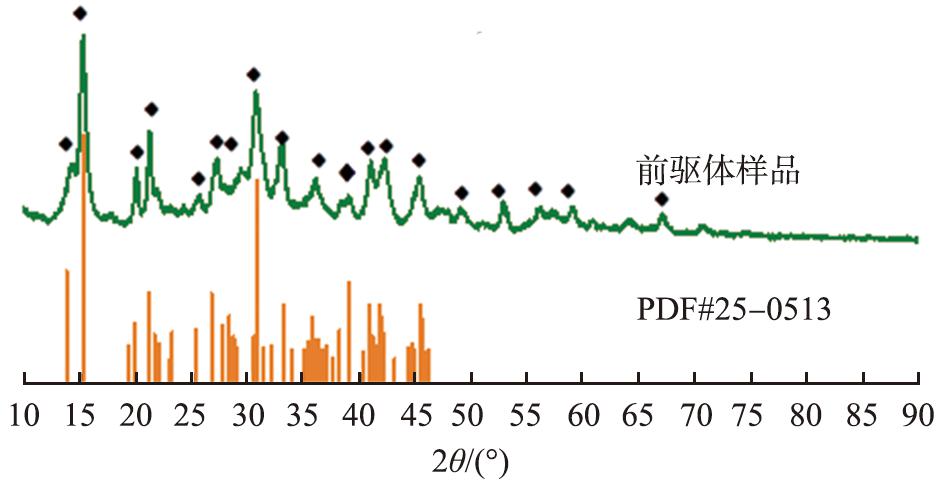
图1 4MgCO3·Mg(OH)2·4H2O的XRD图谱
Fig.1 XRD pattern of 4MgCO3·Mg(OH)2·4H2O
所涉及的主要反应如下。
MgCO3→MgO+CO2↑,
(2)
MgO+H2O+2CO2→Mg(HCO3)2,
(3)
5Mg(HCO3)2 →4MgCO3MgOH4H2O+6CO2↑。
(4)
前驱体4MgCO3·Mg(OH)2·4H2O的SEM图像如图2所示。由图可知,样品呈现分散性良好的多孔棒状晶体,多孔结构由纳米片紧密叠加形成,微棒长度为50.0 μm,直径为10.0 μm。

图2 4MgCO3·Mg(OH)2·4H2O的SEM图像
Fig.2 SEM image of 4MgCO3·Mg(OH)2·4H2O
2.2 前驱体4MgCO3·Mg(OH)2·4H2O分解率影响因素
2.2.1 焙烧温度的影响
前驱体4MgCO3·Mg(OH)2·4H2O在焙烧温度分别为650、 700、 750、 800 ℃的条件下焙烧3.0 h,考察焙烧温度对前驱体分解率的影响,前驱体分解率如图3所示。由图可知,4MgCO3·Mg(OH)2·4H2O分解率随温度升高呈现先增大先减小的变化趋势,在温度为700 ℃时分解率达到最大值99.98%;在温度为750 ℃时分解率最低,原因可能是焙烧时间相同,温度较低时,不利于4MgCO3·Mg(OH)2·4H2O分解转化[19],在温度为700 ℃时,4MgCO3·Mg(OH)2·4H2O焙烧完全,继续升温,分解率变化不大,因此,适宜的焙烧温度为700 ℃。
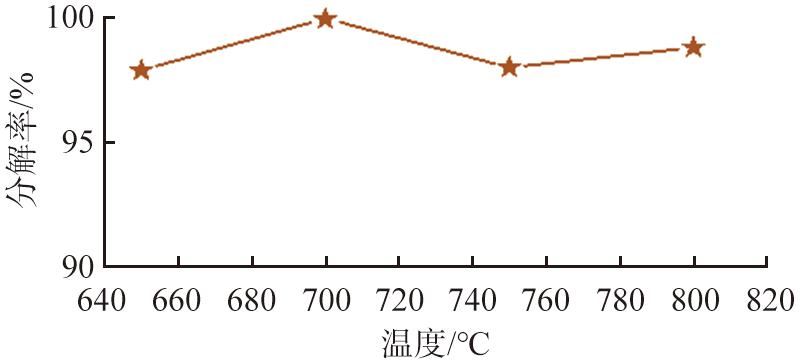
图3 不同焙烧温度下4MgCO3·Mg(OH)2·4H2O的分解率
Fig.3 Decomposition rate of 4MgCO3·Mg(OH)2·4H2O at different roasting temperatures
2.2.2 焙烧时间的影响
前驱体4MgCO3·Mg(OH)2·4H2O焙烧温度为700 ℃,焙烧时间分别为2.5、 3.0、 3.5、 4.0 h,研究焙烧时间对4MgCO3·Mg(OH)2·4H2O分解率的影响,前驱体分解率结果如图4所示。由图可知,随着焙烧时间延长,4MgCO3·Mg(OH)2·4H2O分解率呈现先增大后减小的变化趋势,在焙烧时间为3.0 h时,分解率达到最大值99.98 %。原因是焙烧温度相同时,焙烧时间过短,4MgCO3·Mg(OH)2·4H2O未全部转化为MgO;当焙烧达到一定时间时,4MgCO3·Mg(OH)2·4H2O转化完全,继续延长反应时间分解率无明显变化,因此,适宜焙烧时间为3.0 h。
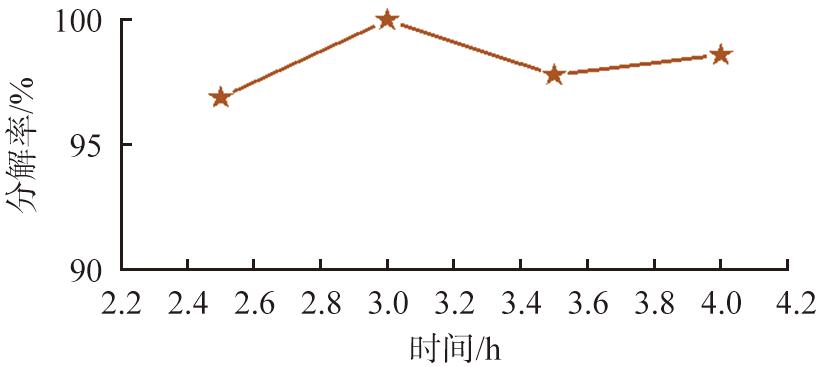
图4 不同焙烧时间下4MgCO3·Mg(OH)2·4H2O的分解率
Fig.4 Decomposition rate of 4MgCO3·Mg(OH)2·4H2O at different roasting times
2.3 MgO物相组成和形貌的影响因素
2.3.1 焙烧温度影响
在前驱体4MgCO3·Mg(OH)2·4H2O焙烧时间为3.0 h时,不同焙烧温度所得产物的XRD谱图和SEM图像如图5、 6所示。由图5可知,不同焙烧温度下所得产物全部衍射峰与MgO的XRD标准图谱(PDF#45-0946)一致,表明所得产物均为MgO晶体。由图6可知,不同温度下所得产物均为纳米片状堆叠而成的多孔棒状,但直径和长度有所不同。由图6(a)、 (b)可知,在烘焙温度升高时,产物平均直径由10.0 μm 增加为20.0 μm,而平均长度由50.0 μm减小至30.0 μm。由图6(b)可知,在焙烧温度为700 ℃时,产物中存在少量一端为光滑表面,而另一端被多孔结构覆盖的棒状晶体,具有光滑表面的部分平均直径为10.0 μm,而被多孔结构所覆盖的部分平均直径为20.0 μm,这种两端形貌不一致的棒状晶体平均长度为50.0 μm,由图6(c)、 (d)可知,进一步升高温度,产物形貌不再发生变化。
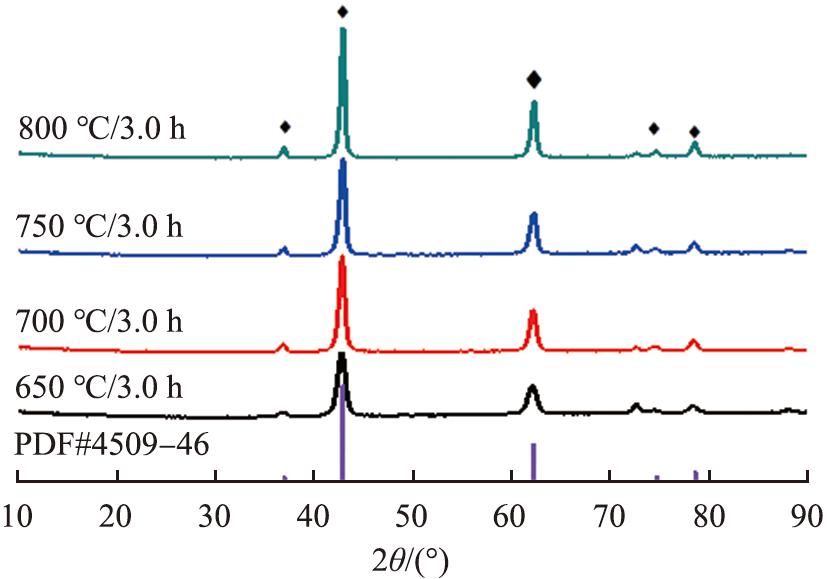
图5 不同焙烧温度下所得MgO的XRD图谱
Fig.5 XRD patterns obtained at different roasting temperatures
2.3.2 焙烧时间的影响
前驱体4MgCO3·Mg(OH)2·4H2O焙烧温度相同,不同焙烧时间所得产物的XRD谱图和SEM图像如图7、 8所示。 由图7可知, 保持相同焙烧温度为700 ℃, 在焙烧时间分别为2.5、 3.0、 3.5、 4.0 h时,晶面指数为(111)、 (200)、 (220)、 (331)、 (222)处的衍射峰均与MgO的XRD标准图谱(PDF#45-0946)一致,基底平滑,无杂峰。
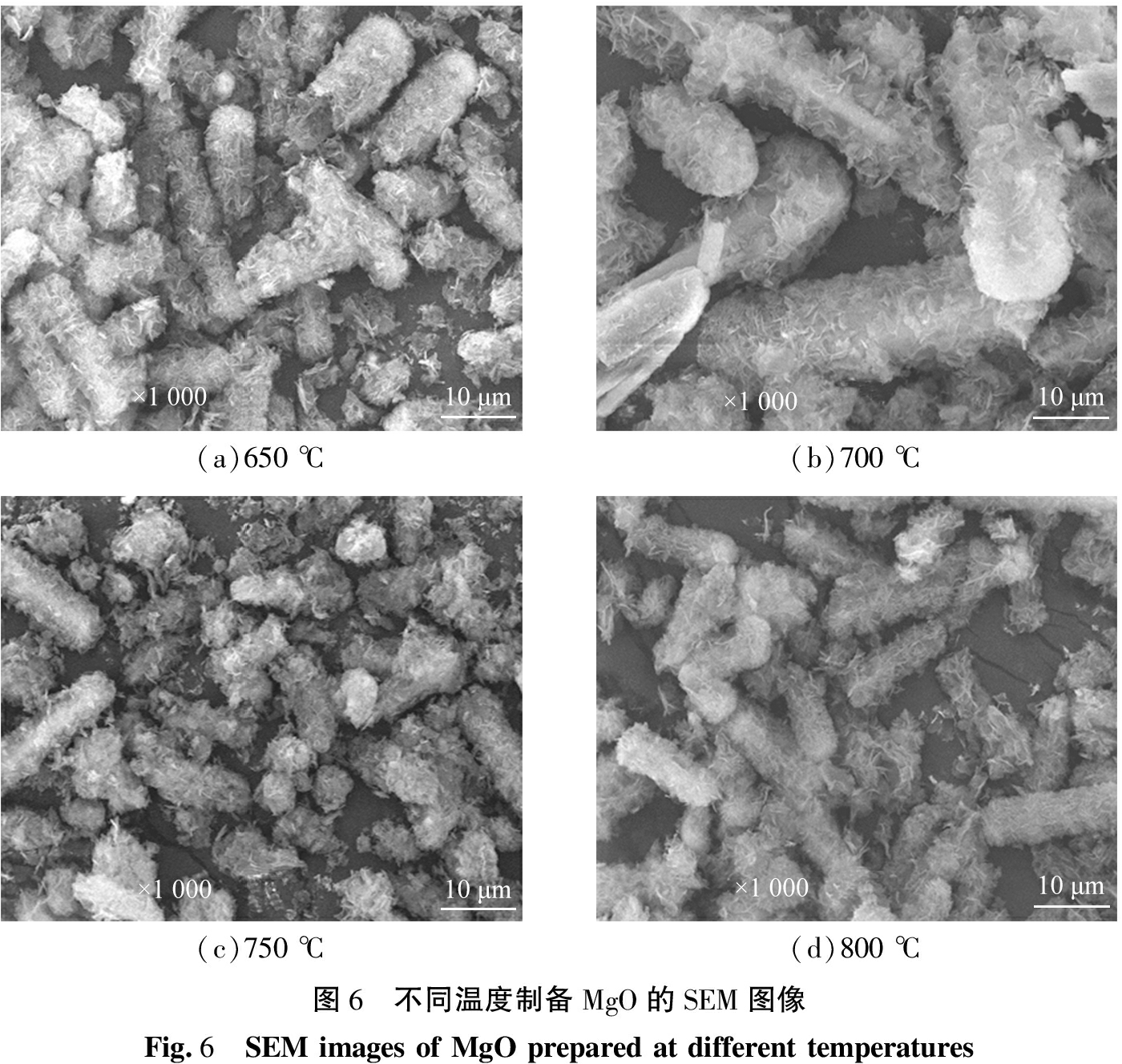
(a)650 ℃(b)700 ℃(c)750 ℃(d)800 ℃图6 不同温度制备MgO的SEM图像Fig.6 SEM images of MgO prepared at different temperatures

(a)3.0 h(b)4.0 h图8 不同焙烧时间制备的MgO的SEM图像Fig.8 SEM images of magnesium oxide at different roasting time
图7 不同焙烧时间下所得MgO的XRD图谱
Fig.7 XRD patterns obtained at different roasting times
由图8(b)可知,将焙烧时间延长为4.0 h,产物与图8(a)呈现出相同形貌的MgO晶体,被多孔结构覆盖部分平均直径仍保持20.0 μm,光滑部分平均直径仍保持10 μm,但平均长度减小为40.0 μm。
综上所述,制备MgO晶体最佳焙烧温度为700 ℃,时间为3.0 h。
2.3.3 MgO孔结构分析
固定焙烧温度为700 ℃, 时间为3.0 h, 制得MgO晶体, 采用Brunauer-Emmet-Teller法和Barret-Joyner-Halenda法分析比表面积、 孔隙体积和孔径分布, 结果如图9所示。 由图9(a)可知, MgO样品具有Ⅳ型等温线曲线, 且形成H3型回滞环, 可以认为是由片状粒子堆积形成的狭缝孔。 由图9(b)、 (c)可知, 孔径分布为2~50 nm, 表明样品具有介孔性质, 孔径主要集中于2~15 nm, 样品比表面积为76.17 m2/g。
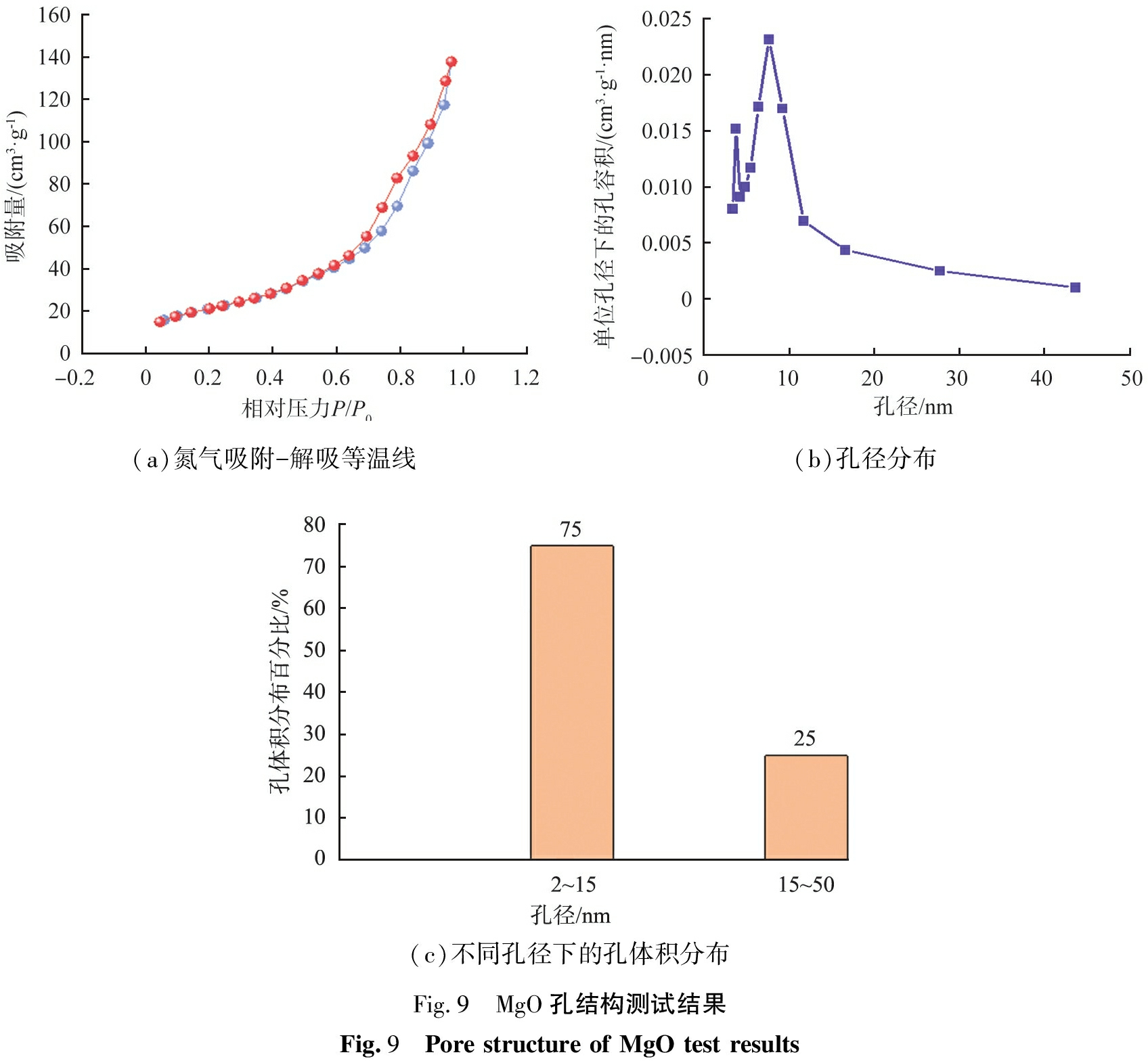
(a)氮气吸附-解吸等温线(b)孔径分布(c)不同孔径下的孔体积分布Fig.9 MgO孔结构测试结果Fig.9 Pore structure of MgO test results
2.4 MgCO3·Mg(OH)2·4H2O热分解过程
采用Diamond软件对4MgCO3·Mg(OH)2·4H2O的晶体结构进行模拟,结果如图10所示。由图可知,4MgCO3·Mg(OH)2·4H2O晶体结构的主体为Mg3通过边共享的Mg1和Mg2的[MgO6]八面体生长基元形成三菱结构。由图10(a)可知,这些三菱结构沿a轴和c轴通过[MgO6]八面体生长基元棱共享和![]() 基团共同连接。由图10(b)可知,沿b轴则通过
基团共同连接。由图10(b)可知,沿b轴则通过![]() 基团连接形成波浪条带。由图10(c)可知,Mg2+在4MgCO3·Mg(OH)2·4H2O中呈现2种不同的八面体配位,在Mg1和Mg2形成的[MgO6]八面体生长基元中,O原子分别来自4个
基团连接形成波浪条带。由图10(c)可知,Mg2+在4MgCO3·Mg(OH)2·4H2O中呈现2种不同的八面体配位,在Mg1和Mg2形成的[MgO6]八面体生长基元中,O原子分别来自4个![]() 基团、 1个—OH基团、 1个H2O分子;在Mg3形成的[MgO6]八面体生长基元中,O原子分别来自4个
基团、 1个—OH基团、 1个H2O分子;在Mg3形成的[MgO6]八面体生长基元中,O原子分别来自4个![]() 基团、 2个—OH基团。
基团、 2个—OH基团。
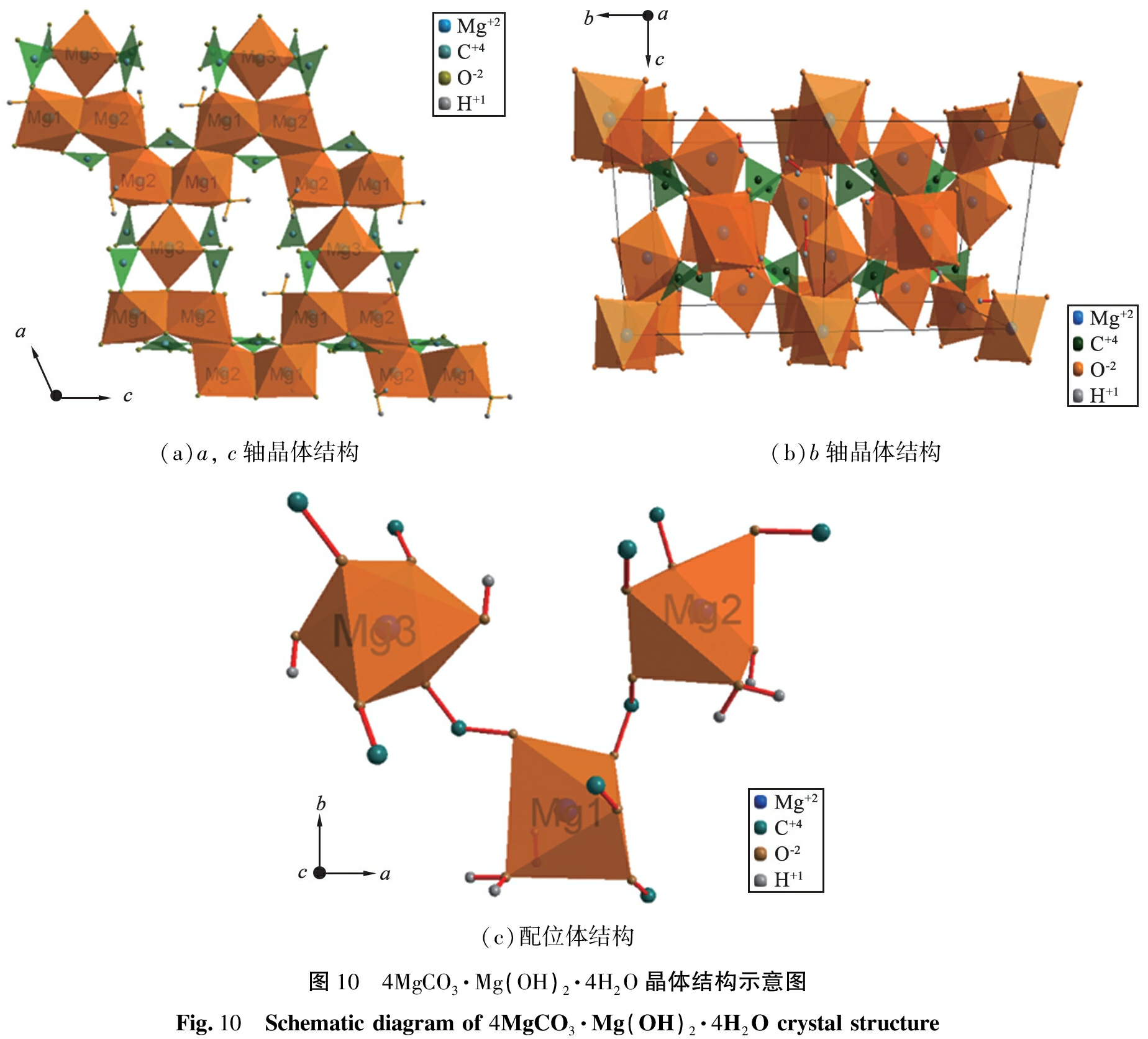
(a)a, c轴晶体结构(b)b轴晶体结构(c)配位体结构图10 4MgCO3·Mg(OH)2·4H2O晶体结构示意图Fig.10 Schematic diagram of 4MgCO3·Mg(OH)2·4H2O crystal structure
对4MgCO3·Mg(OH)2·4H2O进行热分析的结果如图11所示。由图可知,4MgCO3·Mg(OH)2·4H2O分解过程为4个分子结晶水从Mg1和Mg2位点的[MgO6]八面体中逸出, 理论失质量分数为15.45%。 根据热重(TG)曲线可以得出, 4MgCO3·Mg(OH)2·4H2O在温度为142~302 ℃时受热分解, 根据热重微分(DTG)曲线可以得出, 当温度为236 ℃时出现峰值, 表明该温度下失质量速率达最大值, 差示扫描量热法(DSC曲线)相应位置出现一个明显的吸热峰, 表明该分解过程吸热。 此过程的实际失质量分数为14.59 %, 其反应方程式为
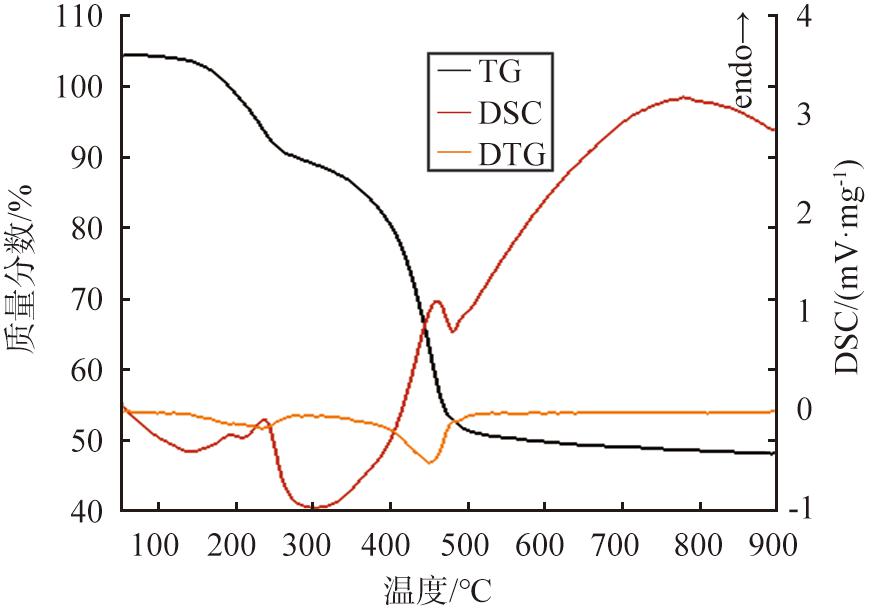
图11 4MgCO3·Mg(OH)2·4H2O热分析曲线
Fig.11 4MgCO3·Mg(OH)2·4H2O thermal analysis curves
4MgCO3·Mg(OH)2·4H2O→4MgCO3·Mg(OH)2+4H2O。
(5)
随着温度继续升高,各位点的羟基开始分离,形成水分子逸出,当温度达到一定值时,C—O键被破坏,形成CO2逸出,其理论失质量分数为41.49 %。根据TG曲线可以得出,在温度为306~483 ℃时,4MgCO3·Mg(OH)2继续分解,根据DTG曲线可以得出,在温度为458 ℃时出现峰值,表明该温度下失质量速率达到最大值,在DSC曲线相应位置出现一个明显的吸热峰,表明该分解过程吸热。此过程的实际失质量分数为39.86%,反应方程式为
4MgCO3·Mg(OH)2→5MgO+4CO2+H2O。
(6)
热分解过程中,4MgCO3·Mg(OH)2·4H2O快速调整分子结构,当所有结晶水逸出后,产物以无定型碳酸镁形式存在,随着温度进一步升高,C—O断裂,生成CO2逸出,MgO形成,4MgCO3·Mg(OH)2·4H2O结构崩塌;继续升温,生成的MgO纳米片开始自组装,形成表面由纳米片覆盖的多孔棒状。部分棒状区域由于MgO纳米片浓度相对较低,因此导致该区域无片状覆盖或覆盖量少。此过程的生长示意图如图12所示。
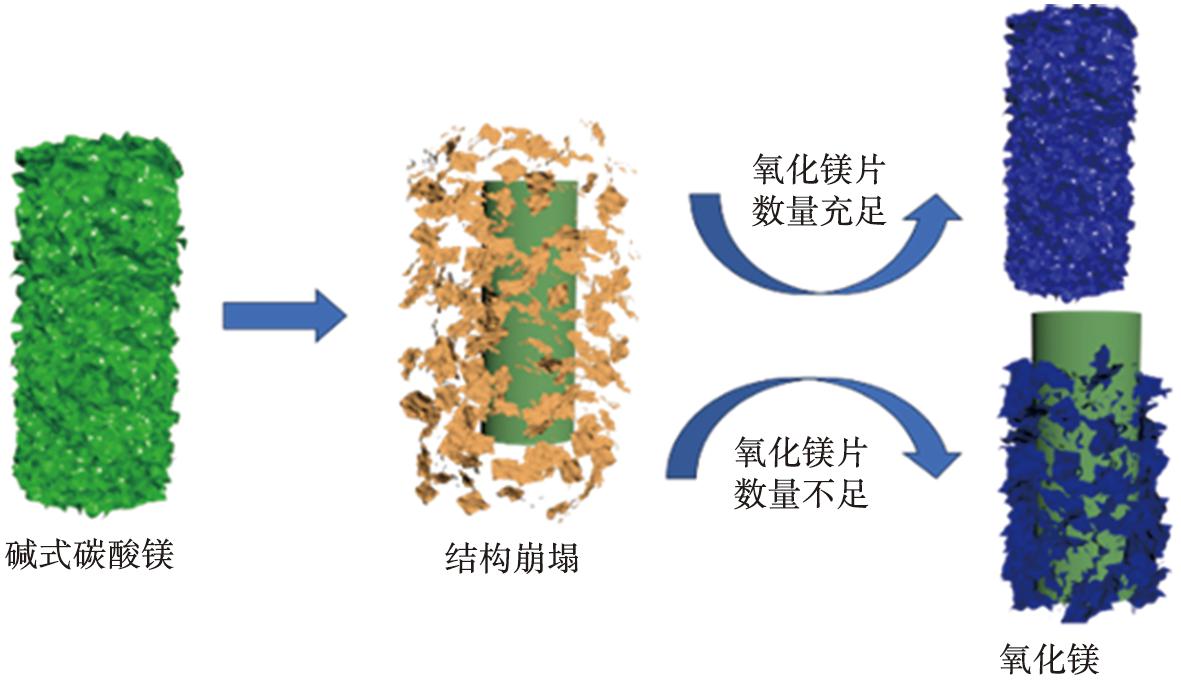
图12 MgO晶体的生长示意图
Fig.12 Growth diagram of MgO crystal
采用Jade软件对4MgCO3·Mg(OH)2·4H2O和MgO的XRD数据进行分析的结果如表1所示,采用Diamond软件对MgO的晶体结构进行模拟的结果如图13所示。
表1 4MgCO3·Mg(OH)2·4H2O和MgO晶体结构参数
Tab.1 4MgCO3·Mg(OH)2·4H2O CRystal structure parameters
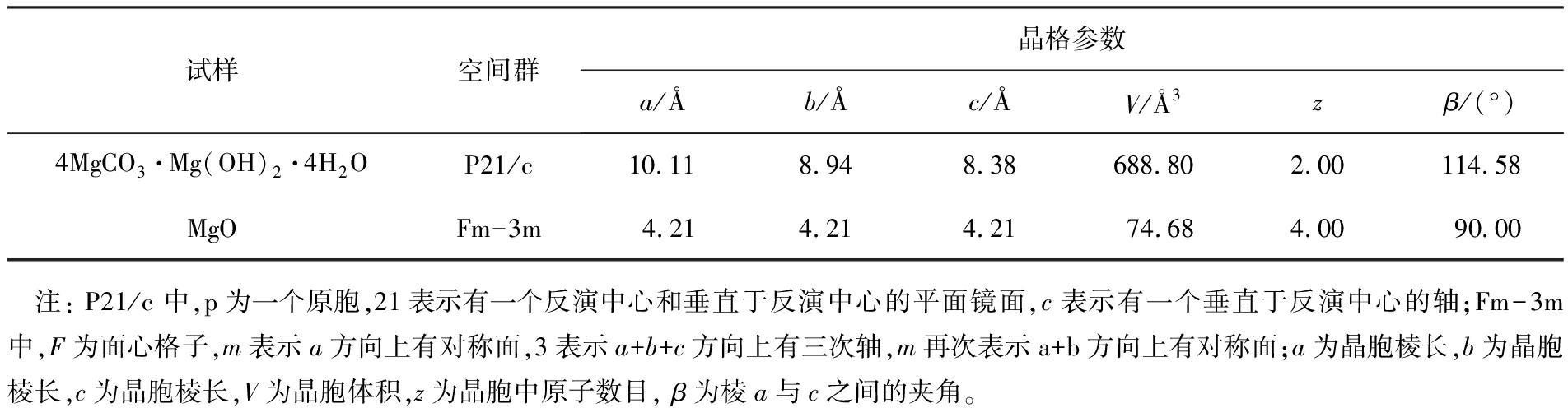
试样空间群晶格参数a/Åb/Åc/ÅV/Å3zβ/(°)4MgCO3·Mg(OH)2·4H2OP21/c10.118.948.38688.802.00114.58MgOFm-3m4.214.214.2174.684.0090.00 注: P21/c 中,p为一个原胞,21表示有一个反演中心和垂直于反演中心的平面镜面,c表示有一个垂直于反演中心的轴;Fm-3m 中,F为面心格子,m表示a方向上有对称面,3表示a+b+c方向上有三次轴,m再次表示a+b方向上有对称面;a为晶胞棱长,b为晶胞棱长,c为晶胞棱长,V为晶胞体积,z为晶胞中原子数目, β为棱a与c之间的夹角。
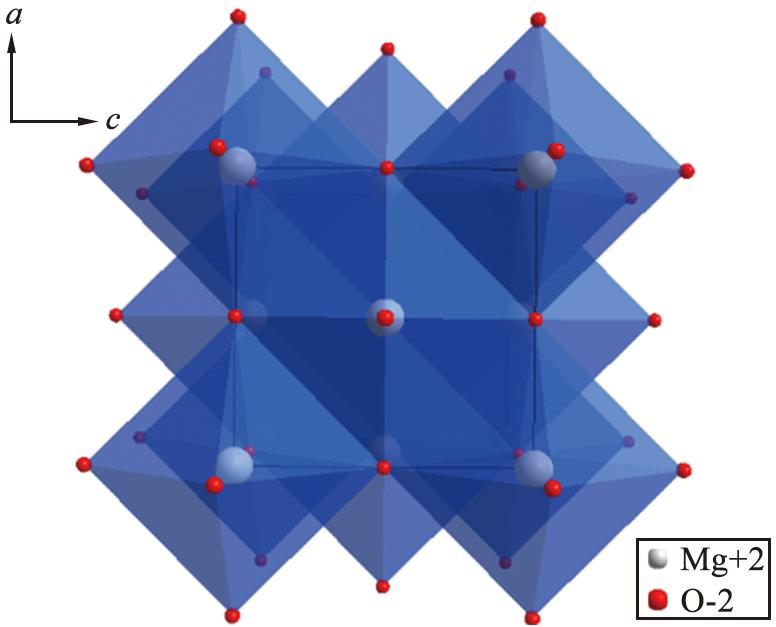
图13 MgO晶体结构示意图
Fig.13 Schematic diagram of MgO crystal structure
在4MgCO3·Mg(OH)2·4H2O热解过程中,随着温度升高,晶体晶格常数减小,当4MgCO3·Mg(OH)2·4H2O完全转变为MgO时,晶体结构空隙消失,故所制得MgO晶体晶粒尺寸减小。
根据Scherrer公式[20]计算前驱体4MgCO3·Mg(OH)2·4H2O和MgO样品的晶粒尺寸,所得结果如表2、 3所示。由表可知,前驱体4MgCO3·Mg(OH)2·4H2O的平均晶粒直径为51.92 nm,MgO样品的平均晶粒长度为11.28 nm,证明4MgCO3·Mg(OH)2·4H2O转变为MgO的过程中,晶粒直径减小。
表2 4MgCO3·Mg(OH)2·4H2O的晶粒尺寸
Tab.3 Grain size of 4MgCO3·Mg(OH)2·4H2O
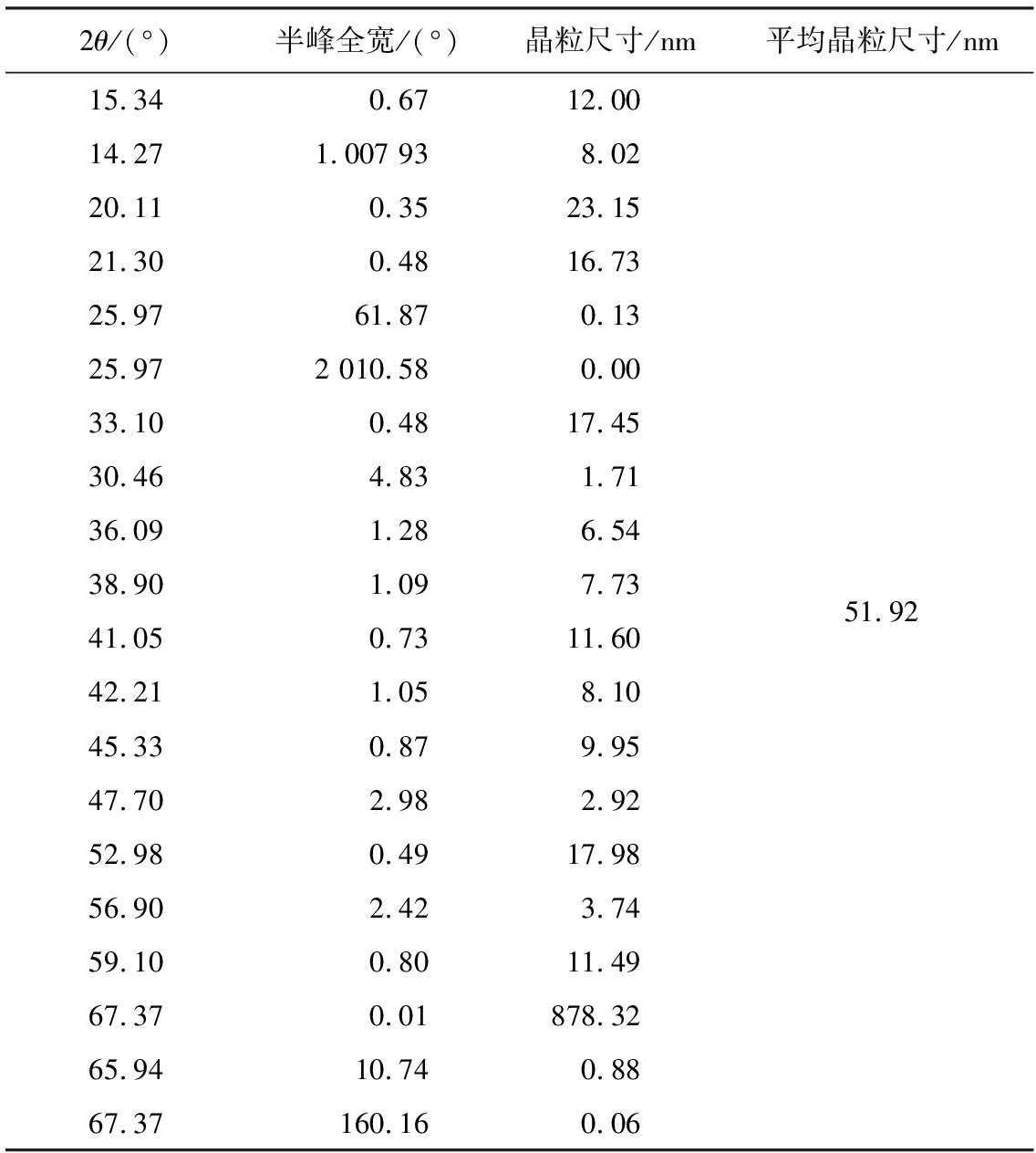
2θ/(°)半峰全宽/(°)晶粒尺寸/nm平均晶粒尺寸/nm15.340.6712.0014.271.007 938.0220.110.3523.1521.300.4816.7325.9761.870.1325.972 010.580.0033.100.4817.4530.464.831.7136.091.286.5438.901.097.7341.050.7311.6042.211.058.1045.330.879.9547.702.982.9252.980.4917.9856.902.423.7459.100.8011.4967.370.01878.3265.9410.740.8867.37160.160.0651.92
表3 MgO的晶粒尺寸
Tab.3 Grain size of MgO
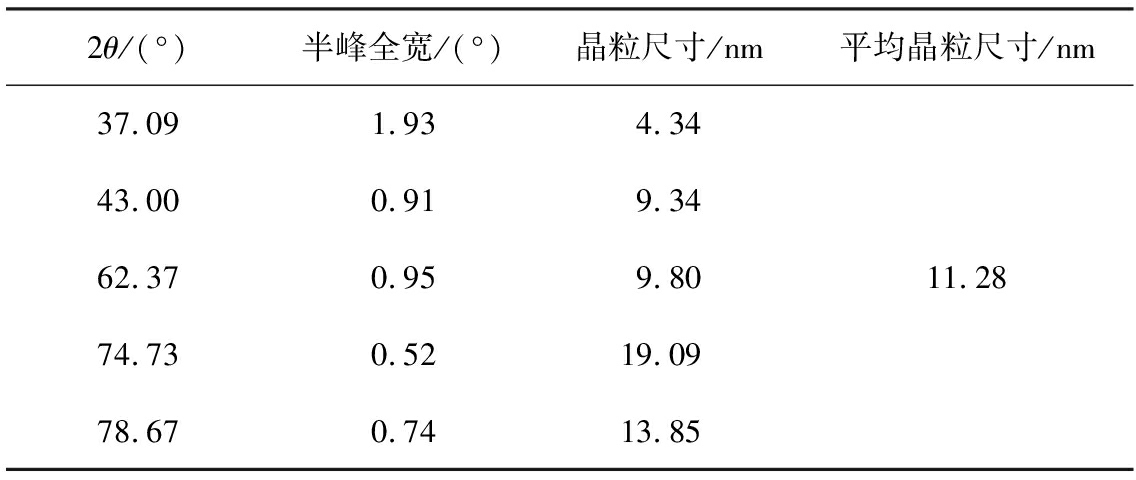
2θ/(°)半峰全宽/(°)晶粒尺寸/nm平均晶粒尺寸/nm37.091.934.3443.000.919.3462.370.959.8074.730.5219.09 78.670.7413.85 11.28
随着4MgCO3·Mg(OH)2·4H2O热分解进行,结晶水和CO2溢出,形成介孔孔隙,MgO晶粒尺寸减小,比表面积增大,活性位点增多,表面能提高,对临近的原子或分子产生吸附,颗粒之间发生团聚,从而导致MgO直径增大。
3 结论
1)以菱镁矿为初始原料,无外加辅助助剂,采用水化碳化-低温水溶液法,直接热解Mg(HCO3)2溶液获得平均直径为10.0 μm、 平均长度为50 μm的多孔棒状4MgCO3·Mg(OH)2·4H2O,并以此为前驱体,在焙烧温度为700 ℃、 时间为3.0 h时,获得最大分解率99.98 %、 比表面积为76.12 m2/g的介孔棒状MgO。同时分析了4MgCO3·Mg(OH)2·4H2O的热解机制为在结晶水失去时,—OH基团的分离和C—O键断裂将导致4MgCO3·Mg(OH)2·4H2O结构彻底崩塌,新生成的MgO纳米片高温下发生自组装,此过程中晶格常数减小,晶粒直径由51.92 nm减小至11.28 nm。
2)该MgO制备工艺可实现多孔MgO晶体的可控制备,且环保,无毒无害,有望提高菱镁矿附加值。
利益冲突声明(Conflict of Interests)
所有作者声明不存在利益冲突。
All authors disclose no relevant conflict of interests.
作者贡献(Author’s Contributions)
邓凤,王余莲,参与了论文的撰写,张一帆,李纪勋,关蕊,李克卿,苏峻樟,孙浩然,韩会丽,袁志刚,苏德生,池云参与了论文的修改。所有作者均阅读并同意了最终稿件的提交。
The manuscript was drafted and revised by DENG Feng and WANG Yulian. ZHANG Yifan, LI Jixun, GUAN Rui, LI Keqing, SU Junzhang, SUN Haoran, HAN Huili, YUAN Zhigang, SU Desheng, CHI Yun also participated in the revision of the manuscript. All authors read and agreed to submit the final manuscript.
[1]程文婷, 薄秋芳, 程芳琴, 等. 聚乙二醇辅助合成氧化镁及其处理含铅溶液的性能[J]. 中国科学: 化学, 2013, 43(11): 1490-1496.
CHENG W T, BO Q F, CHENG F Q, et al. Synthesis of magnesium oxide assisted by PEG-10000 and adsorption capacity for lead solution[J]. Scientia Sinica Chimica, 2013, 43(11): 1490-1496.
[2]田键, 刘洋, 胡攀, 等. 氧化镁在环境污染治理中应用研究进展[J]. 湖北大学学报(自然科学版), 2021, 43(1): 74-79.
TIAN J, LIU Y, HU P, et al. Research progress of application of magnesium oxide in environmental pollution control[J]. Journal of Hubei University (Natural Science), 2021, 43(1): 74-79.
[3]闫平科, 王万起, 马正先. 超细氧化镁粉体的制备新方法及应用[J]. 中国非金属矿工业导刊, 2009(6): 19-21.
YAN P K, WANG W Q, MA Z X. Research on the new preparing methods and application of micropowder magnesium oxide[J]. China Non-metallic Minerals Industry Herald, 2009(6): 19-21.
[4]易师甜. 纳米氧化镁的制备及抗菌性能研究[D]. 武汉: 华中科技大学, 2009.
YI S T. Preparation of nano-magnesium oxide and research on its antibacterial ability[D].Wuhan: Huazhong University of Science and Technology, 2009.
[5]赵嘉莘. 多孔MgO绒球的制备及其在热电池中的应用研究[D]. 绵阳: 西南科技大学, 2021.
ZHAO J S. Study on the preparation of porous MgO pompons and its application in thermal batteries[D]. Mianyang: Southwest University of Science and Technology, 2021.
[6]ZHAO J X, LIU J S, LI H Q, et al. Porous MgO pompons as a binder for the molten electrolyte applied in thermal batteries[J]. Ionics, 2021, 27(3): 1271-1278.
[7]李录. 多孔氧化镁/氢氧化镁的可控制备及重金属吸附性能研究[D]. 福州: 福建师范大学, 2021.
LI L. Controlled preparation and heavy metal adsorption properties of porous magnesium oxide/magnesium hydroxide[D]. Fuzhou: Fujian Normal University, 2021.
[8]BORGOHAIN X, BORUAH A, SARMA G K, et al. Rapid and extremely high adsorption performance of porous MgO nanostructures for fluoride removal from water[J]. Journal of Molecular Liquids, 2020, 305: 112799.
[9]AHMED S, GUO Y W, LI D Q, et al. Superb removal capacity of hierarchically porous magnesium oxide for phosphate and methyl orange[J]. Environmental Science and Pollution Research, 2018, 25(25): 24907-24916.
[10]康宁. 多孔球状活性MgO制备及除氟效能研究[D]. 沈阳: 沈阳建筑大学, 2022.
KANG N. Research on prepatation and defluorination of porous spherical activated MgO[D]. Shenyang: Shenyang Jianzhu University, 2022.
[11]何欣芮. 盐湖水氯镁石构筑不同形貌MgO及其染料吸附性能研究[D]. 西宁: 青海师范大学, 2023.
HE X R. Construction different morphologies of MgO from salt lake bischofite and study of dye adsorption properties[D]. Xining: Qinghai Normal University, 2023.
[12]夏勇亮. 轻烧白云石粉料制备氧化镁研究[D]. 北京: 北京化工大学, 2013.
XIA Y L. Research of megnesia preparation from light burning dolomite powder[D]. Beijing: Beijing University of Chemical Technology, 2013.
[13]仇龙, 李会杰, 黄娜娜, 等. 轻烧粉制备介孔氧化镁及其吸附性能的研究[J]. 沈阳化工大学学报, 2022, 36(3): 215-220.
QIU L, LI H J, HUANG N N, et al. Preparation and adsorption properties of mesoporous magnesium oxide from light burned powder[J]. Journal of Shenyang University of Chemical Technology, 2022, 36(3): 215-220.
[14]刘珈伊, 王余莲, 时天骄, 等. 菱镁矿气泡模板法制备三水碳酸镁晶体及其生长机理[J]. 矿产保护与利用, 2022, 42(2): 114-119.
LIU J Y, WANG Y L, SHI T J, et al. Preparation and growth mechanism of nesquehonite crystal crystals by bubble template method with magnesite[J]. Conservation and Utilization of Mineral Resources, 2022, 42(2): 114-119.
[15]王余莲, 印万忠, 李昂, 等. 热分解法制备三水碳酸镁晶须及其结晶动力学研究[J]. 矿产保护与利用, 2018(6): 107-113.
WANG Y L, YIN W Z, LI A, et al. Preparation and crystallization kinetics of nesquehonite whiskers with thermal decomposition method[J]. Conservation and Utilization of Mineral Resources, 2018(6): 107-113.
[16]王余莲, 印万忠, 张夏翔, 等. 三水碳酸镁法制备碱式碳酸镁过程研究[J]. 矿产保护与利用, 2017(4): 81-86.
WANG Y L, YIN W Z, ZHANG X X, et al. Preparation of hydromagnesite using nesquehonite method[J]. Conservation and Utilization of Mineral Resources, 2017(4): 81-86.
[17]刘珈伊, 王余莲, 时天骄, 等. 无水乙醇辅助低温直接法制备碱式碳酸镁晶体[J]. 中国粉体技术, 2021, 27(1): 41-49.
LIU J Y, WANG Y L, SHI T J, et al. Preparation of basic magnesium carbonate crystals with low temperature direct method by anhydrous ethanol-assisted process[J]. China Powder Science and Technology, 2021, 27(1): 41-49.
[18]李希艳, 张虹, 刘雪景, 等. 抑制性气氛中菱镁矿分解特性与动力学研究[J]. 无机盐工业, 2023, 55(10): 50-55.
LI X Y, ZHANG H, LIU X J, et al. Research on the decomposition characteristics and kinetics of magnesite in an inhibitory atmosphere[J]. Inorganic Chemicals Industry, 2023, 55(10): 50-55.
[19]戴卫东, 王寿武, 卢伯南. 碱式氯化镁烧结法制备氧化镁晶须的工艺研究[J]. 盐业与化工, 2009, 38(4): 19-22.
DAI W D, WANG S W, LU B N. Studies on the technology of preparing magnesium oxide whiskers wih basic magnesium chloride by sintering method[J]. Journal of Salt and Chemical Industry, 2009, 38(4): 19-22.
[20]孙赫男, 关岩, 毕万利, 等. 烧结氧化镁粉的晶体特征对磷酸镁水泥力学性能的影响[J]. 材料导报, 2022, 36(19): 91-96.
SUN H N, GUAN Y, BI W L, et al. The influence of crystal characteristics of sintered magnesium oxide powder on the mechanical properties of magnesium phosphate cement[J]. Materials Reports, 2022, 36(19): 91-96.