口服给药是最常用、 最方便的给药途径, 与其他给药途径(静脉、 肌肉、 皮下)相比, 具有安全性高、 避免疼痛和良好的患者依从性等优点, 然而因药物活性成分(active pharmaceutical ingredients, APIs)较差的水溶性而导致的低口服生物利用度是口服给药途径面临的主要挑战[1]。在药物研发过程中, 研究者尝试了各种克服候选药物水溶性差的方法, 包括成盐、 微粉化、 固体-脂质纳米粒、 纳米混悬剂和固体分散体(solid dispersions, SDs)[2-6]。 与另外几种技术相比, SDs技术简单、 快速、 成熟, 被认为是改善难溶性药物溶解性能最成功的策略之一。 广义来说, SDs是一种药物以分子状态、 胶态、 微晶或无定型(非晶)团簇状态分散在辅料(水溶性、 难溶性、 肠溶性材料)中的制剂中间体, 通过增强润湿性、 减小孔径、 增大表面积、 减少团聚、 提高孔隙率和无定型状态来改善难溶性药物的水溶性。
随着SDs技术的快速发展,研究人员开发和从其他领域引入了各种SDs制备技术。由于APIs和聚合物的物理化学特性复杂多变以及对制备技术的了解不够深入,因此如何选择合适的SDs制备技术一直在困扰着研究人员。
虽然自1989年以来已经有许多基于SDs技术的药物产品成功上市,但是目前对于SDs的质量控制仍存在一定的局限性。大多数研究人员在对SDs进行质量控制时,会重点关注产品中药物和聚合物之间的相互作用、溶出度,而忽视了SDs作为一种制剂中间体重要的粉体学性质,例如流动性、 可压性、 粒度分布,这些性质与下游加工的顺利进行和最终产品的质量密切相关,因此在对SDs进行质量控制时要给予粉体学性质足够的重视。本文中将对各种SDs制备技术的原理、优点和局限性进行综述,讨论在对SDs进行质量控制时需要关注的问题,旨在为SDs质量提升研究提供参考,助力生产出稳定、 有效的SDs产品。
1 制备技术
SDs的各种制备技术如图1所示。虽然SDs可以通过各种制备技术进行生产,但是它们形成的基本原理是一致的。首先将药物和载体混合均匀,然后通过将混合体系加热熔融或溶解在有机溶剂中以破坏药物的晶格结构,最后将系统快速冷却或干燥得到SDs。SDs的各种制备技术都源于熔融法、 溶剂法、 溶剂-熔融法、 机械分散法等方法。制造技术的变化对SDs特性(如粒径、 流动性、 可压性、 固态、 分子间相互作用)有着重大的影响。充分了解各种制备技术的应用现状并在此基础上选择合适的制备技术对于制备安全有效的SDs产品至关重要。本文中第1部分将对各种SDs制备技术的应用场景、 优点和局限性进行详细的讨论,此外通过查阅文献和专著对部分已上市SDs产品的信息进行总结并提供一套常用SDs制备技术选择方案,旨在助力研究人员快速选择合适的制备技术以生产出稳定、 有效的SDs产品。

图1 SDs制备技术
Fig.1 Preparation techniques for solid dispersions
部分已上市SDs产品信息如表1所示,常用SDs制备工艺选择决策树如图2所示。
表1 部分已上市SDs产品信息
Tab.1 Information of some marketed solid dispersion products
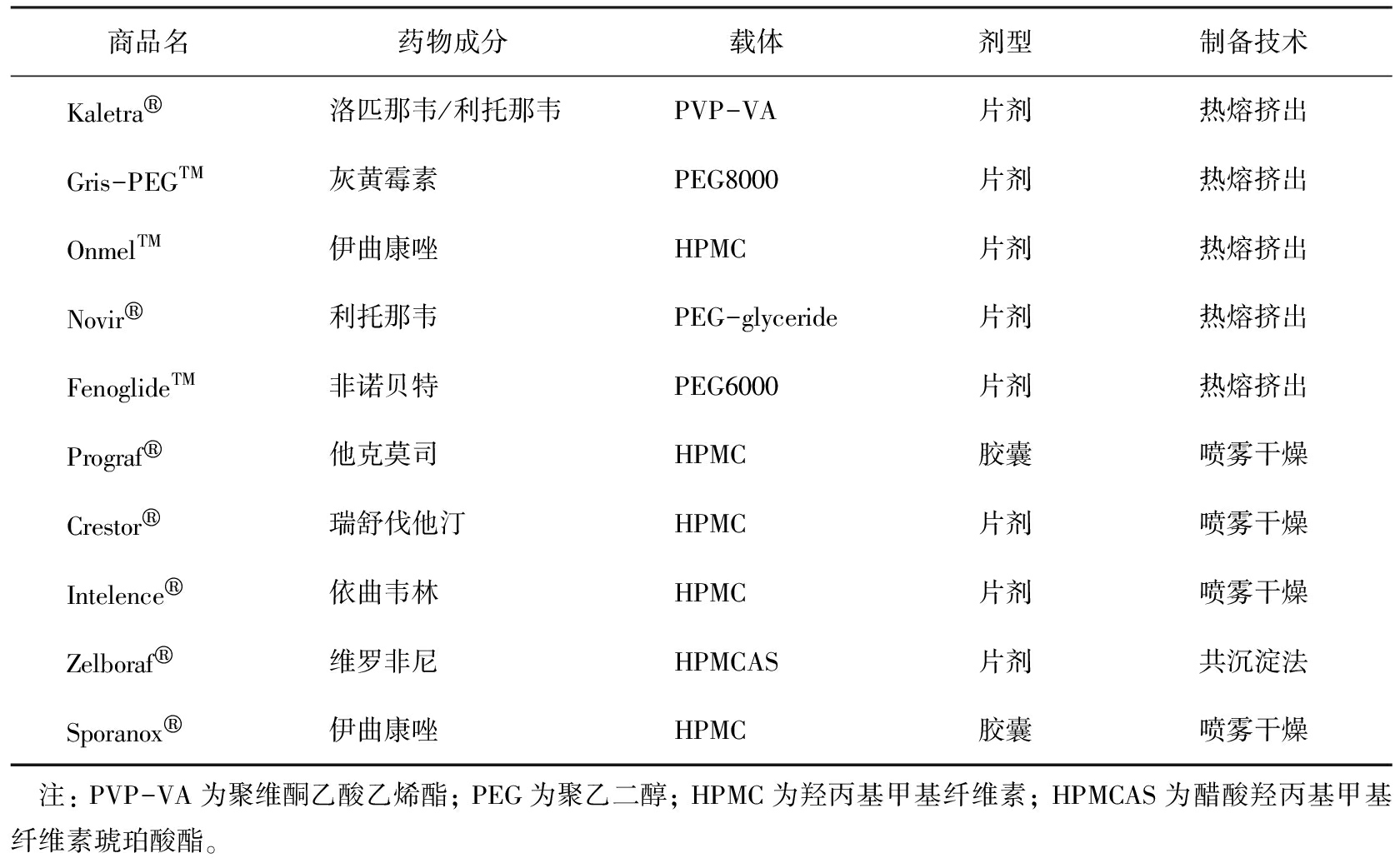
商品名药物成分载体剂型制备技术Kaletra®洛匹那韦/利托那韦PVP-VA片剂热熔挤出Gris-PEGTM灰黄霉素PEG8000片剂热熔挤出OnmelTM伊曲康唑HPMC片剂热熔挤出Novir®利托那韦PEG-glyceride片剂热熔挤出FenoglideTM非诺贝特PEG6000片剂热熔挤出Prograf®他克莫司HPMC胶囊喷雾干燥Crestor®瑞舒伐他汀HPMC片剂喷雾干燥Intelence®依曲韦林HPMC片剂喷雾干燥Zelboraf®维罗非尼HPMCAS片剂共沉淀法Sporanox®伊曲康唑HPMC胶囊喷雾干燥 注: PVP-VA为聚维酮乙酸乙烯酯; PEG为聚乙二醇; HPMC为羟丙基甲基纤维素; HPMCAS为醋酸羟丙基甲基纤维素琥珀酸酯。
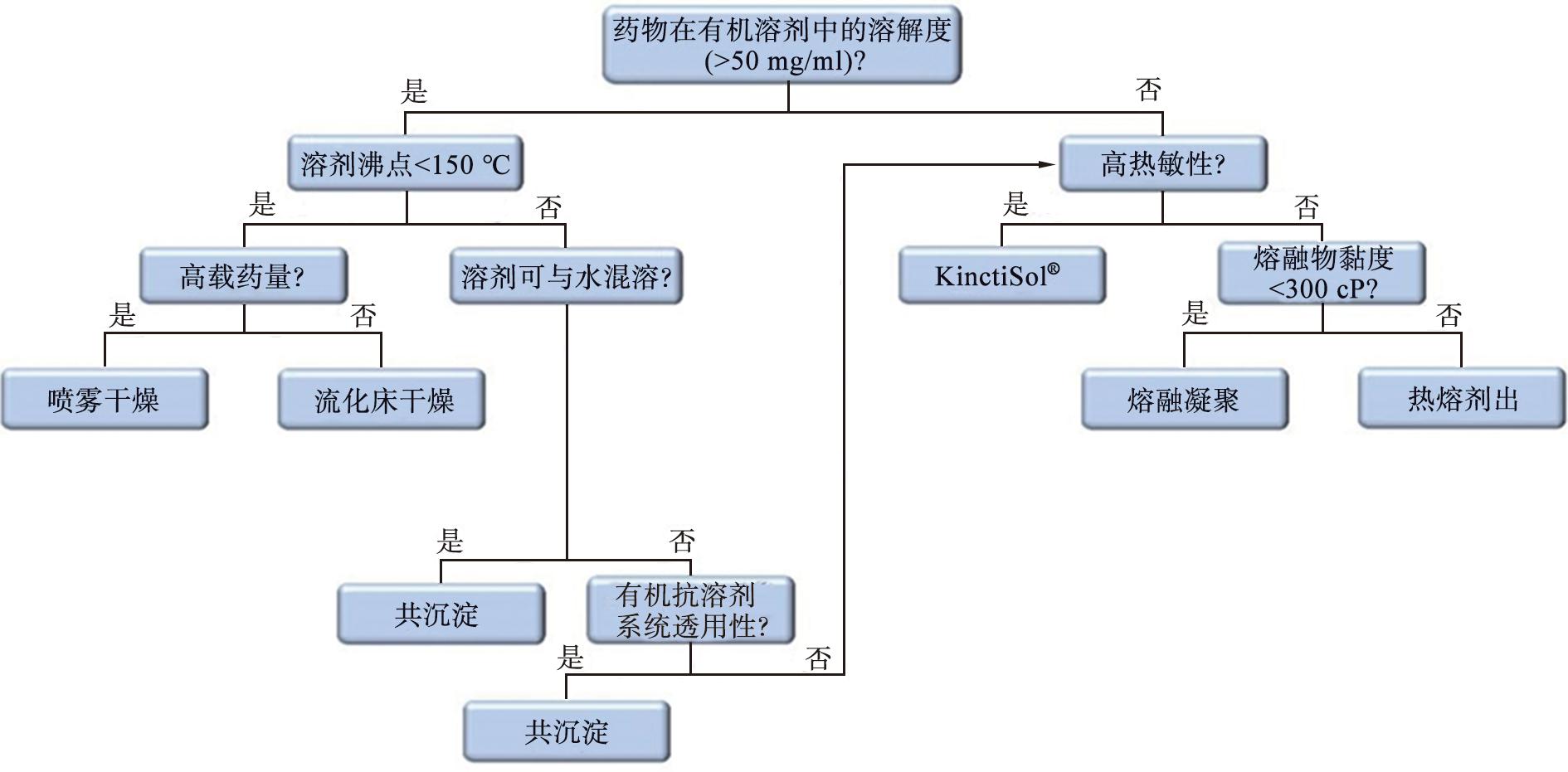
图2 常用固体分散体制备工艺选择决策树[7-8]
Fig.2 A method selection decision tree with the commonly used preparation techniques of SDs
1.1 熔融法
熔融法是指首先将药物溶解在无定形聚合物的熔融物中,然后熔融产物通过冷却固化产生无定形SDs的过程。熔融法的主要优点是无需使用有机溶剂,不存在有机溶剂残留所导致的潜在毒性问题,有效避免了SDs在保质期内可能发生的与溶剂相关的稳定性风险[7-8]。由于制备过程中存在的高温处理步骤,因此该方法对原料药和聚合物有一定的要求,即原料药物必须是热稳定的,聚合物的熔点或玻璃化转变温度不能太高,并且需要具有一定的热塑性。常用于熔融法的载体有聚乙烯吡咯烷酮类聚合物、 聚乙烯己内酰胺-聚醋酸乙烯酯-聚乙二醇接枝共聚物。熔融法还要求药物在载体中具有足够的溶解度或混溶性,相容性较差的药物和载体制备的SDs具有较差的增溶效果和更大的药物重结晶风险[9]。Fox方程、 Gordon-Taylor方程、 Flory-Huggins理论、 汉森溶解度参数法常被用来判断药物和载体的混溶性[10-12]。
1.1.1 传统熔融法
剧烈搅拌熔融物或将熔融物倾倒在不锈钢板上是传统熔融法迅速冷却固化熔融物以获得SDs的常用手段。有时也会选择将粉碎好的药物加入预先加热熔融的载体材料中,这样可以有效避免可能的药物热降解。传统熔融法具有操作简单、 无需有机溶剂的优点,常用于少量SDs的制备,这种方法面临的问题是药物的热降解和只能使用具有较低熔点的载体。潘虹等[13]采用熔融法制备了甘草次酸SDs,与原料药相比,甘草次酸SDs的溶解性能有了明显的提高。
1.1.2 热熔挤出法
热熔挤出技术 (hot melt extrusion, HME)[1]是熔融法制备SDs的代表技术之一, 最初用于塑料和食品加工业, 近年来逐渐发展成为最受欢迎的SDs连续制造工艺[14]。 HME是将活性药物、 功能性辅料和加工助剂混合后, 在挤出机中经过熔化、 混合和脱挥发一系列步骤后, 以一定的压力、 速度和温度从模具中挤出的过程[15]。 这项技术十分符合现代制药行业注重速度和效率的理念, HME可以通过使用不同几何形状和尺寸的模具来制备片剂、 颗粒、 胶囊和口溶膜[16]。在高温熔融和螺杆剪切的作用下,难溶性原料药发生了物理状态的改变,并在分子水平上高度分散于载体材料中,因此采用HME技术生产的制剂往往具有优异的溶解性能和生物利用度。HME技术为SDs的开发提供了几个优点,包括无需溶剂、 混合均匀、 掩味以及具有规模化和连续化生产的潜力,并且它可以制备具有控制、 修饰、 持续和靶向释放特性的制剂[17-18]。与其他熔融技术相比,该技术具有较短的停留时间,在一定程度上降低了热敏性药物降解的风险。Li等[19]采用HME技术制备了以掩味聚合物为载体的阿奇霉素SDs,不仅大幅度增加了阿奇霉素的溶解度,而且有效地掩蔽了药物的苦味。HME技术还可以与过程分析技术(process analytical technology, PAT)相结合, 以加深研究人员对工艺本身的理解, 实现产品的在线质量控制[20-22]。 HME也存在着一定的局限性,如不适合处理高熔点的APIs和高黏性聚合物,过高的操作温度、 剪切应力、 剪切速率和较长的停留时间可能会导致原料药的热降解。仪器的快速和有效清洁也一直限制着HME技术的发展。
基于HME原理的MeltrexTM是一种获得专利的SDs制备技术,MeltrexTM工艺示意图如图3所示。特殊的双螺杆挤出机和2个独立的料斗构成的连续输送挤出系统,可以有效减少药物在HME机中的停留时间,从而最大限度地避免药物热降解[23]。已于2005年上市的抗艾滋病药物Keletra®就是基于该技术成功制备的商业化SDs产品。
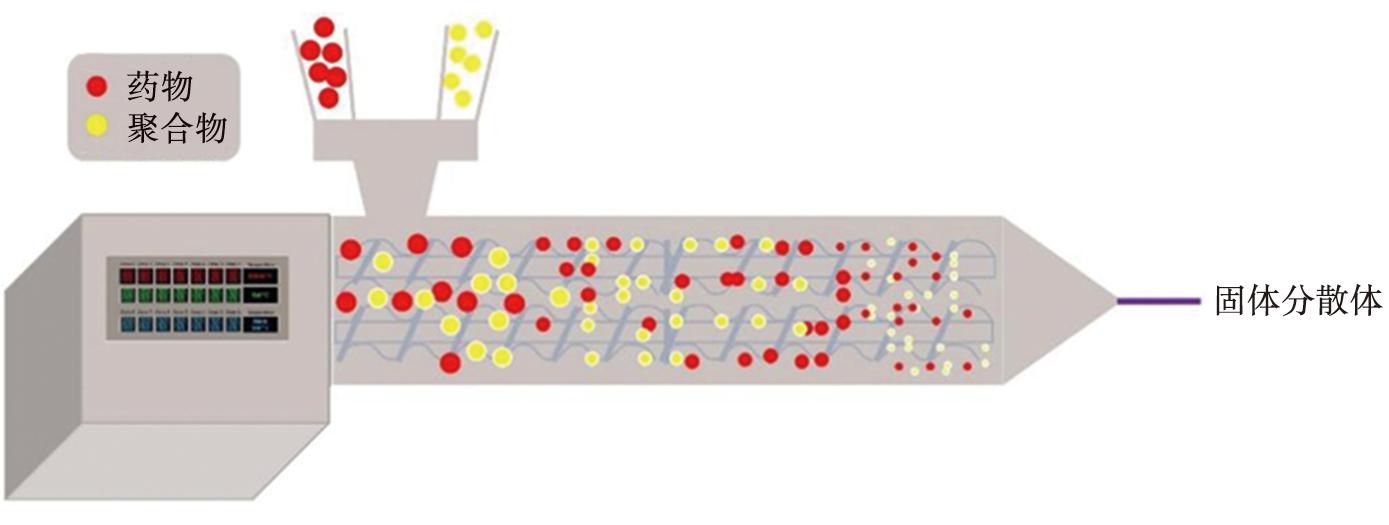
图3 MeltrexTM工艺示意图
Fig.3 Schematic illustration of the MeltrexTM process
1.1.3 熔融凝聚
熔融凝聚法是另外一种具有工业可行性的熔融法,如果药物和载体的熔融混合物具有较低的黏度,就可以考虑使用这种方法[8]。在该方法中,熔融的聚合物或药物和聚合物的熔融混合物替代了聚合物溶液来充当造粒过程的黏合剂,避免了溶剂残留可能会导致的潜在稳定性问题,并省去了额外的干燥步骤。Seo等[24]基于熔融凝聚法在高剪切混合器中制备了地西泮SDs的附聚物,较低的药物浓度就可以获得较高的溶出速率。在另一项基于熔融凝聚法的研究中,流化床被用作熔融造粒设备来生产SDs[25]。流化床与高剪切混合器相比具有更精准的温度控制和更简化的造粒过程。旋转式加工机也被证明能够替代高剪切混合器来制备SDs,它允许研究人员更容易地控制温度和添加更多的黏合剂[26]。然而与其他熔融法类似,较高的工艺温度限制了它在热敏性药物中的应用。可供该过程使用的载体较少也限制了这种方法的推广应用。
1.1.4 KinetiSol® Dispersing(KSD)
KSD技术过程示意图如图4所示,材料在一个封闭的固定容积室中进行处理,固定容积室外安装有实时温控单元,室内包含变速驱动器、高速旋转轴和以高径向速度旋转的新型混合元件。它通过一系列高速旋转的桨叶所产生的热能和动能来处理药物和亲水性聚合物以制备SDs,而无需外部热量的输入[27]。这项技术的主要优势是加工时间极短,整个过程的持续时间通常小于20 s,原料药暴露在高温下的时间甚至短至5 s。与其他热处理工艺相比,KSD技术处理的药物具有最小的热降解可能性[28]。Dinunzio 等[29]分别通过KSD和HME制备了羟丙甲基纤维素-伊曲康唑SDs,KSD可在15 s内将结晶型APIs转变成无定型状态,而HME则需要300 s以上。它具有良好的加工能力,可以在不加入任何增塑剂的情况下直接制备以高熔点和高黏度聚合物为载体的SDs。有研究表明,与同样基于熔融原理的HME相比,KSD制备的SDs的结晶药物和杂质更少[30]。这项技术面临的主要问题是超过一定限度的机械能可能会导致药物的降解,因此研究人员需要仔细考虑工艺参数,必要时进行实验设计,以探究关键工艺参数和产品关键质量属性之间的关系,从而最终获得稳定、 有效的产品。
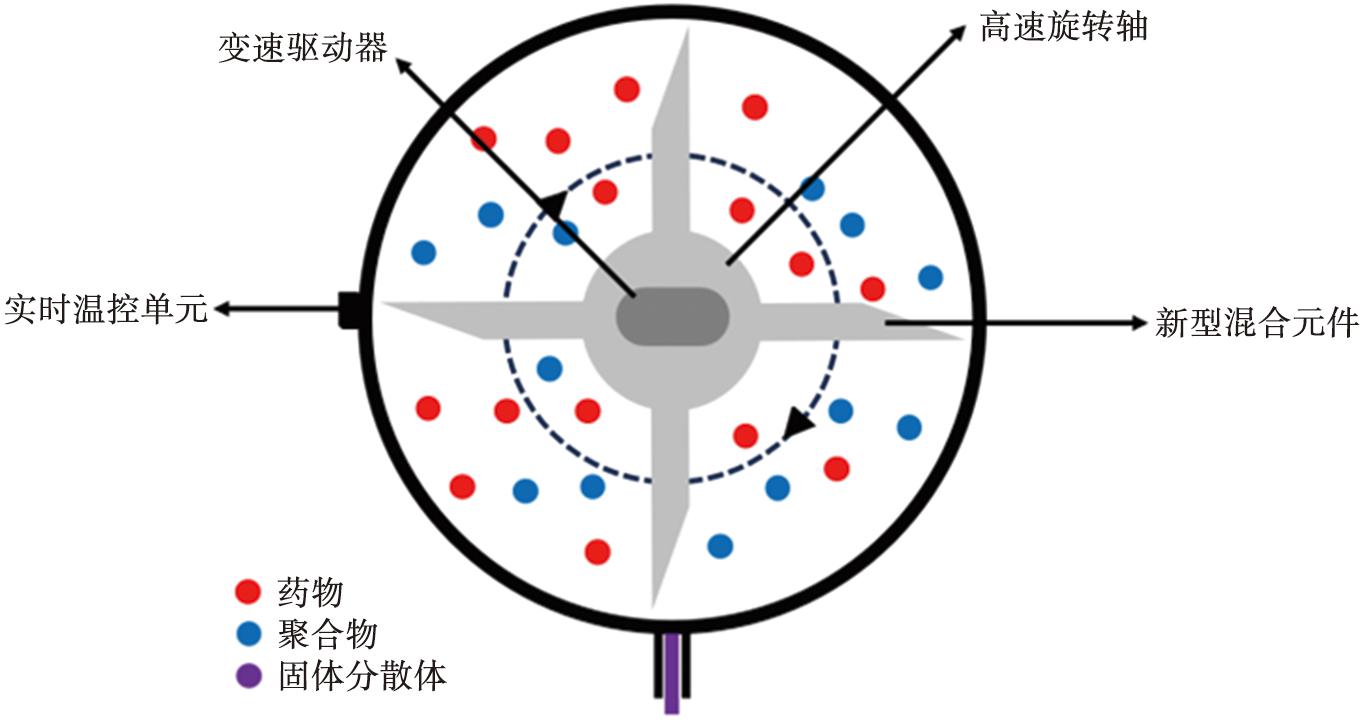
图4 KSD技术过程示意图
Fig.4 Schematic representation of process in KinetiSol® technology
1.1.5 3D打印技术
3D打印技术 (three-dimensional printing, 3DP)是一种具有高成本效益和灵活性的新兴药物制备技术,可以通过增材制造将3D计算机模型转化为实物[7]。基于挤出技术的熔融沉积成型 (fused deposition modeling, FDM) 3D打印常被用来制备SDs。FDM 3D打印技术过程示意图如图5所示。FDM 3DP通常与HME结合成一个集成的连续处理平台,药物和聚合物的混合物在HME机提供的热能和机械能的作用下被挤成具有一定可塑性的熔融材料,然后材料从3D打印机的喷嘴处挤出,在构建板上冷却固化成所需形式[31-32]。这种组合技术减少了传统剂型相关的下游加工(研磨、 造粒、 压片),为药品生产提供了个性化和定制剂型的优势[33]。FDM 3D打印机中使用的热塑性材料需要以细丝形式存在,然而,目前只有HME技术能够提供具有可靠性能的载药细丝[34],因此探索新的载药细丝生产技术将极大程度推进这项技术的发展。该技术的缺点是对使用的药物和赋形剂的限制,因为载药细丝需要足够的热和机械性能来满足打印的需求,所以研究和开发适用的聚合物载体是该技术能够进一步推广应用的关键。
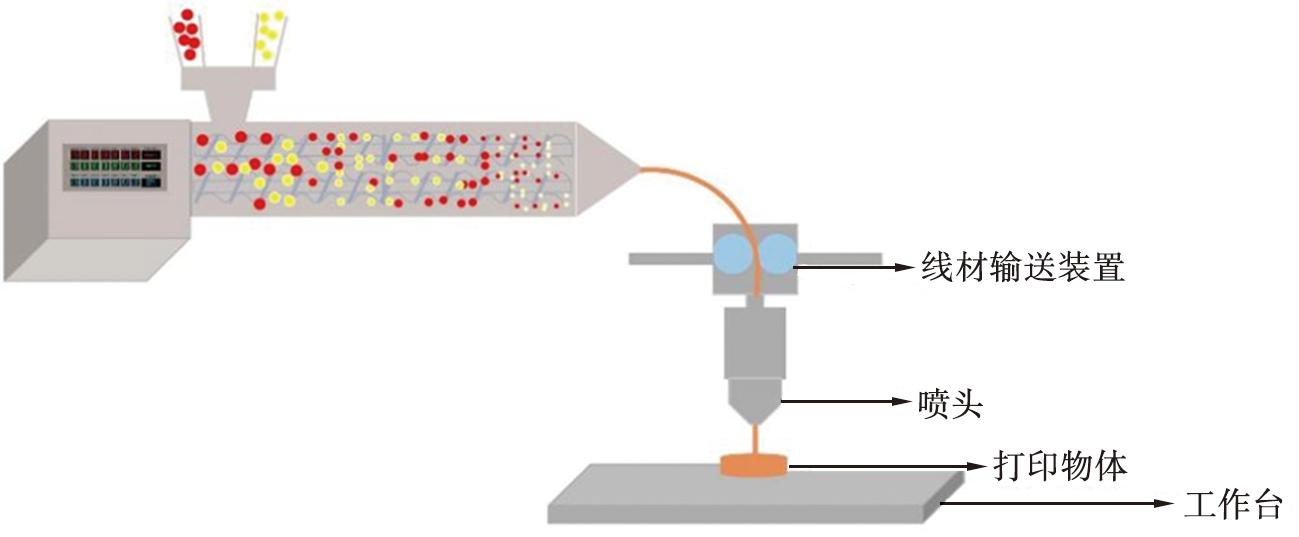
图5 FDM 3D打印技术过程示意图
Fig.5 Schematic representation of FDM 3D technology process
1.2 溶剂法
溶剂法也称共沉淀法或者共蒸发法。通常将处方比例的药物和载体溶解于一种有机溶剂中,有时也会将二者分别溶于有机溶剂后再混合均匀,然后将有机溶剂除去从而得到SDs。在溶剂的除去过程中,药物和载体之间的非共价分子相互作用,例如氢键,诱导了无定型产物的形成[35-36]。溶剂法的操作温度较低,适用于热不稳定、 易挥发、 熔点高的物质。面临的问题是制备时间较长和有机溶剂残留,残留的溶剂一方面可能会毒害人类身体健康,另一方面可能会诱导无定型药物重结晶。购买有机溶剂和溶剂去除设备所带来的高额成本会加重药企的经济负担。
1.2.1 传统溶剂蒸发法
传统溶剂蒸发法是最实用的实验室制备SDs的方法,通常采用旋转蒸发仪在真空环境下去除有机溶剂[37],有时也会使用水浴锅和蒸发皿来蒸发溶剂。该方法的优点是简单易行和较低的相分离风险[23]。面临的问题是溶剂蒸发速率较慢, 产物收集困难和低可扩展性。此外收集到的产品并不能直接用于压片和装填胶囊,需要经过研磨、 粉碎、 造粒等后处理过程,然而该过程中产生的机械能和热能可能会导致SDs出现潜在的稳定性问题。
1.2.2 喷雾干燥法
喷雾干燥技术凭借极快的溶剂去除效率已经逐渐成为最受欢迎的SDs制备技术之一,大部分已上市的SDs产品都是采用该技术制备的。在这项技术中,药物和载体的溶液或悬浮液被泵送至干燥室的喷嘴处雾化产生液滴,干燥室中产生的热空气会在几秒钟内干燥雾化液滴以生成SDs粉末[38]。在实际生产中,研究人员常致力于尽可能低的溶剂残留量,因此喷雾干燥后的二次干燥是必须的步骤。在喷雾干燥过程中,研究人员通过调节配方(溶剂、 原料药和辅料的比例)和工艺参数(进料流量、 进料温度)可以有效地控制产品的特性和性能,合适的处方和工艺参数可以有效地避免相分离和重结晶的风险。由于操作温度较低,因此喷雾干燥技术可有效避免药物的热降解[39]。喷雾干燥技术具有生产工艺易放大的优势,Sawicki等[40]研究发现,喷雾干燥技术展现出比冷冻干燥技术更优秀的可扩展性,与冷冻干燥技术生产的SDs相比具有更好的溶解性能。可是,通过这项技术制备的SDs通常具有低堆积密度和较差的流动性,这可能会影响下游加工的顺利进行和最终产品的质量。该技术面临的另一问题是药物和载体在进料溶液中可能存在较大的溶解度差异,导致最终生成不均匀的SDs[41-42]。物料在设备壁上的黏附问题以及防爆问题也在限制着这项技术的发展[8]。
1.2.3 冷冻干燥法
冷冻干燥法包括冷冻和冻干2个步骤,首先将含有药物和载体的溶液或者悬浮液冷冻起来,然后通过降低冷冻液周围压力使样品中的水和溶剂发生固气转化,从而除去有机溶剂得到SDs[43-44]。冷冻干燥法属于连续工艺,生产效率较高并且具有实现规模化生产的潜力。很明显,采用该方法制备SDs可有效避免药物的氧化、 分解以及热降解。研究表明,用冷冻干燥法制备的SDs具有相分离风险小、 结构疏松和表面积大的特点。冷冻干燥法面临的主要问题是可供选择的溶剂种类非常有限,大部分有机溶剂的冷冻温度很低且升华过程中仍然保持冻结,常用的溶剂仅有叔丁醇、 甲醇、 乙腈。较长的循环周期和高额的生产成本也阻碍了该方法的推广应用[45]。
为了提高冷冻速率, 缩短SDs生产周期, 研究人员开发了更加高效的冷冻干燥技术, 包括喷雾冷冻干燥技术(spray freeze drying, SFD)和超快速冷冻技术(ultra-rapid freezing, URF)。 SFD能够使药物和载体以最快的速度玻璃化, 从而有效降低了药物和载体相分离的风险, 制备出的SDs具有较大的比表面积、低密度和长期稳定性。 Van等[46]分别采用喷雾干燥和SFD制备了四氢大麻酚SDs, 研究结果表明, 采用SFD制备的SDs中的药物具有更好的稳定性, 其原因是更快的冷却速率使更多药物与基质结合。
1.2.4 流化床干燥法
流化床干燥法是一种具有工业可行性的SDs制备技术,流化床技术示意图如图6所示。根据不同的流化床工艺,采用该方法制备的SDs可以分成2种,分别是底喷工艺制备的固体分散颗粒(solid dispersion granules, SDGs)以及顶喷工艺制备的固体分散微丸(solid dispersion pellets, SDPs)[47-50]。与喷雾干燥法相似,流化床干燥法可以使药物由结晶状态转化为无定型状态以及使药物和聚合物在分子水平上发生相互作用。与喷雾干燥法、HME法和共沉淀法制备的SDs相比,采用顶喷工艺制备SDGs具有优异的流动性、 可压性。SDGs可以直接进行压片或者装填胶囊而无需额外的下游加工步骤,不仅缩短了产品生产周期,而且大大减少了后处理过程中潜在的SDs稳定性问题。采用底喷包衣工艺制备的SDPs是一种结合了SDs和微丸优势的多单位剂型。研究人员可以通过改变进料溶液的量轻松改变药物装载量以及通过包衣或单位组合调整药物释放,为市场提供能够满足各种患者需求的产品[50-51]。口服给药后,SDPs可以均匀地扩散到整个胃肠道,从而减轻局部胃肠道副作用,并降低单位剂型引起的剂量倾倒风险[52]。研究人员还可以将额外的赋形剂包覆在SDGs或者SDPs上以达到控制释放曲线和增强稳定性的目的[53-55]。采用流化床干燥法制备的同时具有优异溶解性能和流动性的SDGs或者SDPs无疑是传统SDs的理想替代品;然而与其他基于溶剂法的SDs制备工艺相似,流化床干燥法也面临着溶剂残留的问题,因此研究人员通常会在产品制备结束后进行二次干燥以最大限度减少溶剂残留。
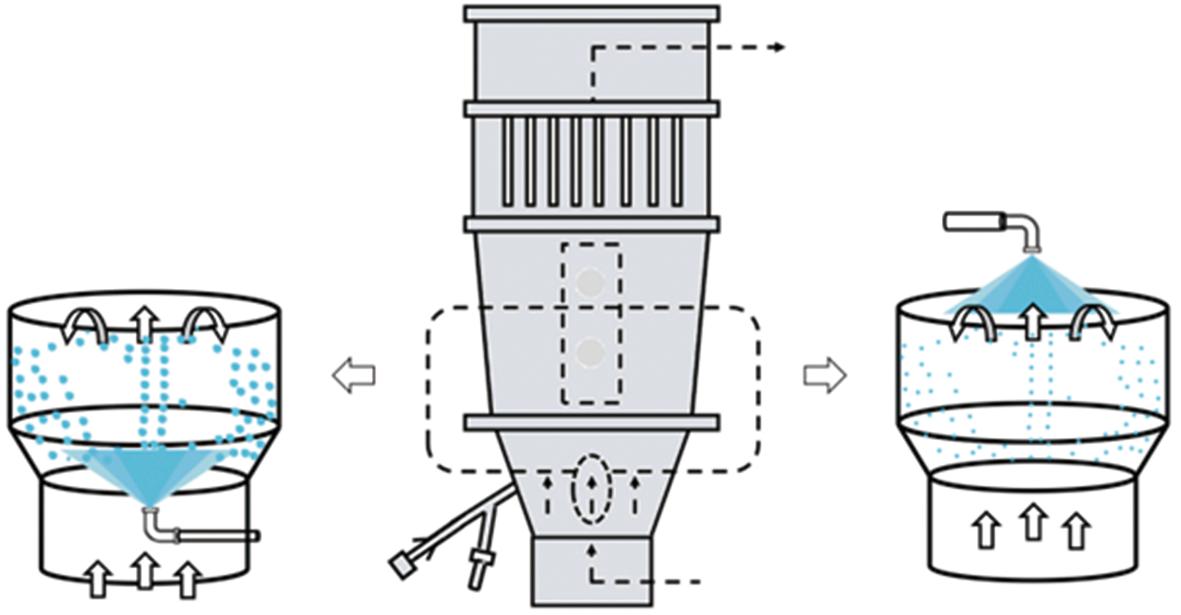
图6 流化床技术示意图
Fig.6 Schematic illustration of fluidized bed technology
1.2.5 超临界流体法
超临界流体(supercritical fluids, SCFs)法是指在临界压力和临界温度条件下同时呈现气态和液态特性的气体。SCFs的液体性质有利于药物-聚合物的增溶,而气体性质可以有效促进固体扩散和溶剂蒸发。二氧化碳因价廉易得、 无毒、 生物相容性好、 环境影响小、 超临界条件容易达到等优势,已经逐渐成为当前应用最广泛的SCFs[30]。SCFs技术能够在非常短的时间和无需溶剂情况下生产出表面光滑、分散性好和粒径范围较窄的SDs,研究人员可以通过调节配方和工艺参数以制备所需粒度分布的SDs。在诸多SDs的制备方法中,SCFs技术被认为是一种创新和有良好前景的技术。与其他溶剂蒸发工艺相比,SCFs技术具有成本低、对环境友好的优势。SCFs技术的分类如表2所示[56]。
表2 超临界流体技术的分类
Tab.2 Classification of supercritical fluid technology

超临界流体的作用方法溶剂超临界溶液快速膨胀法(rapid expansion of a supercritical solution, RESS)超临界溶液快速膨胀成液体溶剂(rapid expansion of a supercritical solution into a liquid solvent, RESOLV)反溶剂气体反溶剂法(gas antisolvent, GAS)超临界抗溶剂法(supercritical antisolvent, SAS)气溶胶溶剂萃取法(aerosol solvent extraction system, ASES)压缩流体反溶剂法(pressed fluid antisolvent, PCA)超临界流体强化溶液快速分析技术(solution enhanced dispersion by supercritical fluids, SEDS)溶质气体饱和溶液沉析技术(particle formation from gas saturated solutions, PGSS)
Van等[57]采用RESS技术成功制备了青蒿素SDs,改善了青蒿素的水溶性。Brion等[58]通过实验设计确定了在使用PGSS法制备SDs过程中影响最大的2个参数(高压釜的温度、 压力),并确定了最佳工艺条件,最终成功改善了新化学实体的水溶性。Wu等[59]分别采用PCA和喷雾干燥技术制备了吡罗昔康-聚乙烯吡咯烷酮SDs,结果表明,采用PCA技术制备的SDs具有更好的溶解性能。SCFs技术也可以与其他SDs制备技术联合应用来制备SDs。在与HME技术联合时,超临界CO2可以作为增塑剂来降低加工温度和熔体黏度[60]。在与喷雾干燥技术联合时,超临界CO2可以作为萃取溶剂从物料中提取残留溶剂以尽可能减少溶剂残留[61]。SCFs技术也存在一定的局限性,包括购买设备产生的高额费用,基础理论研究不够扎实,大部分药物和载体在超临界CO2中的溶解度较低[62]。
1.2.6 共沉淀法
共沉淀法是一种将反溶剂逐渐滴加到溶有药物和聚合物的溶液中,从而使二者共同沉淀以获得SDs的方法[34]。该方法相对简单,成本较低而且放大起来相对容易,Zelboraf®就是采用共沉淀技术生产的商业化SDs产品。共沉淀法可以通过配方设计和调节沉淀过程来精确控制产品的多种晶型或尺寸。一方面,该方法可以制备具有较大粒径的SDs,流动性可以满足直接加工的需要,省去了繁琐的造粒过程;另一方面,该方法还可以通过快速共沉淀制备无定型纳米颗粒,非晶化和纳米化可以在改善药物溶解性能上发挥协同作用,最大程度地改善药物溶解度和生物利用度[72]。该方法的显著缺点是洗涤和干燥过程中存在的热、湿气可能会引起SDs重结晶。
1.2.7 静电纺丝法
静电纺丝技术可以制备具有极高药物溶解速率的纳米纤维形式的SDs,是SDs技术和纳米技术的结合[73]。在静电纺丝过程中,药物和载体的溶液通过电场力克服表面张力完成喷射,喷出的溶液在加速通过电场时迅速完成溶剂的蒸发形成纳米或者亚微米直径的纤维状SDs,因此原料药的溶解性能可以通过纳米技术和SDs技术协同改善[30]。研究人员可以通过改变溶液表面张力, 调整高压类型、 喂料速率及电导率来对产品的粒度分布进行控制。一步自上而下的简单制造工艺,极少的溶剂残留和良好的可扩展性使该方法获得了极大的关注。Yu等[74]研究表明,与真空干燥、 冷冻干燥和加热干燥制备SDs相比,静电纺丝技术制备的纳米纤维状SDs具有更快的溶解速度,这得益于其较大的表面积、 高孔隙率和基质中更均匀的药物分布,然而较低的生产效率、 复杂的工艺设计、 较差的产品重现性和一定的电喷涂专业知识门槛等缺陷限制了该技术的应用。
1.3 溶剂-熔融法
溶剂-熔融法是指将溶有药物的溶剂与熔融的载体混合后,经干燥和固化形成SDs的过程[75],是溶剂法与熔融法的结合。与溶剂法相比,溶剂-熔融法需要较少的溶剂,并且熔融状态的载体更易分散和溶解;与熔融法相比,溶剂-熔融法需要更低的操作温度和更短的加热时间,因此能够有效避免药物的热降解[23]。
1.4 机械分散法
机械分散法又称研磨法,是指将药物和载体材料混合后,通过一些机械过程,如球磨或研磨,来减小药物的粒度、 提高分散度并引起一定程度的非晶化的SDs制备过程[9]。该方法十分简单,无需有机试剂,但是原料药非晶化的程度比较低,并且需要使用比例较大的载体材料,仅适用于在实验室中制备小剂量药物的SDs[76]。Mesallati等[77]采用球磨法成功制备了环丙沙星SDs,结果发现酸性聚合物更适合作为环丙沙星的载体,因为酸性聚合物它能够与环丙沙星形成稳定的离子相互作用。
2 质量控制
2.1 药物固态
药物固态即药物的固体存在状态,原料药的固态对产品的稳定性和性能有很大的影响[78]。每种固态都有自己的物理特性,如储存稳定性和溶解度。SDs中药物的溶解性能取决于结晶形式。无定形药物往往表现出比结晶形式药物更高的溶解度,因为与具有有序晶格结构的高度结晶化合物相比,溶出介质需要更少的能量来突破无序的晶格结构[79]。不适当的配方设计或生产工艺可能导致SDs存在结晶药物,对设计为无定形状态的制剂的溶出行为产生不利影响,而且即使少量的晶体也可以作为无定形基质中的“种子”,导致进一步的晶体生长,对产品的稳定性和溶解性能造成不良影响[80]。
目前对于药物固态的表征和控制可以通过多种方法来实现。性状是评估SDs固态最直观的定性指标之一。一般来说,透明的SDs代表着晶型药物已经转变为无定型状态,而浑浊甚至不透明的SDs通常仍含有结晶药物[81]。粉末X射线衍射(powder X-ray diffraction, PXRD)也被用于对SDs中药物的固态进行定性或定量研究[81-82]。当SDs中的药物处于结晶状态时,PXRD图显示为尖锐的毛刺峰;当PXRD图中药物特征衍射峰消失则意味着晶体结构的破坏,即药物由结晶态转变为无定型状态。除了对于药物的固态进行定性研究外,PXRD还可以对药物的固态进行定量研究,需要注意的是,用于定量研究的样品需要尽可能保持物理性质的一致,结晶度小于5%的可能无法被PXRD检测到[83]。差示扫描量热法(differential scanning calorimetry, DSC)可以通过研究一定温度范围内样品的热事件来对样品的固态进行定性或定量研究。温度范围的选择很大程度上取决于药物和聚合物各自的热性质,例如,熔点。SDs中的药物由结晶状态转变为无定型状态通常表现为SDs的DSC图中药物的熔点峰减弱或消失。DSC也可根据样品玻璃化转变温度的变化来评估药物是否发生了固态转变。DSC、 PXRD都是基于实验室的离线测量方式,这种方法耗时低效,在加工和质量反馈之间存在一个很长的滞后期,使得过程控制具有很大的挑战性。近年来,近红外光谱技术(near infrared, NIR)和拉曼光谱技术被广泛用来在线监测HME制备SDs过程中药物的固态变化,通过可视化材料在机筒中的固态变化提高了对过程的理解[21]。Saerens等[84]通过将光纤拉曼探头分别安装在挤出机的5个部分实现了对整个机筒内药物固态变化的光谱可视化,有助于处方和工艺参数的优化,以获得具有理想固态特性的SDs。Saerens等[85]的另一项研究表明,与DSC和PXRD相比,在线拉曼光谱技术结合化学计量学方法是一种更可靠、更灵敏的药物固态表征方法。
在对SDs的固态进行检测时,仅采用一种技术进行表征很可能得到不准确的结果,正确的做法是采用多种技术对固态进行综合评估。
2.2 药物和聚合物之间的相互作用
药物和聚合物之间的相互作用通常包括离子相互作用、 氢键、 偶极-偶极相互作用和范德华相互作用[86-88]。药物和聚合物之间的强相互作用,特别是离子键和氢键相互作用,在改善SDs的混溶性和物理稳定性,提高药物可制造性,维持药物在溶液中的过饱和状态,阻止药物在胃肠道中沉淀,抑制药物重结晶方面发挥着至关重要的作用。药物和聚合物之间相互作用的表征方法及判断依据如表3所示。连接光纤的NIR探头和拉曼探头也被集成到HME机上,用来在线监测SDs制备过程中药物和聚合物之间的相互作用[89-90]。
表3 药物和聚合物之间相互作用的表征方法及判断依据
Tab.3 Characterization methods and judgment basis for API-polymer interactions
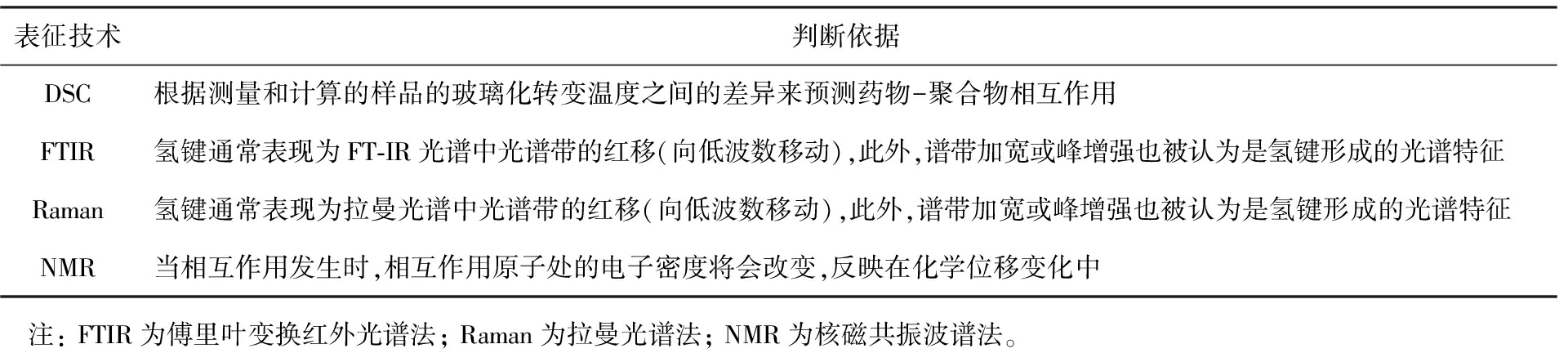
表征技术判断依据DSC根据测量和计算的样品的玻璃化转变温度之间的差异来预测药物-聚合物相互作用FTIR氢键通常表现为FT-IR光谱中光谱带的红移(向低波数移动),此外,谱带加宽或峰增强也被认为是氢键形成的光谱特征Raman氢键通常表现为拉曼光谱中光谱带的红移(向低波数移动),此外,谱带加宽或峰增强也被认为是氢键形成的光谱特征NMR当相互作用发生时,相互作用原子处的电子密度将会改变,反映在化学位移变化中 注: FTIR为傅里叶变换红外光谱法; Raman为拉曼光谱法; NMR为核磁共振波谱法。
2.3 溶出度
SDs的溶出度不仅是处方和工艺优化的重要评价指标, 而且是产品安全、 有效的根本保证。 药物必须通过溶解到胃肠液中, 进入肠壁并穿过肝脏以进入全身血液, 才能在人体内充分发挥疗效, 因此, 溶出度的检测是SDs质量控制的又一关键环节。 与其他医药产品相同, SDs的溶出性质考察主要是使用液相色谱法或者紫外-可见分光光度法测定不同释放时间段内药物的累积释放度, 进而绘制药物的溶出曲线, 并计算药物的体外释放动力学方程[91]。 McFall等[92]采用紫外-可见分光光度法测定了不同时间点时阿立哌唑SDs的累积释放量, 并绘制了溶出曲线, 结果表明, 阿立哌唑SDs明显改善了药物的溶出行为。 Yun等[93]以蛇床子素SDs为研究对象, 采用高效液相色谱法考察了蛇床子素在溶出介质中的累积释放情况, 结果表明, 与原料药相比, 采用合适聚合物制备的蛇床子素SDs具有更加优异的溶出性质。
2.4 粉体学性质
一般来说,大多数技术制备的SDs都是具有低堆积密度和较差流动性的粉末产品,SDs只是一种制剂中间体,需要经过一定的制剂工艺过程制备成片剂、 胶囊剂、 颗粒剂,其粉体学性质会影响下游加工过程的顺利进行和最终产品的质量。以粉末产品压片为例,较差的粉末特性会导致片剂存在含量不均匀、 硬度不够、 松片等质量问题,因此对SDs粉体学性质的了解和后续的控制在制剂的开发和加工中至关重要。流动性、 可压性、 粒度分布是常用来评估粉体功能特性的基本指标。流动性是口服固体制剂配方和工艺开发过程中的一个关键因素,直接影响制药过程的效率、 成本和最终产品的质量[94]。粉末的流动性主要通过多个参数进行综合评估,常用参数包括休止角、豪斯纳比和卡尔指数等。休止角、 卡尔指数和豪斯纳比与流动性之间的关系如表4所示[95]。可压性是指材料在压力下变形的能力,本质是反映体积和压力的关系。研究人员可以通过卡尔指数和片剂的脆碎度来评价可压性,此外压缩位移实验也被用来评估可压性[96]。较差的可压性可能会导致仪器的损坏、 片剂的拉伸强度降低[95]。Kim等[47]以休止角、 豪斯纳比、卡尔指数为评价指标,比较了制备的SDGs和相同处方的物理混合物的粉体学性质,结果表明,SDGs具有优于物理混合物的流动性和可压性,凸显了SDGs成为传统SDs前瞻性替代品的潜力。Kwon等[49]使用豪斯纳比、 卡尔指数对制备的塞来昔布SDGs的流动性进行了评价,结果表明,SDGs流动性优于塞来昔布粉。粒度分布表示粉体中不同粒径的粒子群所占比例,反映了粒子大小的均匀程度,粉末的流动性、 溶解特性、 稳定性和混合均匀性都会受到粒度分布的影响。常用的粒度测量方法包括视觉法、 分离法、 射流扫描法、 场扫描法、 沉降法等5种基本的方法。常用的粒度测量方法和测量范围如表5所示[97-99]。Kim等[47]采用激光散射法检测了微晶纤维素和SDGs的粒径,结果表明,与造粒底物微晶纤维素相比,SDGs的粒径增加了约2.7倍。
表4 休止角、 卡尔指数和豪斯纳比与流动性之间的关系
Tab.4 Relationship between angle of repose, Carr’s index and Hausner’s ratio and flowability
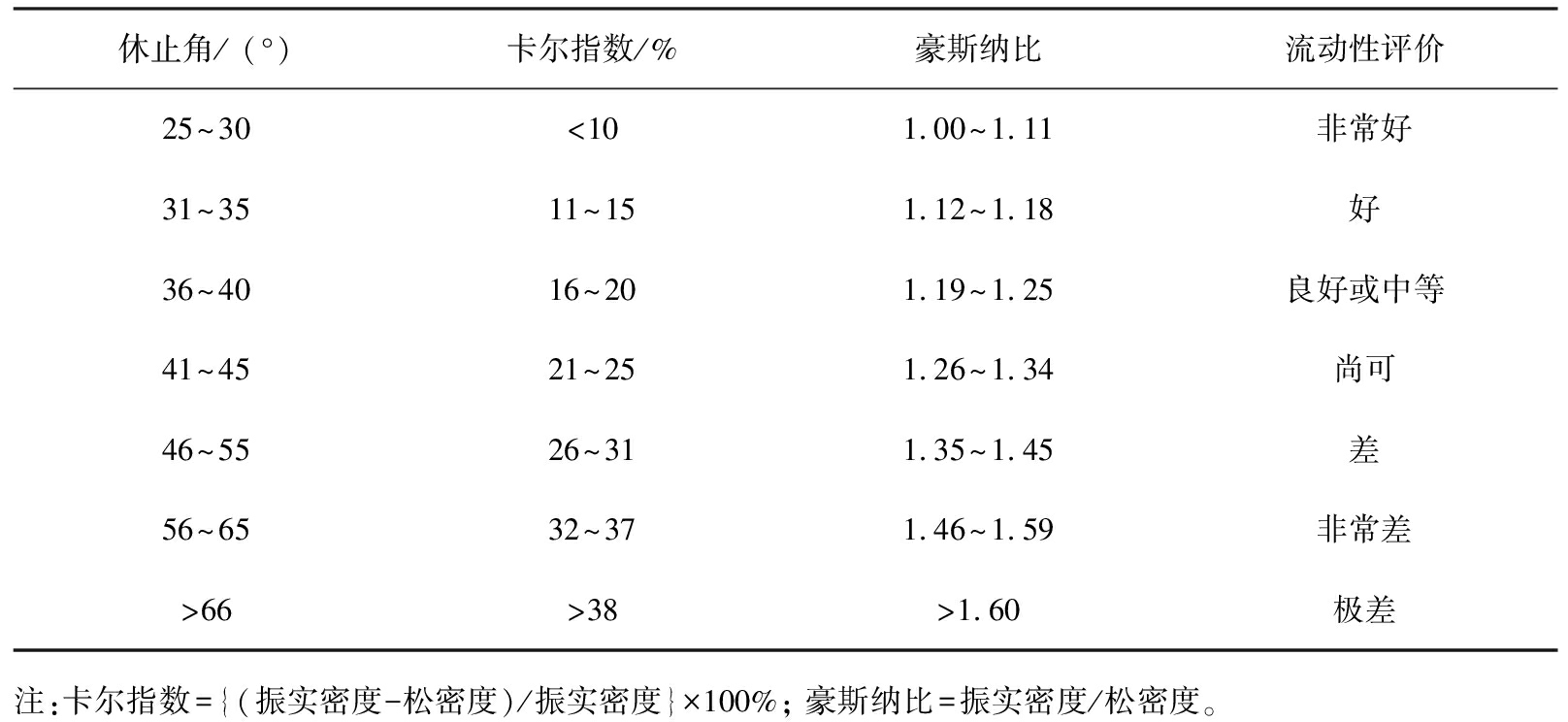
休止角/ (°)卡尔指数/%豪斯纳比流动性评价25~30<101.00~1.11非常好31~3511~151.12~1.18好36~4016~201.19~1.25良好或中等41~4521~251.26~1.34尚可46~5526~311.35~1.45差56~6532~371.46~1.59非常差>66>38>1.60极差注:卡尔指数={(振实密度-松密度)/振实密度}×100%; 豪斯纳比=振实密度/松密度。
表5 常用的粒度测量方法和测量范围
Tab.5 Commonly used particle size measurement methods and measurement ranges
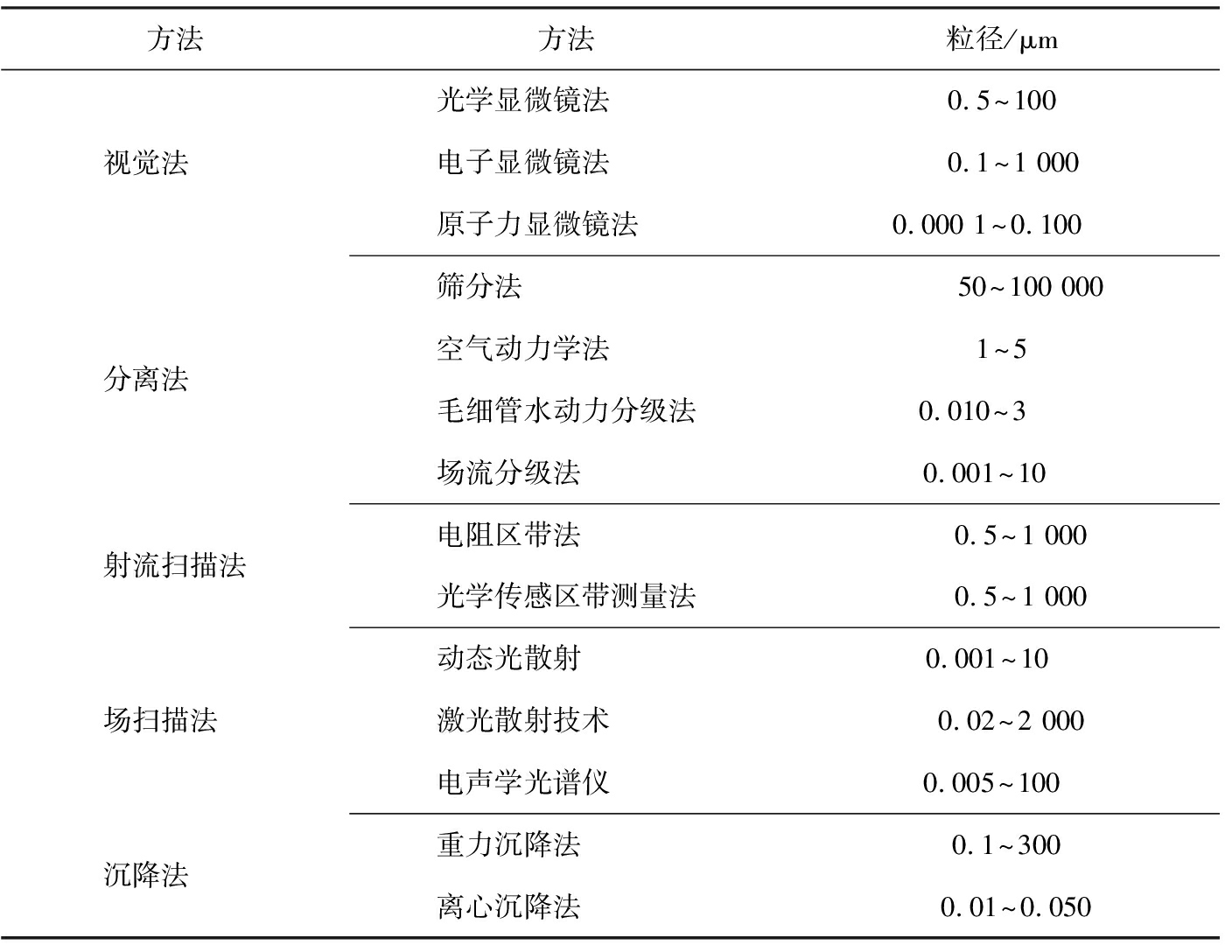
方法方法粒径/μm视觉法 光学显微镜法 0.5~100 电子显微镜法 0.1~1 000原子力显微镜法 0.000 1~0.100 分离法 筛分法 50~100 000空气动力学法 1~5毛细管水动力分级法0.010~3 场流分级法 0.001~10 射流扫描法电阻区带法 0.5~1 000光学传感区带测量法0.5~1 000场扫描法 动态光散射 0.001~10 激光散射技术 0.02~2 000电声学光谱仪 0.005~100 沉降法 重力沉降法 0.1~300离心沉降法 0.01~0.050
3 总结与展望
本文中对SDs的制备技术以及对SDs进行质量控制需要考虑的几个方面进行了综述。 SDs制剂的成功开发取决于正确的制备技术和全面、 准确的质量控制。 深入了解各种制备技术的应用场景、 优点和局限性是正确选择制备技术的前提。 药物和聚合物的物理化学性质对于选择合适制备策略的重要性也不容忽视, 这些性质关系到最终产品的热稳定性和物理稳定性, 未来应进行全面的审查。
虽然目前已经有许多技术被用于SDs的制备,但是仍然存在一些问题需要解决,主要是有毒溶剂的使用和药物可能存在的热降解风险。目前对于商业上可行的制备技术的选择仍旧十分局限,在未来,研究人员应该尝试开发更多简单、 高效和扩展性好的SDs制备技术。在对SDs进行质量控制方面,研究人员除了要对固态、 药物和聚合物之间的相互作用和溶出特性进行考察之外,还要对SDs的粉体学性质进行准确、 全面的考察。
同时具有优异流动性和溶解性能的SDs将会极大程度推动SDs产品的商业化发展,相信随着新颖和优化的制备技术的引入以及更加全面、 准确质量控制措施的实施,有望在保证产品质量和性能的前提下,不断提高SDs产品的生产率。
利益冲突声明(Conflict of Interests)
所有作者声明不存在利益冲突。
All authors disclose no relevant conflict of interests.
作者贡献(Author’s Contributions)
张晓阳构思了评论文章并撰写文章的初稿。应泽华进行了所有文献的检索。郭抒博进行了所有文献的检索。李文龙审阅并修改了稿件。所有作者均阅读并同意了最终稿件的提交。
ZHANG Xiaoyang conceptualized the review article and wrote the first draft of the article. YING Zehua conducted all literature searches. GUO Shubo conducted all literature searches. LI Wenlong reviewed and revised the manuscript. All authors read and agreed to the submission of the final manuscript.
[1]MISHRA D K, DHOTE V, BHARGAVA A, et al. Amorphous solid dispersion technique for improved drug delivery: basics to clinical applications[J]. Drug Delivery and Translational Research, 2015, 5(6): 552-565.
[2]SKRDLA P J. Estimating the maximal solubility advantage of drug salts[J]. International Journal of Pharmaceutics, 2021, 595: 120228.
[3]YAO S C, CHEN N Y, SUN X X, et al. Size-dependence of the skin penetration of andrographolide nanosuspensions: in vitro release-ex vivo permeation correlation and visualization of the delivery pathway[J]. International Journal of Pharmaceutics, 2023, 641: 123065.
[4]MIRCHANDANI Y, PATRAVALE V B. Solid lipid nanoparticles for hydrophilic drugs[J]. Journal of Controlled Release, 2021, 335: 457-464.
[5]KANUJA H K, AWASTHI R, MEHTA M, et al. Nanosuspensions-an update on recent patents, methods of preparation, and evaluation parameters[J]. Recent Patents on Nanotechnology, 2021, 15(4): 351-366.
[6]ALSHETAILI A, ALMUTAIRY B K, ALSHEHRI S M, et al. Development and characterization of sustained-released donepezil hydrochloride solid dispersions using hot melt extrusion technology[J]. Pharmaceutics, 2021, 13(2): 213.
[7]BHUJBAL S V, MITRA B, JAIN U, et al. Pharmaceutical amorphous solid dispersion: a review of manufacturing strategies[J]. Acta Pharmaceutica Sinica B, 2021, 11(8): 2505-2536.
[8]VASCONCELOS T, MARQUES S, DAS NEVES J, et al. Amorphous solid dispersions: rational selection of a manufacturing process[J]. Advanced Drug Delivery Reviews, 2016, 100: 85-101.
[9]ZHANG J, GUO M S, LUO M Q, et al. Advances in the development of amorphous solid dispersions: the role of polymeric carriers[J]. Asian Journal of Pharmaceutical Sciences, 2023, 18(4): 100834.
[10]HOSSAIN S, KABEDEV A, PARROW A, et al. Molecular simulation as a computational pharmaceutics tool to predict drug solubility, solubilization processes and partitioning[J]. European Journal of Pharmaceutics and Biopharmaceutics, 2019, 137: 46-55.
[11]MA X Y, HUANG S Y, LOWINGER M B, et al. Influence of mechanical and thermal energy on nifedipine amorphous solid dispersions prepared by hot melt extrusion: preparation and physical stability[J]. International Journal of Pharmaceutics, 2019, 561: 324-334.
[12]SKRDLA P J, FLOYD P D, DELL’ORCO P C. Predicted amorphous solubility and dissolution rate advantages following moisture sorption: case studies of indomethacin and felodipine[J]. International Journal of Pharmaceutics, 2019, 555: 100-108.
[13]潘虹, 李飞, 柴硕, 等. 甘草次酸固体分散体3种制备工艺比较[J]. 中国药业, 2022, 31(18): 57-61.
PAN H, LI F, CHAI S, et al. Comparison of three preparation technologies of glycyrrhetinic acid solid dispersion[J]. China Pharmaceuticals, 2022, 31(18): 57-61.
[14]CHIVATE A, GARKAL A, DHAS N, et al. Hot-melt extrusion: an emerging technique for solubility enhancement of poorly water-soluble drugs[J]. PDA Journal of Pharmaceutical Science and Technology, 2021, 75(4): 357-373.
[15]TRAN P H L, LEE B J, TRAN T T D. Recent studies on the processes and formulation impacts in the development of solid dispersions by hot-melt extrusion[J]. European Journal of Pharmaceutics and Biopharmaceutics, 2021, 164: 13-19.
[16]ALZAHRANI A, NYVANANDI D, MANDATI P, et al. A systematic and robust assessment of hot-melt extrusion-based amorphous solid dispersions: theoretical prediction to practical implementation[J]. International Journal of Pharmaceutics, 2022, 624: 121951.
[17]MATADH A V, ECHANUR A, SURESH S, et al. Can continuous manufacturing of topical semisolids by hot melt extrusion soon be a reality?[J]. Molecular Pharmaceutics, 2023, 20(8): 3779-3790.
[18]REPKA M A, BANDARI S, KALLAKUNTA V R, et al. Melt extrusion with poorly soluble drugs-an integrated review[J]. International Journal of Pharmaceutics, 2018, 535(1/2): 68-85.
[19]LI J L, LI C H, ZHANG H, et al. Preparation of azithromycin amorphous solid dispersion by hot-melt extrusion: an advantageous technology with taste masking and solubilization effects[J]. Polymers, 2022, 14(3): 495.
[20]SALAVE S, PRAYAG K, RANA D, et al. Recent progress in hot melt extrusion technology in pharmaceutical dosage form design[J]. Recent Advances in Drug Delivery and Formulation, 2022, 16(3): 170-191.
[21]WESHOLOWSKI J, PRILL S, BERGHAUS A, et al. Inline UV/Vis spectroscopy as PAT tool for hot-melt extrusion[J]. Drug Delivery and Translational Research, 2018, 8(6): 1595-1603.
[22]MUNIR N, NUGENT M, WHITAKER D, et al. Machine learning for process monitoring and control of hot-melt extrusion: current state of the art and future directions[J]. Pharmaceutics, 2021, 13(9): 1432.
[23]VO C L N, PARK C, LEE B J. Current trends and future perspectives of solid dispersions containing poorly water-soluble drugs[J]. European Journal of Pharmaceutics and Biopharmaceutics, 2013, 85(3): 799-813.
[24]SEO A, HOLM P, KRISTENSEN H G, et al. The preparation of agglomerates containing solid dispersions of diazepam by melt agglomeration in a high shear mixer[J]. International Journal of Pharmaceutics, 2003, 259(1/2): 161-171.
[25]![]() I, D- URI
I, D- URI J,
J, ![]() I, et al. In silico modeling of in situ fluidized bed melt granulation[J]. International Journal of Pharmaceutics, 2014, 466(1/2): 21-30.
I, et al. In silico modeling of in situ fluidized bed melt granulation[J]. International Journal of Pharmaceutics, 2014, 466(1/2): 21-30.
[26]孙嘉慧, 唐海, 杨美青, 等. 固体分散体技术提高难溶性药物溶解度研究进展[J]. 化工与医药工程, 2021, 42(5): 38-43.
SUN J H, TANG H, YANG M Q, et al. Research progress in improving solubility of insoluble drugs by solid dispersion technique[J]. Chemical and Pharmaceutical Engineering, 2021,42(5):38-43.
[27]JERMAIN S V, MILLER D, SPANGENBERG A, et al. Homogeneity of amorphous solid dispersions: an example with KinetiSol® [J]. Drug Development and Industrial Pharmacy, 2019, 45(5): 724-735.
[28]ELLENBERGER D J, MILLER D A, WILLIAMS R O. Expanding the application and formulation space of amorphous solid dispersions with KinetiSol®: a review[J]. AAPS PharmSciTech, 2018, 19(5): 1933-1956.
[29]DINUNZIO J C, BROUGH C, MILLER D A, et al. Fusion processing of itraconazole solid dispersions by KinetiSol® dispersing: a comparative study to hot melt extrusion[J]. Journal of Pharmaceutical Sciences, 2010, 99(3): 1239-1253.
[30]BIKIARIS D N. Solid dispersions: Part II: new strategies in manufacturing methods for dissolution rate enhancement of poorly water-soluble drugs[J]. Expert Opinion on Drug Delivery, 2011, 8(12): 1663-1680.
[31]DUMPA N, BUTREDDY A, WANG H H, et al. 3D printing in personalized drug delivery: an overview of hot-melt extrusion-based fused deposition modeling[J]. International Journal of Pharmaceutics, 2021, 600: 120501.
[32]DESHKAR S, RATHI M, ZAMBAD S, et al. Hot melt extrusion and its application in 3D printing of pharmaceuticals[J]. Current Drug Delivery, 2021, 18(4): 387-407.
[33]KHALID G M, BILLA N. Solid dispersion formulations by FDM 3D printing: a review[J]. Pharmaceutics, 2022, 14(4): 690.
[34]BANDARI S, NYAVANANDI D, DUMPA N, et al. Coupling hot melt extrusion and fused deposition modeling: critical properties for successful performance[J]. Advanced Drug Delivery Reviews, 2021, 172: 52-63.
[35]PASSERINI N, CALOGER G, ALBERTINI B, et al. Melt granulation of pharmaceutical powders: a comparison of high-shear mixer and fluidised bed processes[J]. International Journal of Pharmaceutics, 2010, 391(1/2): 177-186.
G, ALBERTINI B, et al. Melt granulation of pharmaceutical powders: a comparison of high-shear mixer and fluidised bed processes[J]. International Journal of Pharmaceutics, 2010, 391(1/2): 177-186.
[36]S TI P L, BOCZ K, PATAKI H, et al. Comparison of spray drying, electroblowing and electrospinning for preparation of Eudragit E and itraconazole solid dispersions[J]. International Journal of Pharmaceutics, 2015, 494(1): 23-30.
TI P L, BOCZ K, PATAKI H, et al. Comparison of spray drying, electroblowing and electrospinning for preparation of Eudragit E and itraconazole solid dispersions[J]. International Journal of Pharmaceutics, 2015, 494(1): 23-30.
[37]刘诗苑. 诺氟沙星固体分散体的形成机制及性质研究[D]. 天津: 天津大学, 2020.
LIU S Y. Study on the formation mechanism and properties of norfloxacin solid dispersion[D]. Tianjin: Tianjin University, 2020.
[38]亢思莹, 顾宙辉, 黄鑫. 喷雾干燥技术在固体分散体制备中的应用[J]. 药学与临床研究, 2022, 30(2): 159-161.
KANG S Y, GU Z H, HUANG X. Application of spray dry technology in preparation of solid dispersion[J]. Pharmaceutical and Clinical Research, 2022, 30(2): 159-161.
[39]HENGSAWAS SURASARANG S, KEEN J M, HUANG S Y, et al. Hot melt extrusion versus spray drying: hot melt extrusion degrades albendazole[J]. Drug Development and Industrial Pharmacy, 2017, 43(5): 797-811.
[40]SAWICKI E, BEIJNEN J H, SCHELLENS J H M, et al. Pharmaceutical development of an oral tablet formulation containing a spray dried amorphous solid dispersion of docetaxel or paclitaxel[J]. International Journal of Pharmaceutics, 2016, 511(2): 765-773.
[41]BHARDWAJ V, TRASI N S, ZEMLYANOV D Y, et al. Surface area normalized dissolution to study differences in itraconazole-copovidone solid dispersions prepared by spray-drying and hot melt extrusion[J]. International Journal of Pharmaceutics, 2018, 540(1/2): 106-119.
[42]BHUJBAL S V, ZEMLYANOV D Y, CAVALLARO A, et al. Qualitative and quantitative characterization of composition heterogeneity on the surface of spray dried amorphous solid dispersion particles by an advanced surface analysis platform with high surface sensitivity and superior spatial resolution[J]. Molecular Pharmaceutics, 2018, 15(5): 2045-2053.
[43]VALKAMA E, HALUSKA O, LEHTO V P, et al. Production and stability of amorphous solid dispersions produced by a freeze-drying method from DMSO[J]. International Journal of Pharmaceutics, 2021, 606: 120902.
[44]JIN S, LEE C H, LIM D Y, et al. Improved hygroscopicity and bioavailability of solid dispersion of red ginseng extract with silicon dioxide[J]. Pharmaceutics, 2021, 13(7): 1022.
[45]胡献跃, 胡亚男, 黄东纬, 等. 冷冻干燥法制备甲苯磺酸拉帕替尼固体分散体及其大鼠药动学评价[J]. 中国现代应用药学, 2020, 37(3): 299-303.
HU X Y, HU Y N, HUANG D W, et al. Preparation of lapatinib ditosylate solid dispersions by freeze-drying technology and its pharmacokinetic evaluation in rats[J]. Chinese Journal of Modern Applied Pharmacy, 2020, 37(3): 299-303.
[46]VAN DROOGE D J, HINRICHS W L J, DICKHOFF B H J, et al. Spray freeze drying to produce a stable Δ9-tetrahydrocannabinol containing inulin-based solid dispersion powder suitable for inhalation[J]. European Journal of Pharmaceutical Sciences, 2005, 26(2): 231-240.
[47]KIM J S, UD DIN F, CHOI Y J, et al. Hydroxypropyl-β-cyclodextrin-based solid dispersed granules: a prospective alternative to conventional solid dispersion[J]. International Journal of Pharmaceutics, 2022, 628: 122286.
[48]SHANMUGAM S, IM H T, SOHN Y T, et al. Enhanced oral bioavailability of paclitaxel by solid dispersion granulation[J]. Drug Development and Industrial Pharmacy, 2015, 41(11): 1864-1876.
[49]KWON H J, HEO E J, KIM Y H, et al. Development and evaluation of poorly water-soluble celecoxib as solid dispersions containing nonionic surfactants using fluidized-bed granulation[J]. Pharmaceutics, 2019, 11(3): 136.
[50]LI J, MIAO X Q, CHEN T K, et al. Preparation and characterization of pelletized solid dispersion of resveratrol with mesoporous silica microparticles to improve dissolution by fluid-bed coating techniques[J]. Asian Journal of Pharmaceutical Sciences, 2016, 11(4): 528-535.
[51]LI J, LIU P, LIU J P, et al. Novel Tanshinone II A ternary solid dispersion pellets prepared by a single-step technique: in vitro and in vivo evaluation[J]. European Journal of Pharmaceutics and Biopharmaceutics, 2012, 80(2): 426-432.
[52]WU S J, ZENG Q, ZHANG Z Y, et al. Development of sinomenine hydrochloride sustained-release pellet using a novel whirlwind fluidized bed[J]. Journal of Drug Delivery Science and Technology, 2022, 78: 103956.
[53]BOEL E, VAN DEN MOOTER G. The impact of applying an additional polymer coating on high drug-loaded amorphous solid dispersions layered onto pellets[J]. International Journal of Pharmaceutics, 2023, 630: 122455.
[54]NIKOWITZ K, PINTYE-H DI K, REGDON G. Study of the recrystallization in coated pellets: effect of coating on API crystallinity[J]. European Journal of Pharmaceutical Sciences, 2013, 48(3): 563-571.
DI K, REGDON G. Study of the recrystallization in coated pellets: effect of coating on API crystallinity[J]. European Journal of Pharmaceutical Sciences, 2013, 48(3): 563-571.
[55]DEREYMAKER A, PELGRIMS J, ENGELEN F, et al. Controlling the release of indomethacin from glass solutions layered with a rate controlling membrane using fluid-bed processing: part 2: the influence of formulation parameters on drug release[J]. Molecular Pharmaceutics, 2017, 14(4): 974-983.
[56]TRAN P, PARK J S. Application of supercritical fluid technology for solid dispersion to enhance solubility and bioavailability of poorly water-soluble drugs[J]. International Journal of Pharmaceutics, 2021, 610: 121247.
[57]VAN NIJLEN T, BRENNAN K, VAN DEN MOOTER G, et al. Improvement of the dissolution rate of artemisinin by means of supercritical fluid technology and solid dispersions[J]. International Journal of Pharmaceutics, 2003, 254(2): 173-181.
[58]BRION M, JASPART S, PERRONE L, et al. The supercritical micronization of solid dispersions by particles from gas saturated solutions using experimental design[J]. The Journal of Supercritical Fluids, 2009, 51(1): 50-56.
[59]WU K, LI J, WANG W, et al. Formation and characterization of solid dispersions of piroxicam and polyvinylpyrrolidone using spray drying and precipitation with compressed antisolvent[J]. Journal of Pharmaceutical Sciences, 2009, 98(7): 2422-2431.
[60]LYONS J G, HALLINAN M, KENNEDY J E, et al. Preparation of monolithic matrices for oral drug delivery using a supercritical fluid assisted hot melt extrusion process[J]. International Journal of Pharmaceutics, 2007, 329(1/2): 62-71.
[61]COSTA C, CASIMIRO T, CORVO M L, et al. Solid dosage forms of biopharmaceuticals in drug delivery systems using sustainable strategies[J]. Molecules, 2021, 26(24): 7653.
[62]张维, 张志云, 张志丽, 等. 超临界流体技术制备固体分散体的研究进展[J]. 安徽医药, 2013, 17(6): 903-905.
ZHANG W, ZHANG Z Y, ZHANG Z L, et al. Progress in preparation of solid dispersions using supercritical fluid process[J]. Anhui Medical and Pharmaceutical Journal, 2013, 17(6): 903-905.
[63]KESHAVARZ A, KARIMI-SABET J, FATTAHI A, et al. Preparation and characterization of raloxifene nanoparticles using rapid expansion of supercritical solution (RESS)[J]. The Journal of Supercritical Fluids, 2012, 63: 169-179.
[64]ESSEL J T, IHNEN A C, CARTER J D. Production of naproxen nanoparticle colloidal suspensions for inkjet printing applications[J]. Industrial &Engineering Chemistry Research, 2014, 53(7): 2726-2731.
[65]PATHAK P, MEZIANI M J, DESAI T R, et al. Nanosizing drug particles in supercritical fluid processing[J]. Journal of the American Chemical Society, 2004, 126(35): 10842-10843.
[66]LI S M, LIU Y, LIU T, et al. Development and in-vivo assessment of the bioavailability of oridonin solid dispersions by the gas anti-solvent technique[J]. International Journal of Pharmaceutics, 2011, 411(1/2): 172-177.
[67]ADELI E. The use of supercritical anti-solvent (SAS) technique for preparation of irbesartan-pluronic® F-127 nanoparticles to improve the drug dissolution[J]. Powder Technology, 2016, 298: 65-72.
[68]BIN AHN J, KIM D H, LEE S E, et al. Improvement of the dissolution rate and bioavailability of fenofibrate by the supercritical anti-solvent process[J]. International Journal of Pharmaceutics, 2019, 564: 263-272.
[69]LEE S, NAM K, KIM M S, et al. Preparation and characterization of solid dispersions of itraconazole by using aerosol solvent extraction system for improvement in drug solubility and bioavailability[J]. Archives of Pharmacal Research, 2005, 28(7): 866-874.
[70]YANG G, ZHAO Y P, FENG N P, et al. Improved dissolution and bioavailability of silymarin delivered by a solid dispersion prepared using supercritical fluids[J]. Asian Journal of Pharmaceutical Sciences, 2015, 10(3): 194-202.
[71]JUN S W, KIM M S, JO G H, et al. Cefuroxime axetil solid dispersions prepared using solution enhanced dispersion by supercritical fluids[J]. The Journal of Pharmacy and Pharmacology, 2005, 57(12): 1529-1537.
[72]MORIKAWA C, UEDA K, OMORI M, et al. Formation mechanism of amorphous drug nanoparticles using the antisolvent precipitation method elucidated by varying the preparation temperature[J]. International Journal of Pharmaceutics, 2021, 610: 121210.
[73]YU D G, YANG J M, BRANFORD-WHITE C, et al. Third generation solid dispersions of ferulic acid in electrospun composite nanofibers[J]. International Journal of Pharmaceutics, 2010, 400(1/2): 158-164.
[74]YU D G, BRANFORD-WHITE C, WHITE K, et al. Dissolution improvement of electrospun nanofiber-based solid dispersions for acetaminophen[J]. AAPS PharmSciTech, 2010, 11(2): 809-817.
[75]ZHANG Q, PU Y Q, WANG B, et al. Characterization, molecular docking, and in vitro dissolution studies of solid dispersions of 20(S)-protopanaxadiol[J]. Molecules, 2017, 22(2): 274.
[76]BOLOURCHIAN N, SHAFIEE PANAH M. The effect of surfactant type and concentration on physicochemical properties of carvedilol solid dispersions prepared by wet milling method[J]. Iranian Journal of Pharmaceutical Research IJPR, 2022, 21(1): e126913.
[77]MESALLATI H, UMERSKA A, PALUCH K J, et al. Amorphous polymeric drug salts as ionic solid dispersion forms of ciprofloxacin[J]. Molecular Pharmaceutics, 2017, 14(7): 2209-2223.
[78]PUGLIESE A, TOBYN M, HAWARDEN L E, et al. New development in understanding drug-polymer interactions in pharmaceutical amorphous solid dispersions from solid-state nuclear magnetic resonance[J]. Molecular Pharmaceutics, 2022, 19(11): 3685-3699.
[79]PATIL H, TIWARI R V, REPKA M A. Hot-melt extrusion: from theory to application in pharmaceutical formulation[J]. AAPS PharmSciTech, 2016, 17(1): 20-42.
[80]SAERENS L, DIERICKX L, LENAIN B, et al. Raman spectroscopy for the in-line polymer-drug quantification and solid state characterization during a pharmaceutical hot-melt extrusion process[J]. European Journal of Pharmaceutics and Biopharmaceutics, 2011, 77(1): 158-163.
[81]马骏威, 安娜. 热熔挤出法固体分散体质量评价的考虑[J]. 中国药学杂志, 2020, 55(21): 1819-1823.
MA J W, AN N. Consideration for quality evaluation of solid dispersions prepared by hot melt extrusion[J]. Chinese Pharmaceutical Journal, 2020, 55(21): 1819-1823.
[82]LI Y C, PANG H S, GUO Z F, et al. Interactions between drugs and polymers influencing hot melt extrusion[J]. The Journal of Pharmacy and Pharmacology, 2014, 66(2): 148-166.
[83]PANZADE P, SHENDARKAR G, KULKARNI D, et al. Solid state characterization and dissolution enhancement of nevirapine cocrystals[J]. Advanced Pharmaceutical Bulletin, 2021, 11(4): 772-776.
[84]SAERENS L, VERVAET C, REMON J P, et al. Visualization and process understanding of material behavior in the extrusion barrel during a hot-melt extrusion process using Raman spectroscopy[J]. Analytical Chemistry, 2013, 85(11): 5420-5429.
[85]SAERENS L, GHANAM D, RAEMDONCK C, et al. In-line solid state prediction during pharmaceutical hot-melt extrusion in a 12 mm twin screw extruder using Raman spectroscopy[J]. European Journal of Pharmaceutics and Biopharmaceutics, 2014, 87(3): 606-615.
[86]BUDIMAN A, NURANI N V, LAELASARI E, et al. Effect of drug-polymer interaction in amorphous solid dispersion on the physical stability and dissolution of drugs: the case of α-mangostin[J]. Polymers, 2023, 15(14): 3034.
[87]SARPAL K, DELANEY S, ZHANG G G Z, et al. Phase behavior of amorphous solid dispersions of felodipine: homogeneity and drug-polymer interactions[J]. Molecular Pharmaceutics, 2019, 16(12): 4836-4851.
[88]WALDEN D M, BUNDEY Y, JAGARAPU A, et al. Molecular simulation and statistical learning methods toward predicting drug-polymer amorphous solid dispersion miscibility, stability, and formulation design[J]. Molecules, 2021, 26(1): 182.
[89]VAN RENTERGHEM J, KUMAR A, VERVAET C, et al. Elucidation and visualization of solid-state transformation and mixing in a pharmaceutical mini hot melt extrusion process using in-line Raman spectroscopy[J]. International Journal of Pharmaceutics, 2017, 517(1/2): 119-127.
[90]ALMEIDA A, SAERENS L, DE BEER T, et al. Upscaling and in-line process monitoring via spectroscopic techniques of ethylene vinyl acetate hot-melt extruded formulations[J]. International Journal of Pharmaceutics, 2012, 439(1/2): 223-229.
[91]吴思俊, 张晓阳, 郭抒博, 等. 中药丸剂生产过程控制及质量表征技术研究进展[J]. 分析测试学报, 2023, 42(8): 1012-1025.
WU S J, ZHANG X Y, GUO S B, et al. Research progress on production process control technology and quality characterization technology of traditional Chinese medicine pills[J]. Journal of Instrumental Analysis, 2023, 42(8): 1012-1025.
[92]MCFALL H, SARABU S, SHANKAR V, et al. Formulation of aripiprazole-loaded pH-modulated solid dispersions via hot-melt extrusion technology: in vitro and in vivo studies[J]. International Journal of Pharmaceutics, 2019, 554: 302-311.
[93]YUN F, KANG A, SHAN J J, et al. Preparation of osthole-polymer solid dispersions by hot-melt extrusion for dissolution and bioavailability enhancement[J]. International Journal of Pharmaceutics, 2014, 465(1/2): 436-443.
[94]MEGARRY A J, SWAINSON S M E, ROBERTS R J, et al. A big data approach to pharmaceutical flow properties[J]. International Journal of Pharmaceutics, 2019, 555: 337-345.
[95]YU Y T, ZHAO L J, LIN X, et al. Research on the powder classification and the key parameters affecting tablet qualities for direct compaction based on powder functional properties[J]. Advanced Powder Technology, 2021, 32(2): 565-581.
[96]马英杰, 逄秀娟, 王思玲, 等. 辅料对尼莫地平固体分散体粉体学性质的影响[J]. 沈阳药科大学学报, 2009, 26(4): 254-259.
MA Y J, PANG X J, WANG S L, et al. Effects of excipients on powder technology properties of nimodipine dispersion powders[J]. Journal of Shenyang Pharmaceutical University, 2009, 26(4): 254-259.
[97]SARRAGUÇA M C, CRUZ A V, AMARAL H R, et al. Comparison of different chemometric and analytical methods for the prediction of particle size distribution in pharmaceutical powders[J]. Analytical and Bioanalytical Chemistry, 2011, 399(6): 2137-2147.
[98]YOUNG Z, QU M L, CODAY M M, et al. Effects of particle size distribution with efficient packing on powder flowability and selective laser melting process[J]. Materials, 2022, 15(3): 705.
[99]PAULI V, ROGGO Y, KLEINEBUDDE P, et al. Real-time monitoring of particle size distribution in a continuous granulation and drying process by near infrared spectroscopy[J]. European Journal of Pharmaceutics and Biopharmaceutics, 2019, 141: 90-99.