近几年来,铅基卤化物半导体类钙钛矿材料引起广泛重视。目前,广义的钙钛矿通常是指具有ABX3结构类型的化合物。在钙钛矿ABX3中,A位离子(A为![]() 等)占据立方体晶格顶点,主要起到晶格电荷补偿的作用,不会对材料的能带结构产生重要影响[1];B位金属离子以Pb2+为主,位于立方体体心位置;X位卤素离子(X为Cl-、 Br-、 I-)位于立方体6个面的面心,带隙随着金属-卤素键角的增大而减小[2]。APbX3类钙钛矿半导体因具有合适的禁带宽度(约为1.5 eV)、 较长的载流子扩散长度(102~103 nm)、低成本溶液加工等优点在光电转换器件领域迅速发展。Liu等[3]考虑到铅元素的固有毒性,尝试用Sn2+取代Pb2+。Noel等[4]首次用Sn完全替代Pb,以掺杂氟的SnO2导电玻璃(FTO)、 2,2’,7,7’-四[N,N-二(4-甲氧基苯基)氨基]-9,9’-螺二芴(spiro-OMeTAD)等原料制备钙钛矿太阳能电池,结构为FTO-TiO2(致密)-TiO2(多孔)-钙钛矿-spiro-OMeTAD-Au,功率转换效率达到6.4%,但Sn2+在空气中极易氧化成Sn4+,Sn基钙钛矿的稳定性无法保证正常应用。除了采用与Pb具有等价位的Sn2+、 Ge2+来替代Pb2+形成传统的ABX3钙钛矿结构外,2016年Volonakis等[5]制得具有三维结构的Bi基非铅双金属钙钛矿材料,分子式为A2B+BiX6。双金属钙钛矿结构采用了金属离子分裂法,将2个+2价Pb离子用1个+1价和1个+3价离子代替,这一结构最大程度地保持了与Pb基三维钙钛矿相似的几何构型和电子结构[6-8],因此,双金属钙钛矿材料因环境友好、稳定性高和具有可调光电性能等特点受到广泛关注。
等)占据立方体晶格顶点,主要起到晶格电荷补偿的作用,不会对材料的能带结构产生重要影响[1];B位金属离子以Pb2+为主,位于立方体体心位置;X位卤素离子(X为Cl-、 Br-、 I-)位于立方体6个面的面心,带隙随着金属-卤素键角的增大而减小[2]。APbX3类钙钛矿半导体因具有合适的禁带宽度(约为1.5 eV)、 较长的载流子扩散长度(102~103 nm)、低成本溶液加工等优点在光电转换器件领域迅速发展。Liu等[3]考虑到铅元素的固有毒性,尝试用Sn2+取代Pb2+。Noel等[4]首次用Sn完全替代Pb,以掺杂氟的SnO2导电玻璃(FTO)、 2,2’,7,7’-四[N,N-二(4-甲氧基苯基)氨基]-9,9’-螺二芴(spiro-OMeTAD)等原料制备钙钛矿太阳能电池,结构为FTO-TiO2(致密)-TiO2(多孔)-钙钛矿-spiro-OMeTAD-Au,功率转换效率达到6.4%,但Sn2+在空气中极易氧化成Sn4+,Sn基钙钛矿的稳定性无法保证正常应用。除了采用与Pb具有等价位的Sn2+、 Ge2+来替代Pb2+形成传统的ABX3钙钛矿结构外,2016年Volonakis等[5]制得具有三维结构的Bi基非铅双金属钙钛矿材料,分子式为A2B+BiX6。双金属钙钛矿结构采用了金属离子分裂法,将2个+2价Pb离子用1个+1价和1个+3价离子代替,这一结构最大程度地保持了与Pb基三维钙钛矿相似的几何构型和电子结构[6-8],因此,双金属钙钛矿材料因环境友好、稳定性高和具有可调光电性能等特点受到广泛关注。
Cs2AgBiBr6为一种新型的无机双钙钛矿材料,具有较大的光学带隙和良好的光吸收性能,在光电子器件领域具有广泛的应用潜力,如太阳能电池[9-10]、 光电探测器[11]和发光二极管等,可通过多种方法制备。2021年,Wu等[12]在温度为200 ℃条件下,选用含有溴化铋(BiBr3)-硝酸银(AgNO3)-铯酸盐的高沸点有机溶剂,调控氢溴酸(HBr)、 油酸、 油胺添加剂的含量,采用热注射法合成了具有纯立方形状和高结晶度的Cs2AgBiBr6纳米晶体。2022年,Yang等[13]同样使用了热注射法制备Cs2AgBiBr6, 通过与BiOCl纳米片形成异质结构提高了Cs2AgBiBr6纳米晶体的光电性能。 热注射法需要的温度较高, 而且使用挥发性的有机溶剂,易对环境造成污染。 2021年, Jiang等[14]采用水热法处理氮掺杂碳材料, 将BiBr3、 AgBr、 CsBr溶解在HBr溶液中,在温度为110 ℃的油浴锅中加热并快速搅拌,在真空烘箱中干燥合成Cs2AgBiBr6粉末,首次通过简单的一锅法成功合成了氮掺杂碳材料负载的无铅卤化物钙钛矿Cs2AgBiBr6复合材料,制备步骤复杂,但温度控制精度较高。2023年,Low等[15]使用微波辅助溶剂热法合成Cs2AgBiBr6纳米颗粒,制备方法与热注入法类似,仅是将油浴锅换成微波炉来完成恒温搅拌过程,仍然需要复杂的操作工艺且产量低。综上,传统的Cs2AgBiBr6合成方法存在一些问题,如合成过程复杂、 产率较低和颗粒尺寸难以控制等,因此,需要寻找一种简单有效的制备方法以获得高纯度的Cs2AgBiBr6纳米粉体。
机械球磨法通过机械力、 热力和表面效应等作用,可实现高能量的物理化学反应、物料的均匀混合、材料的纳米化以及结构的可控性,是一种重要的可批量化粉体制备技术。与传统的溶剂热合成方法相比,采用机械球磨法制备卤化物钙钛矿晶体材料不必添加具有挥发性的有机溶剂,不用在特定温度下进行加工。2017年,Zhu等[16]在室温下研磨CsX和PbX2盐(X为Cl、 Br、 I或其混合物)成功构建了CsPbX3量子点,实现了无机Pb基钙钛矿量子点的组分可调化,CsPbX3量子点的波长为409~658 nm。2018年,Sadhukhan等[17]采用干式机械合成方法制备混合卤化物杂化钙钛矿(CH3NH3PbI3-xBrx),随着x的增加,晶格结构由四方相转变为立方相。2019年,Breternitz等[18]首次利用机械球磨法制得Cs2AgInBr6双钙钛矿粉体,通过漫反射测试发现Cs2AgInBr6双钙钛矿粉体禁带宽度为2.36 eV。2022年,Muscarella等[19]测试了温度依赖的光致发光的Cs2AgBiBr6,发现发光峰位没有变化或仅产生轻微红移,目前Cs2AgBiBr6纳米粉体的光学性质尚不明确。综上,机械球磨法制备Cs2AgBiBr6粉体具有过程简单、可扩展性强等众多优势。
为了实现高产率、低成本和批量化生产Cs2AgBiBr6纳米粉体材料,本文中利用机械球磨法制备Cs2AgBiBr6纳米粉体,研究球磨时间对Cs2AgBiBr6纳米粉体的纯度、粒径和微观形貌的影响,获取最佳制备工艺条件;测定Cs2AgBiBr6纳米粉体的物相、 纯度、 粒度分布、 微观形貌、 光学带隙、 发光峰位,并进行热重分析,探究Cs2AgBiBr6纳米粉体的光学性质和热稳定性。
1 实验
1.1 原料和设备
原料:溴化铯(CsBr,质量分数为99.5%,上海麦克林生化科技有限公司);溴化银(AgBr,质量分数为99.9%,上海麦克林生化科技有限公司);溴化铋(BiBr3,质量分数≥98%,上海麦克林生化科技有限公司)。
设备:MSK-SFM-1S型行星式球磨机(合肥科晶材料技术有限公司);BPG-7032型电热恒温干燥箱(合肥科晶材料技术有限公司)。
1.2 Cs2AgBiBr6纳米粉体的制备
准备2个氧化铝球磨罐,用清洗刷打磨干净后,放入电热恒温干燥箱中加热烘干;氧化锆研磨球的直径为5、 8、 10 mm,研磨球质量分别为0.2、 1.0、 2.0 g,3种直径的研磨球混合使用,加入球磨罐中备用;3种原料CsBr、 AgBr、 BiBr3物质的量的比为2∶1∶1,实验原料总质量为(5±0.5) g,研磨球与原料的质量比为4.5∶1;将称取好的原料在温度为60 ℃条件下进行干燥处理,然后装入球磨罐中进行研磨。在转速为500 r/min条件下,随着球磨时间的增加,在球磨罐内主要发生纳米粉体的合成、 破碎和提纯反应。球磨时间≤15 min时,球磨罐内主要发生合成反应;球磨时间>15 min时,球磨罐内主要进行纳米粉体的破碎和提纯,为提高样品纯度,设置球磨时间分别为1、 2、 3、 4、 8、 12、 16 h。
1.3 测试与表征
采用SmartLab 9KW型X射线衍射仪(XRD,日本理学公司)和HR Evolution型拉曼光谱仪(日本Horiba公司)测定粉体的物相和纯度;采用LS13320型激光粒度分析仪(美国贝克曼库尔特有限公司)测定不同球磨时间时粉碎后颗粒的粒度分布;采用QUANTA 250 FEG型扫描电子显微镜(SEM,美国FET公司)和JEM-1400型透射电子显微镜(TEM,日本电子株式会社)表征不同球磨时间时粉碎后颗粒的微观形貌;采用UV-3600型紫外可见分光光度计(日本岛津公司)测定纯相粉体的光学带隙,PLS-1000型稳态荧光光谱仪(PL,英国爱丁堡仪器公司)测定发光峰位;采用TGA55型热重分析仪(美国TA公司)表征纯相粉体的热稳定性。
2 结果与讨论
2.1 物相与纯度分析
球磨时间≤1 h时,Cs2AgBiBr6纳米粉体合成阶段样品的XRD图谱如图1所示。
由图1(a)可见,球磨时间为3 min时,可观察到大量的残留产物(AgBr、 CsBr、 BiBr3)、 中间产物Cs3Bi2Br9以及少量的目标产物Cs2AgBiBr6,说明合成反应不充分,而且杂相Cs3Bi2Br9比Cs2AgBiBr6更易合成。主要原因在于,Cs+、 Bi3+、 Br-的离子半径较大,Ag+的离子半径较小,Cs2AgBiBr6因引入Ag+造成离子不匹配,导致Cs2AgBiBr6晶体结构不稳定;高价元素易失去电子,低价元素易获取电子,高价元素与低价元素之间的化学反应通常更容易进行,Bi3+的价态比Ag+高且更具还原性,在这种情况下,Bi3+更容易与Br-成键形成Cs3Bi2Br9。2018年,Han等[20]采用密度泛函理论计算Cs2AgBiBr6、 Cs3Bi2Br9以及AgBr的形成能,准确地预测了Cs3Bi2Br9和AgBr的热力学性能相对于Cs2AgBiBr6的不稳定性,Cs3Bi2Br9比Cs2AgBiBr6具有更低的形成能量,即外界提供少量能量即可合成三维无机中控框架结构,推测合成过程中所发生的化学反应式为
3CsBr+2BiBr3![]() Cs3Bi2Br9
Cs3Bi2Br9
,
(1)
Cs3Bi2Br9+2AgBr+CsBr![]() 2Cs2AgBiBr6
2Cs2AgBiBr6
。
(2)
由图1(b)可知, 球磨时间增加至15 min时, BiBr3、 CsBr、 AgBr、 Cs3Bi2Br9杂相显著减少。 由图1(c)可见, 与球磨时间为15 min时相比,球磨时间为60 min时,BiBr3、 CsBr、 AgBr、 Cs3Bi2Br9、 Cs2AgBiBr6物相的变化不明显。综上,球磨时间≤15 min时,球磨罐内主要发生Cs2AgBiBr6纳米粉体的合成反应;球磨时间>15~60 min时,物相变化不明显;球磨时间>60 min时,球磨罐内主要进行Cs2AgBiBr6纳米粉体的破碎和提纯。
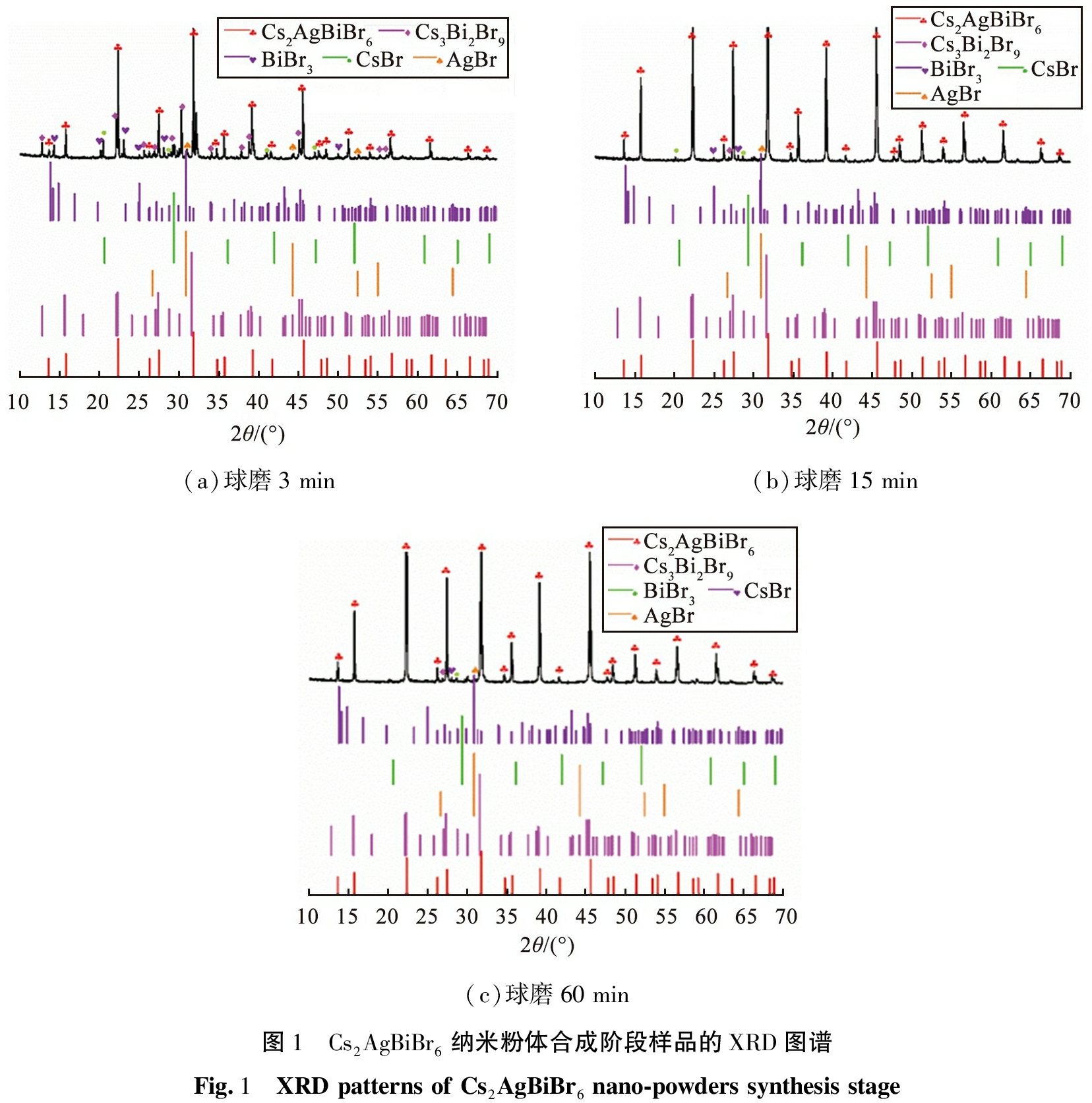
(a)球磨3 min(b)球磨15 min(c)球磨60 min图1 Cs2AgBiBr6纳米粉体合成阶段样品的XRD图谱Fig.1 XRD patterns of Cs2AgBiBr6 nano-powders synthesis stage
Cs2AgBiBr6纳米粉体破碎和提纯阶段样品的XRD图谱如图2所示。由图2(a)可见,球磨时间为2、 3、 4 h时, 主要有目标产物Cs2AgBiBr6和杂相AgBr,该阶段以破碎杂相AgBr为主。 由图2(b)可见, 球磨时间为8 h时, 仅观察到微弱AgBr的衍射峰; 球磨时间为12 h时, AgBr衍射峰消失; 球磨时间为16 h时,未见AgBr衍射峰;AgBr衍射峰峰强随时间的增加逐渐减小,AgBr中的Ag元素不断进入Cs3Bi2Br9晶格中的原始空位,形成Cs2AgBiBr6,此时Ag和Bi原子交替排列形成有序的岩盐结构;球磨时间分别为8、 12、 16 h时,该阶段以提纯目标产物Cs2AgBiBr6为主。综上,考虑到时间成本,最佳球磨时间为12 h。
为了进一步确定球磨时间为12 h时Cs2AgBiBr6纳米粉体的物相纯度,采用脉冲激光沉积技术将Cs2AgBiBr6粉体制成薄膜状平铺到玻璃衬底上,用波长为532 nm的激光扫描薄膜表面。球磨时间为12 h时的Cs2AgBiBr6纳米粉体5个扫描点的光谱图如图3所示。由图3(a)所示为选定的5个定点作为扫描点所在区域。图3(b)所示为5个扫描点的光谱图,谱型一致,说明制得的Cs2AgBiBr6纳米粉体高度均匀。图3(c)所示为第2个扫描点的光谱图,根据拉曼位移特征峰的位置说明Cs2AgBiBr6纳米粉体为纯相,Ag—Br键的结合强度比Bi—Br键的结合强度强得多, Cs2AgBiBr6可被视为一个离散的类实体,![]() 晶格振动占主导地位,
晶格振动占主导地位,![]() 拉曼模式将被隐藏,拉曼位移在73.61、 134.09、 176.00 cm-1处的峰位分别属于
拉曼模式将被隐藏,拉曼位移在73.61、 134.09、 176.00 cm-1处的峰位分别属于![]() 八面体亚晶格引起的呼吸振动T2g、 非对称拉伸振动Eg和对称拉伸振动A1g模式,并满足关系式
八面体亚晶格引起的呼吸振动T2g、 非对称拉伸振动Eg和对称拉伸振动A1g模式,并满足关系式![]()
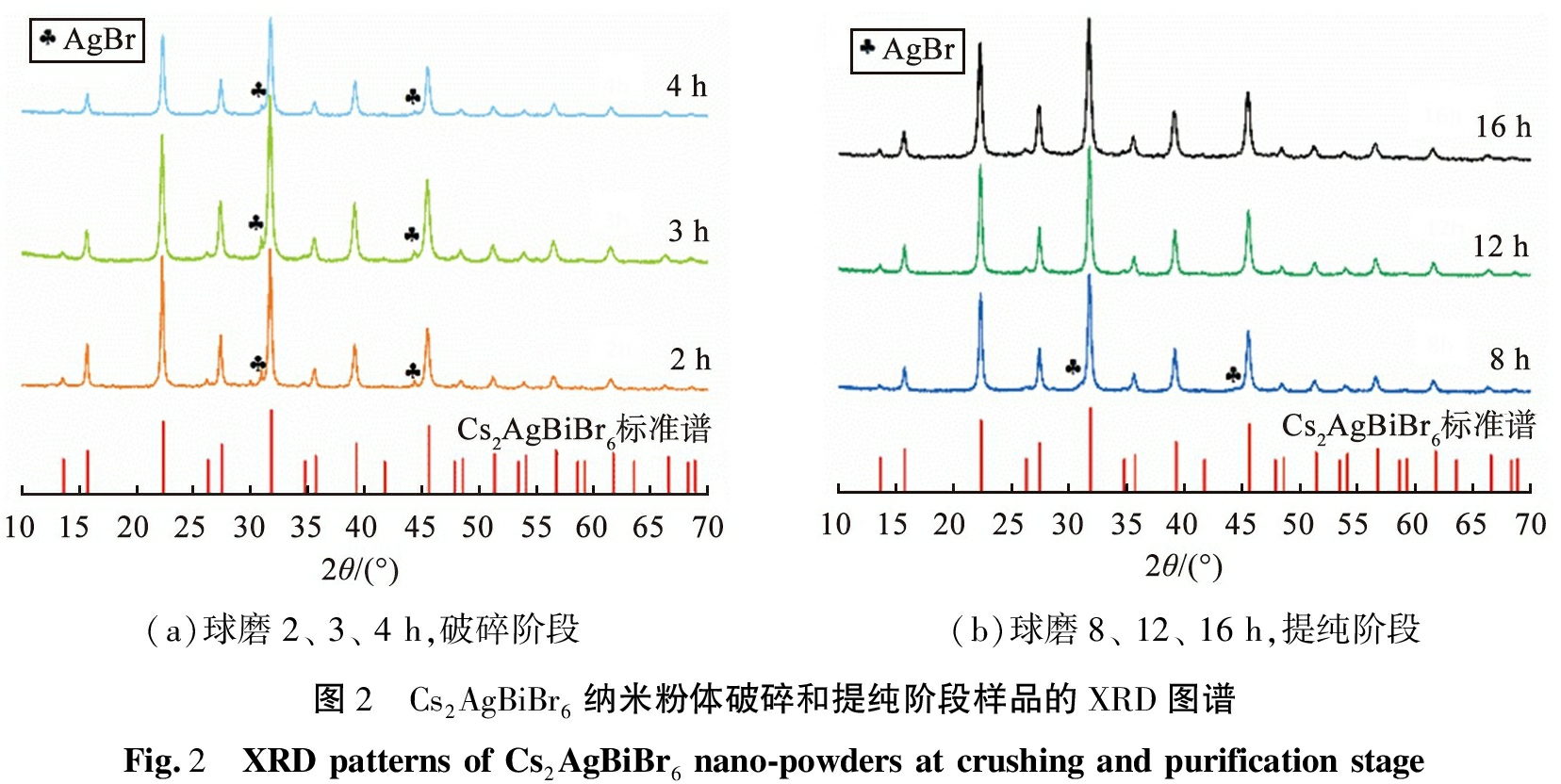
(a)球磨2、 3、 4 h,破碎阶段(b)球磨8、 12、 16 h,提纯阶段图2 Cs2AgBiBr6纳米粉体破碎和提纯阶段样品的XRD图谱Fig.2 XRD patterns of Cs2AgBiBr6 nano-powders at crushing and purification stage
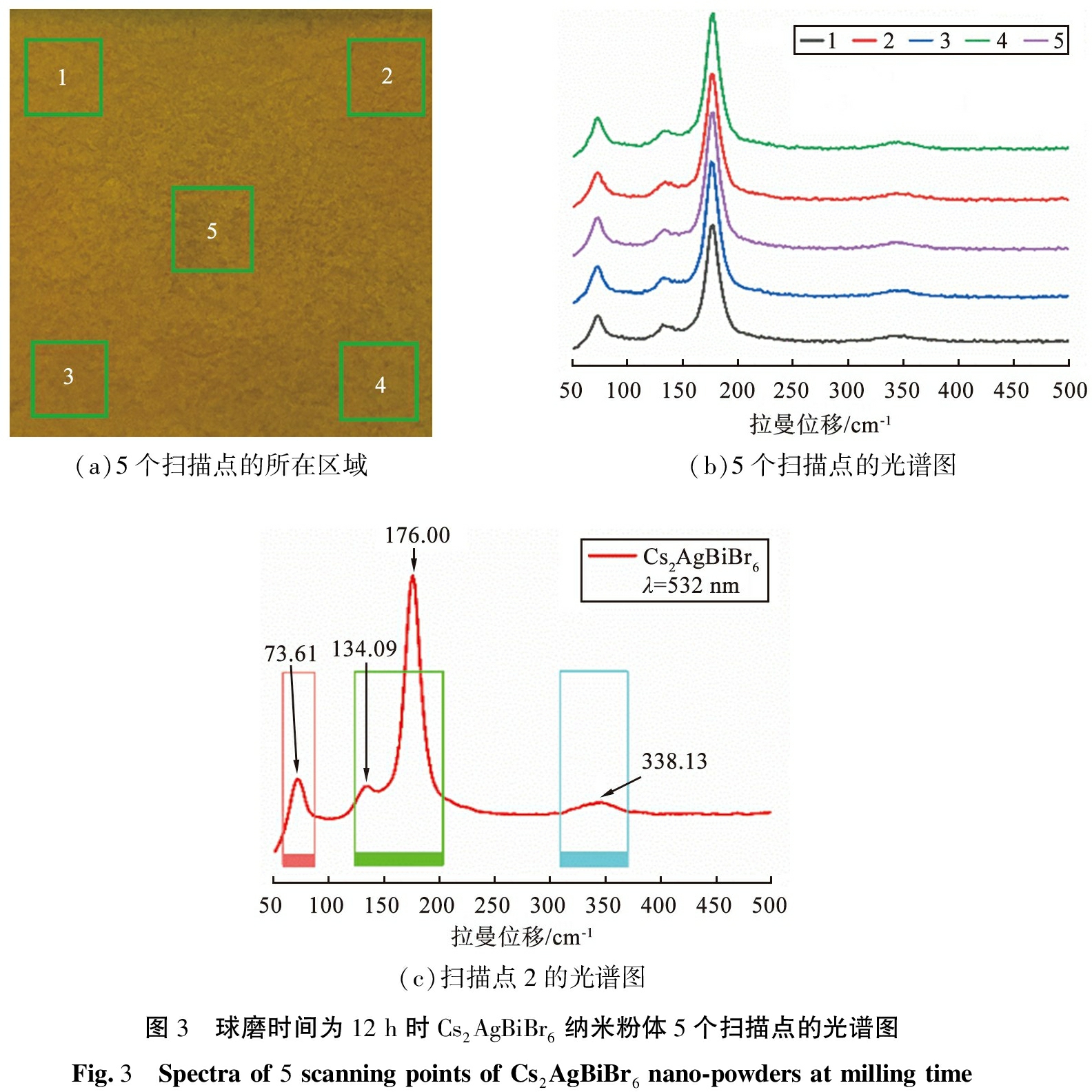
(a)5个扫描点的所在区域(b)5个扫描点的光谱图(c)扫描点2的光谱图图3 球磨时间为12 h时Cs2AgBiBr6纳米粉体5个扫描点的光谱图Fig.3 Spectra of 5 scanning points of Cs2AgBiBr6 nano-powders at milling time
图4为扫描点2的拉曼位移峰强度分布图像, 利用夹峰法显示拉曼位移特征峰的强度分布。 图4(a)为拉曼位移在73.61 cm-1时的强度分布; 图4(b)为拉曼位移为134.09 ~176.00 cm-1时的强度分布; 图4(c)为拉曼位移在338.13 cm-1时的强度分布。 可以看出, 拉曼位移在73.61、 134.09、176.00 cm-1时的强度分布高,晶格振动属于高能量振动,而拉曼位移在338.13 cm-1时的强度分布低,晶格振动属于低能量振动。
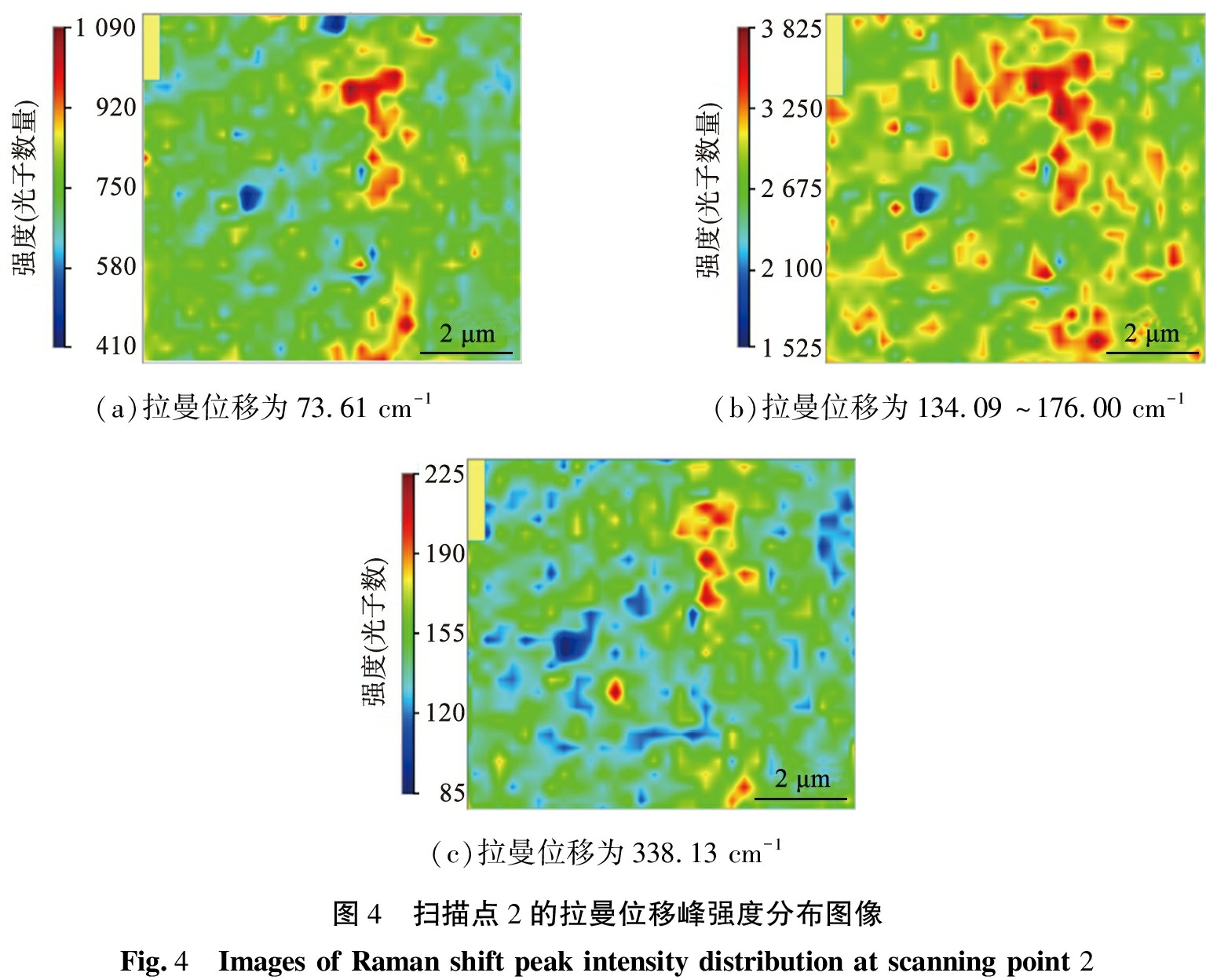
(a)拉曼位移为73.61 cm-1(b)拉曼位移为134.09 ~176.00 cm-1(c)拉曼位移为338.13 cm-1图4 扫描点2的拉曼位移峰强度分布图像Fig.4 Images of Raman shift peak intensity distribution at scanning point 2
2.2 粒径与形貌分析
不同球磨时间时Cs2AgBiBr6纳米粉体的粒径分布如图5所示。由图5(a)可见,球磨时间为0.05 h时, 颗粒粒径为微米量级, 增加球磨时间后, 研磨球与物料碰撞产生机械能, 原本较大的颗粒被碾压并不断细化。 由图5(b)可见,球磨时间为0.25 h时,平均粒径为10.67 μm。由图5(c)可见,当球磨时间为1 h时,平均粒径为7.19 μm。由图5(d)可见,球磨时间到达8 h后,颗粒粒径减小至纳米级别。由图5(e)可见,球磨时间增加至12 h后,颗粒粒径减小速度缓慢,甚至趋于稳定。激光粒度分析仪得出的颗粒数量分布显示出每个大小类别的粒子具有的数量,在体积分数分布中,较大的粒子的影响要远远大于较小颗粒,体积分数分布提供的信息始终偏向于大颗粒,有时较小的粒子即使在数量上很显著,在体积分数分布中也可能看不见,因此当到达纳米级别后,颗粒粒径测试结果由体积分数分布转变为颗粒数量分布。
通过力学碾压和机械能将原料进行扰动加工后,Cs2AgBiBr6纳米粉体颗粒形态也由初期的条棒状结构变成棱状小颗粒,不同球磨时间时的扫描电镜图像如图6所示。由图6可见,Cs2AgBiBr6纳米粉体微观结构越来越规则,表面粗糙度逐渐减小,颗粒团聚现象逐渐消失。
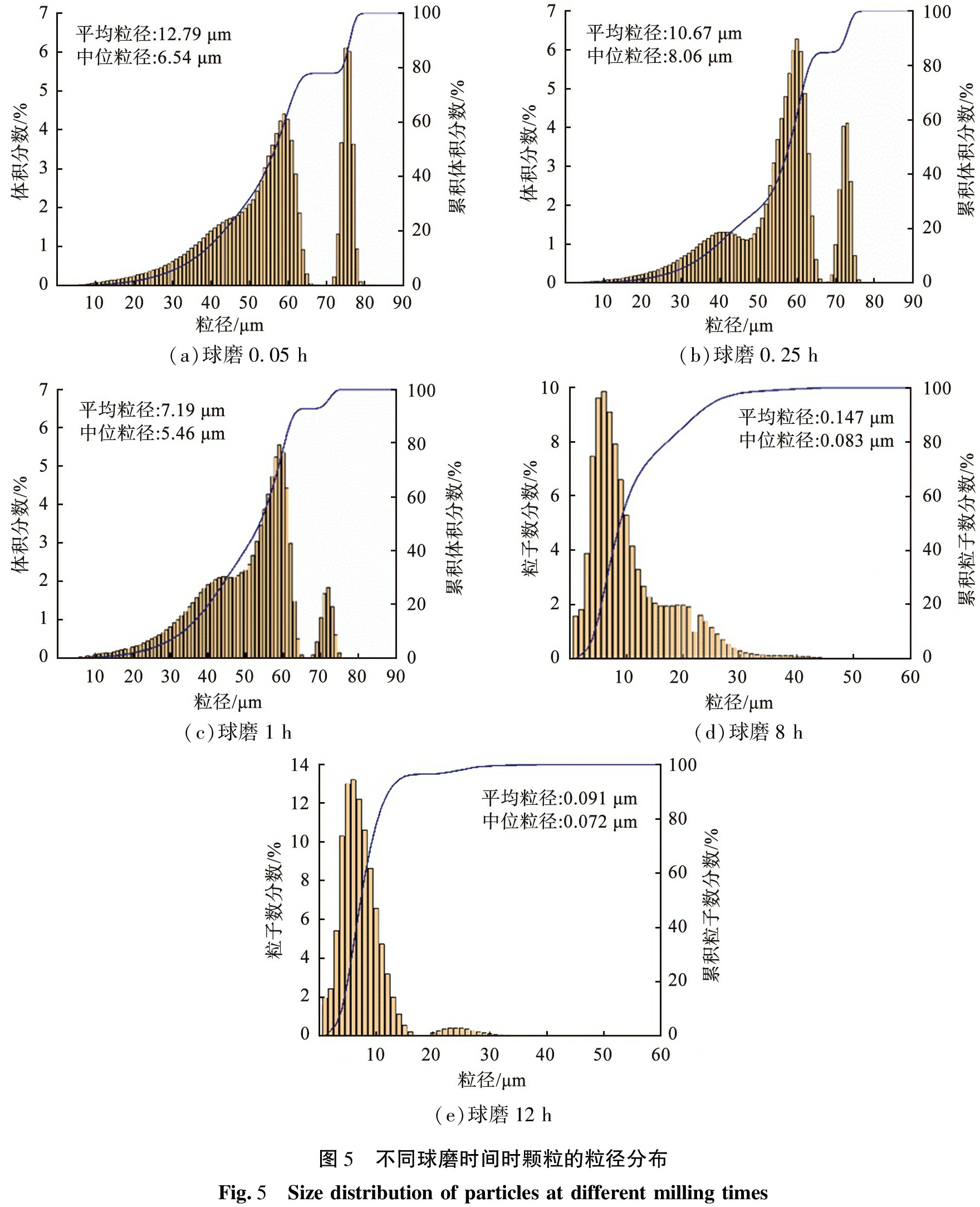
(a)球磨0.05 h(b)球磨0.25 h(c)球磨1 h(d)球磨8 h(e)球磨12 h 图5 不同球磨时间时颗粒的粒径分布Fig.5 Size distribution of particles at different milling times

(a)球磨0.05 h(b)球磨0.25 h(c)球磨1 h(d)球磨8 h(e)球磨12 h图6 不同球磨时间时Cs2AgBiBr6纳米粉体的扫描电镜图像Fig.6 SEM images of Cs2AgBiBr6 nano-powders under different milling time
球磨时间为12 h时Cs2AgBiBr6纳米粉体不同放大倍率下的TEM图像如图7所示。由图7可见,Cs2AgBiBr6纳米粉体均匀分布,可以观察到Cs2AgBiBr6纳米粉体微观结构为棱形状态。
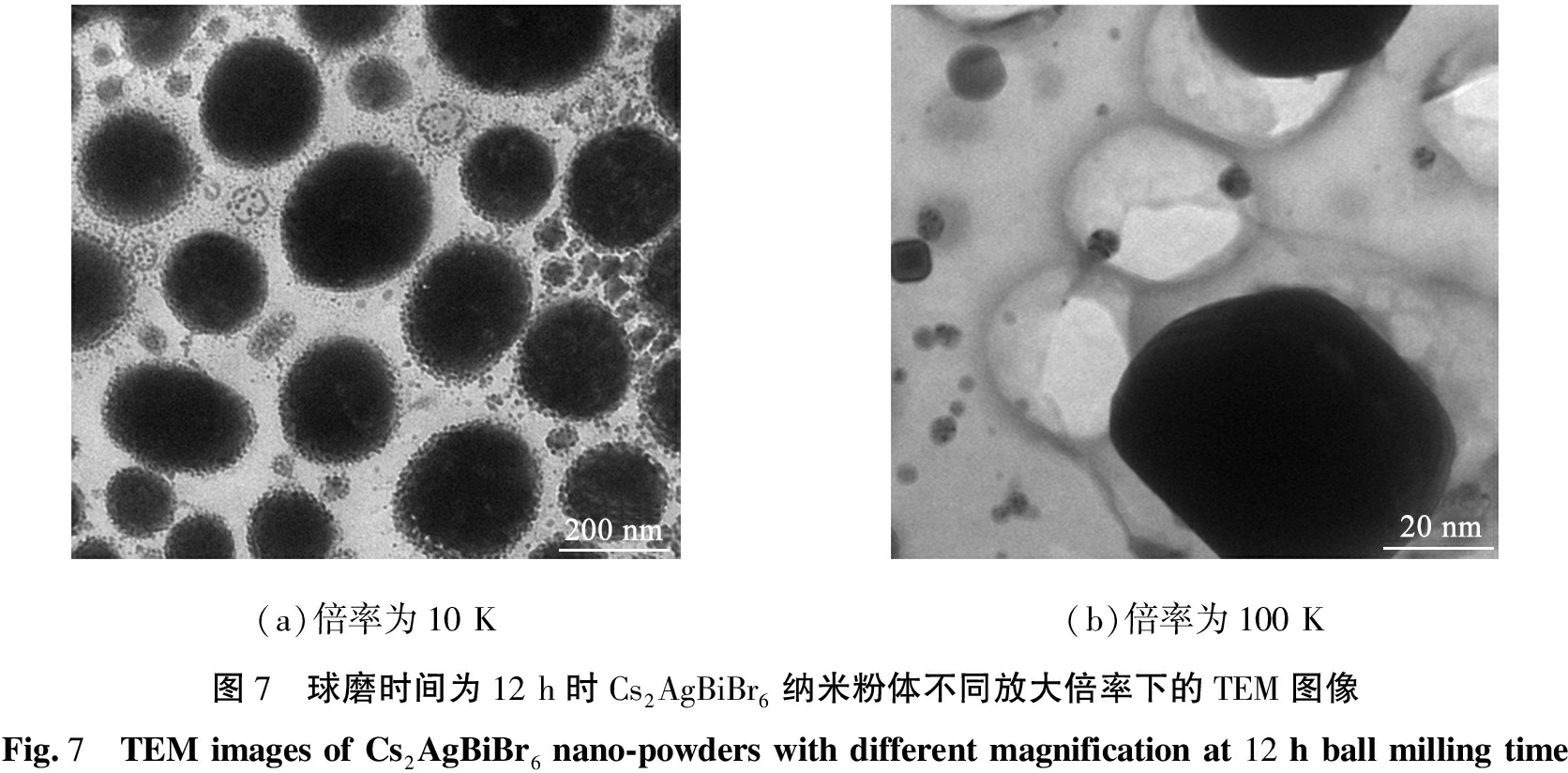
(a)倍率为10 K(b)倍率为100 K 图7 球磨时间为12 h时Cs2AgBiBr6纳米粉体不同放大倍率下的TEM图像Fig.7 TEM images of Cs2AgBiBr6 nano-powders with different magnification at 12 h ball milling time
2.3 热重分析
Cs2AgBiBr6纳米粉体的热重分析如图8所示。无铅双钙钛矿Cs2AgBiBr6纳米粉体在升温速率10 ℃/min, 温度范围为30~800 ℃下的热重曲线(TG)如图8(a)所示,在温度为430 ℃时Cs2AgBiBr6纳米粉体开始分解,失质量分数为39.19%,温度为800 ℃时,剩余样品质量分数不足20%。对图8(a)的曲线进行一阶求导得到微商热重(DTG)曲线,如图8(b)所示,失质量速率最大的温度点在540 ℃。在温度高达430 ℃时,无铅双钙钛Cs2AgBiBr6表现出高热稳定性,温度远高于有机无机杂化钙钛矿MAPbI3。
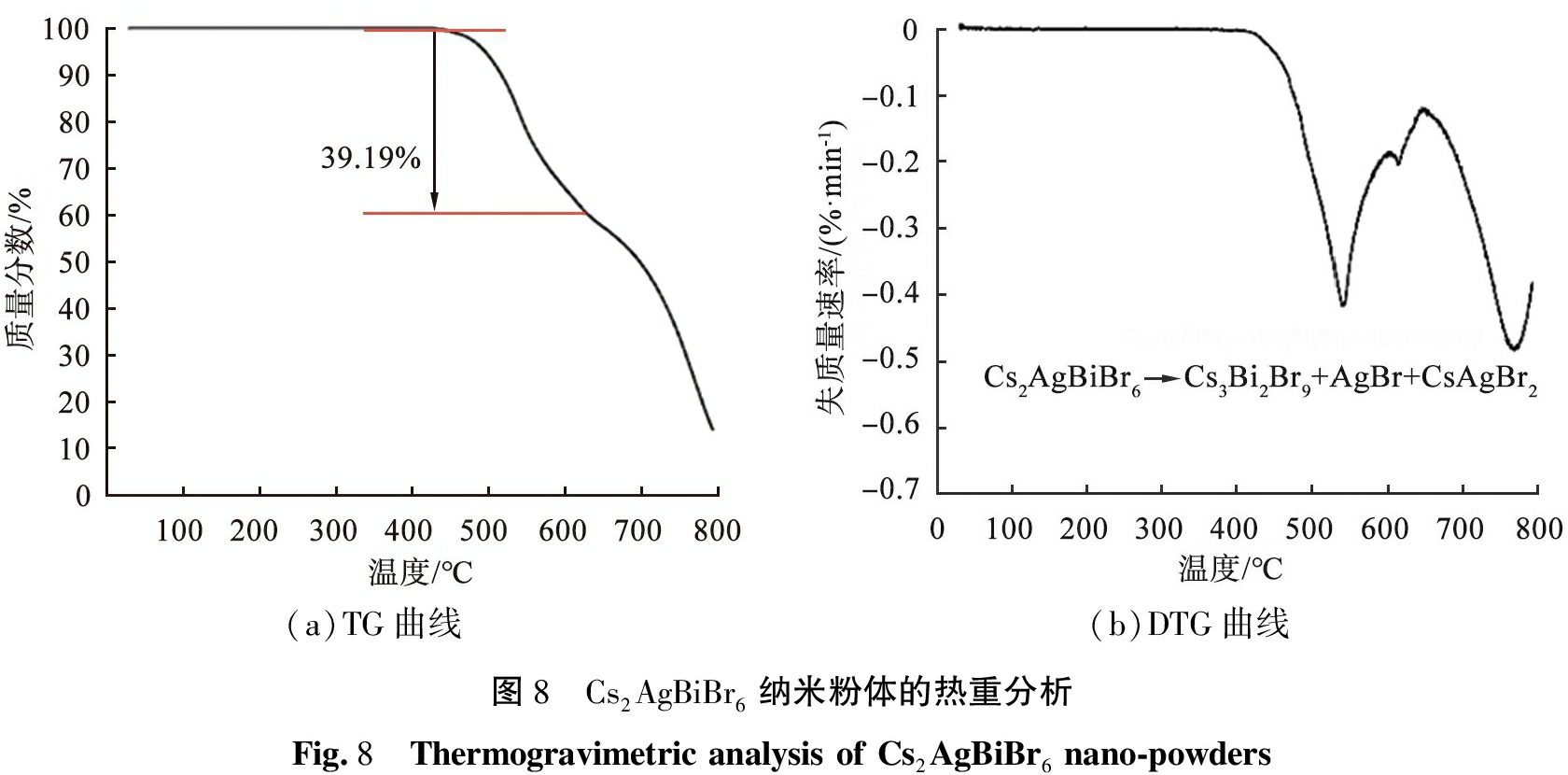
(a)TG曲线(b)DTG曲线图8 Cs2AgBiBr6纳米粉体的热重分析Fig.8 Thermogravimetric analysis of Cs2AgBiBr6 nano-powders
2.4 光学性质分析
图9为Cs2AgBiBr6的光学性质分析。Cs2AgBiBr6纳米粉体的紫外-可见(UV-Vis)吸收光谱如图9(a)所示, Cs2AgBiBr6具有间接带隙特性, 声子辅助跃迁能分别为1.82、 2.12 eV, 其中第1个吸收边对应于电子从价带跃迁到导带吸收光子所需的能量, 第2个吸收边是由于电子从价带到导带需要与晶格振动相互作用即光子-声子散射产生的, 二者结合表明间接带隙宽度(Eg)为1.97 eV, 表现出具有宽吸收范围。 Cs2AgBiBr6的稳态PL光谱如图9(b)所示, Cs2AgBiBr6为宽发射峰, 说明当Cs2AgBiBr6被一定波长的光激发时, 可发出较宽波长范围的光。 宽PL信号可归因于声子辅助的自陷激子复合。 Cs2AgBiBr6的宽发射峰可以提供更宽的发光范围, 对于光电子器件中的光吸收和发射过程具有重要意义。
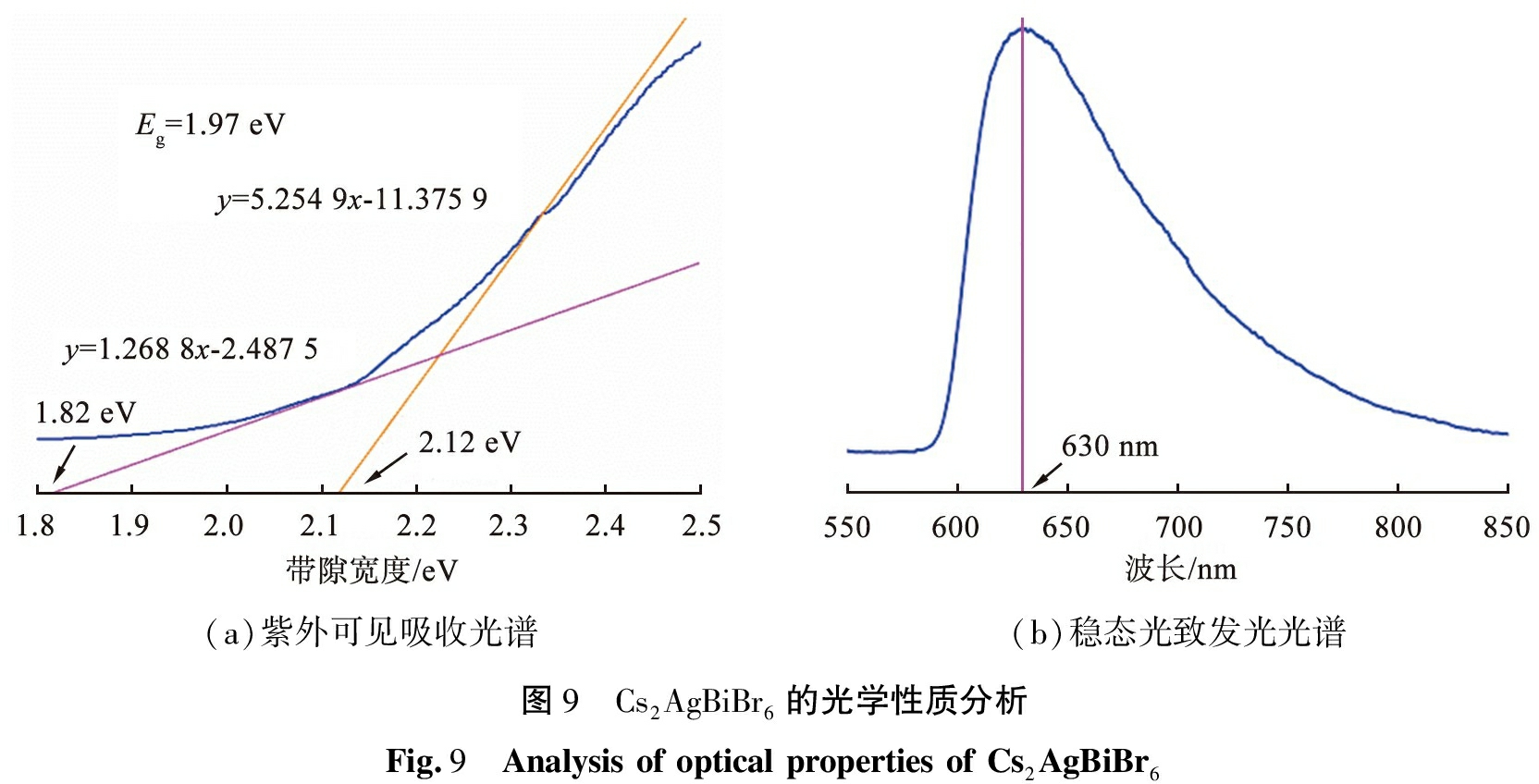
(a)紫外可见吸收光谱(b)稳态光致发光光谱图9 Cs2AgBiBr6的光学性质分析Fig.9 Analysis of optical properties of Cs2AgBiBr6
3 结论
机械球磨法具有成本低、 工艺简单、 产量大等优点,本文中利用机械球磨法制备Cs2AgBiBr6纳米粉体,研究球磨时间对Cs2AgBiBr6纳米粉体的纯度、 粒径和微观形貌的影响,取得最佳制备工艺条件;对Cs2AgBiBr6纳米粉体进行测试和表征,并研究Cs2AgBiBr6纳米粉体的光学性质和热稳定性。
1)当转速为500 r/min,研磨球与物料的质量比为4.5∶1时,球磨法制备Cs2AgBiBr6纳米粉体的最佳球磨时间为12 h。
2)在最佳工艺条件下,制得纯相无铅双钙钛矿Cs2AgBiBr6纳米颗粒粒径约为100 nm。
3)所制得的Cs2AgBiBr6纳米粉体的光学带隙宽度为1.97 eV,发光峰在波长为630 nm处,温度在430 ℃时开始发生分解,温度为540 ℃时样品分解最快。
[1]ZHANG Z H, WU C C, WANG D, et al. Improvement of Cs2AgBiBr6 double perovskite solar cell by rubidium doping[J]. Organic Electronics, 2019, 74(11): 204-210.
[2]ZHOU Y, YUAN B L, WEI H M, et al. Stable CsPbX3 mixed halide alloyed epitaxial films prepared by pulsed laser deposition[J]. Applied Physics Letters, 2022, 120(11): 112109.
[3]LIU X H, YAN K, TAN D W, et al. Solvent engineering improves efficiency of lead-free tin-based hybrid perovskite solar cells beyond 9%[J]. American Chemical Society Energy Letters, 2018, 3(11): 2701-2707.
[4]NOEL N K, STRANKS S D, ABATE A, et al. Lead-free organic-inorganic tin halide perovskites for photovoltaic applications[J]. Energy and Environmental Science, 2014, 7(9): 3061-3068.
[5]VOLONAKIS G, FILIP M R, HAGHIGHIRAD A A, et al. Lead-free halide double perovskites via heterovalent substitution of noble metals[J]. The Journal of Physical Chemistry Letters, 2016, 7(7): 1254-1259.
[6]BEKENSTEIN Y, DAHL J C, HUANG J M, et al. The making and breaking of lead-free double perovskite nanocrystals of cesium silver-bismuth halide compositions[J]. Nano Letters, 2018, 18(6): 3502-3508.
[7]YANG B, HONG F, CHEN J S, et al. Colloidal synthesis and charge-carrier dynamics of Cs2AgSb1-yBiyX6 (X: Br, Cl; 0≤y≤1) double perovskite nanocrystals[J]. Angewandte Chemie International Edition, 2019, 58(8): 2278-2283.
[8]LI Q, WANG Y G, PAN W C, et al. High pressure band gap engineering in lead-free Cs2AgBiBr6 double perovskite[J]. Angewandte Chemie International Edition, 2017, 56(50): 15969-15973.
[9]ZHANG Z Y, SUN Q D, LU Y, et al. Hydrogenated Cs2AgBiBr6 for significantly improved efficiency of lead-free inorganic double perovskite solar cell[J]. Nature Communications, 2022, 13(1): 3397.
[10]HE Y Z, ZHOU Y F, WANG Q, et al. Design and performance exploration of a lead-free all-inorganic hydrogenated Cs2AgBiBr6-based double perovskite solar cell: a numerical modeling study[J]. Solar Rapid Research Letters, 2023, 7(10): 2300030.
[11]YANG J, BAO C X, NING W H, et al. Stable, high-sensitivity and fast-response photodetectors based on lead-free Cs2AgBiBr6 double perovskite films[J]. Advanced Optical Materials, 2019, 7(13): 1801732.
[12]WU D F, TAO Y, HUANG Y Y, et al. High visible-light photocatalytic performance of stable lead-free Cs2AgBiBr6 double perovskite nanocrystals[J]. Journal of Catalysis, 2021, 397(5): 27-35.
[13]YANG L, LI Y P, ZHANG W, et al. Promoting optoelectronic properties of Cs2AgBiBr6 nanocrystals by formation of heterostructures with BiOCl nanosheets[J]. Chemical Communications, 2022, 58(56): 7765-7768.
[14]JIANG Y Q, LI K, WU X, et al. In situ synthesis of lead-free halide perovskite Cs2AgBiBr6 supported on nitrogen-doped carbon for efficient hydrogen evolution in aqueous HBr solution[J]. American Chemical Society Applied Materials and Interfaces, 2021, 13(8): 10037-10046.
[15]LOW Y J, LIEW J , KAMARUDIN M A, et al. Synthesis of cesium silver bismuth bromide double perovskite nanoparticles via a microwave-assisted solvothermal method[J]. Materials Today Chemistry, 2023, 29(3):101477.
[16]ZHU Z Y, YANG Q Q, GAO L F, et al. Solvent-free mechanosynthesis of composition-tunable cesium lead halide perovskite quantum dots[J]. The Journal of Physical Chemistry Letters, 2017, 8(7): 1610-1614.
[17]SADHUKHAN P, KUNDU S, ROY A, et al. Solvent-free solid-state synthesis of high yield mixed halide perovskites for easily tunable composition and band gap[J]. Crystal Growth and Design, 2018, 18(6): 3428-3432.
[18]BRETERNITZ J, LEVCENKO S, HEMPEL H, et al. Mechanochemical synthesis of the lead-free double perovskite Cs2[AgIn]Br6 and its optical properties[J]. Journal of Physics: Energy, 2019, 1(2): 025003.
[19]MUSCARELLA L A, HUTTER E M. Halide double-perovskite semiconductors beyond photovoltaics[J]. American Chemical Society Energy Letters, 2022, 7(6): 2128-2135.
[20]HAN D, ZHANG T, HUANG M L, et al. Predicting the thermodynamic stability of double-perovskite halides from density functional theory[J]. Applied Physics Letters Materials, 2018, 6(8): 084902.