锂离子(Li+)具有优越的化学特性,如高比热容和低膨胀系数[1],被广泛应用于高容量锂电池[2]、 航空航天[3]和核能[4]等先进工业领域。一般情况下,锂元素从矿石和盐湖卤水中提取,矿石提取方法通常采用煅烧法[5],这种方法不仅成本高昂,而且对环境造成严重污染。相比之下,从盐湖卤水中提取Li+更加环保,并且具有操作简便和低耗能的优势。此外,与从矿石中提取锂相比,从盐湖卤水中提取锂的成本通常能降低30%~50%[6],然而,盐湖卤水中共存离子的干扰会对高纯度提取锂产生影响,尤其是与锂具有相似化学性质的Mg2+的影响[7]。高镁、 锂浓度比率(magnesium-lithium concentration ratio,MLR)成为限制富锂盐湖有效利用的因素[8-10],因此,迫切需要开发一种高效率且低成本的新方法用于解决高MLR盐湖中镁、 锂的分离问题。
迄今为止,研究人员已经探索了结晶沉淀法[11-12]、 溶剂萃取[13-16]、 电解法[17-18]、 膜法[19-22]和吸附方法[16,23-24]等技术用于从盐湖卤水中分离镁、 锂并提取锂。结晶沉淀法利用离子的溶解度差异,通过调节物理条件,将不同离子分离。该方法工艺复杂, 产物纯度低, 能耗高且分离率低。溶剂萃取法是利用溶剂与离子形成配合物,通过不同配体将离子分离的方法,但选取不同的溶剂会导致分离效果不佳。电解法通过对溶液施加电场、 电流等方法,使离子发生电解反应后进行分离,该方法操作复杂且效率受限。膜法是利用选择性膜材料,在不同压力差或者浓度差条件下进行镁、 锂分离。近年来,纳滤膜法作为一种热门方法,基于离子的化学特性和静电特性将离子分离[25-26]。虽然该方法具有连续操作和高通量的优点,但成本高昂。溶剂萃取和吸附工艺主要用于回收高MLR盐湖卤水中的锂[27],吸附剂对锂具有较高的选择性,然而它们在工业应用中受到效率和成本的限制,离子分离效果不明显,吸附能力难以进一步提高[28-32]。一些研究表明,纳滤膜可以有效地分离盐湖卤水中的Mg2+和Li+,但膜结垢问题严重限制了分离性能的提高[19-22,33-34]。如何从盐湖卤水中有效分离Mg2+、 Li+并且提取Li+任然是工业界面临的一大难题。
针对从高MLR盐湖卤水中镁、锂分离的工业需求,研究者开始在微流控系统中利用离子浓差极化效应(ion concentration polarization,ICP)结合离子交换膜(ion exchange membrane,IEM)进行离子分离[35-37],从而实现无需化学试剂的离子提取过程,具有经济环保的优势。ICP是指在膜界面处阳离子或阴离子的选择性运输产生的浓度梯度,该方法通过在IEM上施加外部电压,由于膜的离子选择性,只有极少量的反离子能够通过膜,导致界面附近的电解质溶液中的反离子浓度降低,因此,在膜界面形成离子耗竭区(ion depletion zone,IDZ),同时为了满足溶液中的电中性条件,同电荷的离子浓度也相应降低[38]。近期,学者对基于ICP的离子分离进行了深入研究,取得了一些显著进展。例如,Wang等[39]开发了一种基于纳米流体过滤器的电动力学捕获装置,该装置用于在微流控系统中实现高效样品预浓缩。通过光刻和蚀刻技术,在微通道内形成扩展的空间电荷区,从而有效地收集和捕获离子。研究结果表明,电动力学能够以小时为单位实现离子捕获,并且所收集溶液中的离子浓度系数(某元素或难分解化合物的浓度同它所生存的环境中该物质的浓度比值)高达106~108。该装置具备操作简便、性能优越等优点,为各类生物分析微系统的发展奠定了坚实基础,但系统的可靠性还需进一步研究。此外,Gong等[40]的研究发现,通过利用电场放大效应,可以在微通道中将Li+集中,通过电场力与流场力的调控实现离子的富集和分离,然而,这种方法的Li+回收率较低,难以实现大规模生产。为此,Gong等[41]提出了一种分叉微通道离子分离系统,由主微通道、缓冲微通道和纳米结组成,利用ICP产生的电场放大效应实现离子浓缩和分离。尽管通过该系统在出口处可以收集到富锂溶液,Li+浓度较高且MLR有所下降,但在大规模、高效提取和分离离子的技术中仍然存在一些问题;最近的研究中,Tang等[42]提出了一种基于ICP的海水淡化微通道并行方案,然而,该系统缺乏对比实验验证,并且尚未经过进一步优化。基于上述系统的仿真和初步实验结果,韩国Postech团队[43]在宏观尺度上构建了并行电动迁移实验装置,验证了不同粒子运行路径的差异性。此外,荷兰Twente大学的Eijkel课题组[44]利用自由流动的带电粒子富集方法(free flow ICP focusing,FF-ICP)从盐湖卤水溶液中成功分离了Li+和Mg2+,证实了这种方法的可行性,但该实验的成功率仅为0.77。
基于先前所研究系统在各方面的限制,针对高MLR盐湖卤水的离子分离问题,本文中提出了一种含有水平障碍的电泳分离微流控系统。在该系统中,微通道结构调节带电离子的内部力场,并通过施加电场力FE和流场力FD,使Li+在宽度较窄的区域达到受力平衡,而Mg2+则在障碍前端先行分离,实现2种离子的分离。该系统避免了使用离子选择性膜,具有简单易操作、成本低廉等优点,在海水淡化和盐湖提锂等领域,具有广阔的应用前景,突破了传统离子交换和膜分离技术的限制,具有很高的工业应用价值和学术研究意义。
1 物理与数值模型
1.1 物理模型
图1(a)所示为基于电泳原理调节流场分布实现Mg2+和Li+高效分离的二维系统。该系统利用离子的电泳迁移率差异实现离子在微通道中的分离,并通过调节系统的运行参数而改变流场分布。系统由入口模块、 障碍模块和出口模块3部分组成,入口模块包括并列的盐湖卤水入口和缓冲溶液入口。流场力公式为
FD=RFΔph2/32μL,
(1)
式中: R为气体常数; F为法拉第常数; μ为电泳迁移率; h为通道宽度; L为通道长度; p为压力。
电场力公式
FE=qE,
(2)
式中: FE为电场力; q为带电粒子的电荷量; E为电场强度。
由式(1)、 (2)可知,FD与通道宽度成正比,与μ成反比,FE与q成正比。Li+受到的电场力小,并且迁移速度较快,在窄通道实现受力平衡后,通过障碍形成的窄区域从右端出口流出,而Mg2+电荷量大,受到更大的电场力,受到的流场力小于Li+,横向迁移速度小于Li+,因此Mg2+先于Li+从障碍前端的出口处被分离,本系统的设计目标是通过调控流体流动力|FD|和电场力|FE|,实现镁、 锂分离的效果,因此,本文中在系统靠近右端出口处设置了5个障碍,障碍上端到底部的垂直距离遵循H=az2的平方关系(其中,z的取值依次选取2,3,4,a=20)。图中蓝色虚线表示KCl溶液入口,黄色虚线表示含有Li+、Na+、 K+、 Mg2+、 Cl-共5种离子的溶液入口,上端蓝色虚线处接地,表示Mg2+的出口,右端灰色虚线表示Li+出口,电压V0施加在下端绿色虚线处,离子通过实现电场力和水流力的平衡,不同离子的分离路径出现在微通道的不同位置[45-47]。
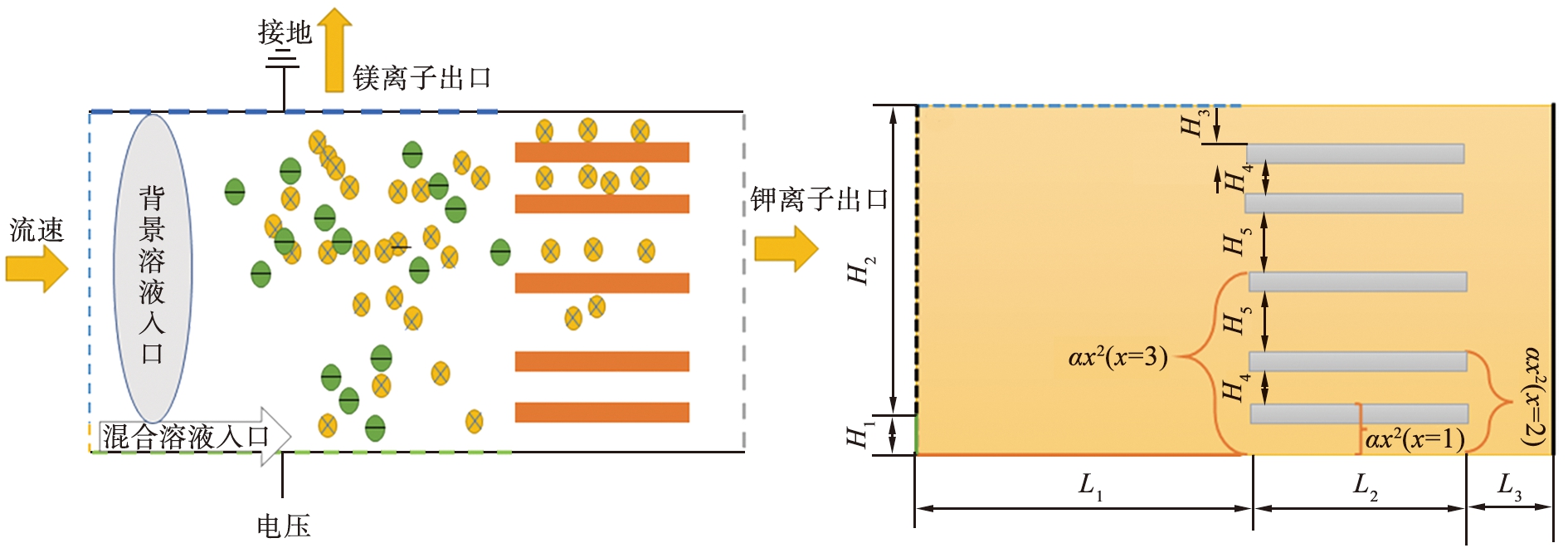
(a)几何结构 (b)尺寸图
图1 镁、 锂分离系统
Fig.1 Magnesium-lithium separation system
1.2 系统的初始参数设置
如图1(b)所示, 离子分离系统的具体尺寸参数为: L1=620 μm, L2=250 μm, L3=100 μm, H1=60 μm, H2=560 μm, H3=20 μm, H4=80 μm, H5=120 μm(其余物理参数见表1)。
表1 模拟盐湖卤水中各离子的动力学参数及初始浓度
Tab.1 Kinetic parameters and initial concentration of each ion in simulated salt lake brines
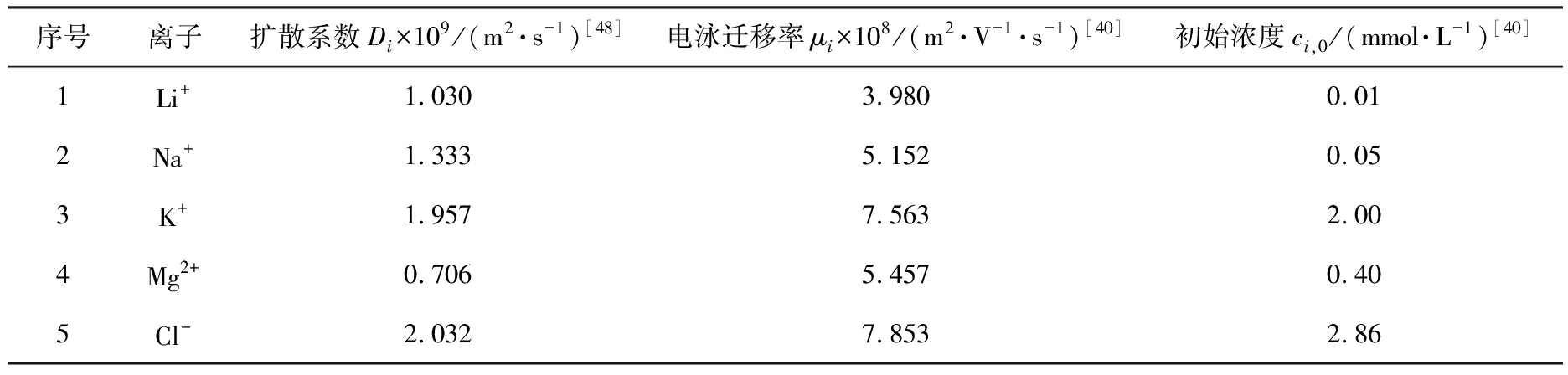
序号离子扩散系数Di×109/(m2·s-1)[48]电泳迁移率μi×108/(m2·V-1·s-1)[40]初始浓度ci,0/(mmol·L-1)[40]1Li+1.0303.9800.012Na+1.3335.1520.053K+1.9577.5632.004Mg2+0.7065.4570.405Cl-2.0327.8532.86
1.3 控制方程
系统动力学通过泊松-能斯特-普朗克(Poisson-Nernst-Plank,PNP)方程控制[49-50]。溶液中离子浓度由能斯特-普朗克(Nernst-Plank)方程确定:
∂ci/∂t=- ·Ji,
·Ji,
(3)
Ji=-(Di ci+Zi(DiF/RT)ci
ci+Zi(DiF/RT)ci Φ)+Uci,
Φ)+Uci,
(4)
式中: Di为扩散系数; Ji=Ji(x,y,t)为通量密度; ci=ci(x,y,t)为离子i的浓度; U为流体流速; T为绝对温度。式(4)中包含的3项多项式分别对应控制离子输运过程当中的扩散通量、 电迁移通量、 对流扩散通量。为方便起见,使用i=1,2,3,4,5代表Li+、 Na+、 K+、 Mg2+、 Cl-,化合价分别为Z1=Z2=Z3=1, Z4=2, Z5=-1,U=U(u,v)为流体流速,Ф为电势。
电势分布受Poisson方程控制
 ·(ε
·(ε Φ)=-ρe,
Φ)=-ρe,
(5)
式中: ε为溶液的介电常数; e为基本电荷;![]() 为空间电荷密度。
为空间电荷密度。
流体流动动力学由Navier-Stokes方程控制
(6)
 ·U=0,
·U=0,
(7)
式中: η为动态黏度;  ≡(∂/∂x, ∂/∂y)代表空间梯度算子(
≡(∂/∂x, ∂/∂y)代表空间梯度算子( 代表散度); ρ为流体密度。
代表散度); ρ为流体密度。
该仿真模型设置边界条件如下(其中x表示系统水平方向的长度; y表示系统竖直方向的长度,下同)。
在系统左边界(x=0),溶液入口水流速度为u0; 下端入口处(x=0,0≤y≤60 μm)所有离子浓度均为初始浓度;上端入口处(x=0,60 μm≤y≤620 μm)Cl-、 K+浓度均等于K+初始浓度:
U=(u0, v), ci=ci,0, c3=c5, i=1,2,3,4,5。
(8)
在L1边界(0≤x≤620 μm, y=0)处,电压为V0; K+、 Cl-的浓度均设置为K+初始浓度
Φ=V0, c5=c3=c3.0。
(9)
上端出口(0≤x≤620 μm, y=620 μm)处,电压接地;压力为0
Φ=0,  ci·n=0, i=1,2,3,4,5,
ci·n=0, i=1,2,3,4,5,
(10)
式中, n为本系统内流体计算域中的外法向单位向量。
系统右边界(x=970 μm, 0≤y≤620 μm),出口处压力为0;物质自由流出
p=0,  ci·n=0, i=1,2,3,4,5。
ci·n=0, i=1,2,3,4,5。
(11)
其他微通道壁面的流体速度设置为无滑移边界条件;所有离子均无法通过壁面
U=0, Ji·n=0, i=1,2,3,4,5。
(12)
仿真使用COMSOL软件中的稳态求解器求解,采用“蠕动流”界面建立溶液对流模型,通过耦合“稀物质传递运输”“蠕动流”和“静电学”界面求解PNP方程。仿真模拟从初始值开始线性扫描,得到高电势下的极度非线性收敛解,并调整具体参数,研究分离系统的性能。
2 结果与讨论
2.1 典型工况下的镁、锂分离机制
使用稳态参数(V0=11.5 V、 u0=990 μm/s)阐述该系统的分离机制, 使用回收率L评估系统的镁、 锂分离效果。 Li+回收率LLi定义为出口附近(x=800 μm, 0≤y≤620 μm,下同)与入口附近(x=1 μm,0≤y≤ 60 μm, 下同)水平方向离子通量积分的比值,Mg2+回收率LMg定义为出口附近(0≤x≤620 μm, y=619 μm,下同)竖直方向与入口附近水平方向离子通量积分的比值。具体表达式为:
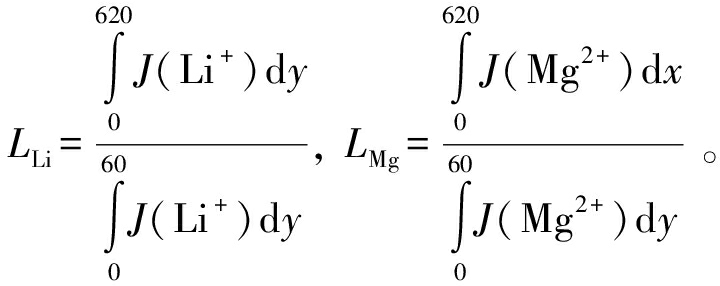
(13)
(a)电场强度
(b)流体流速
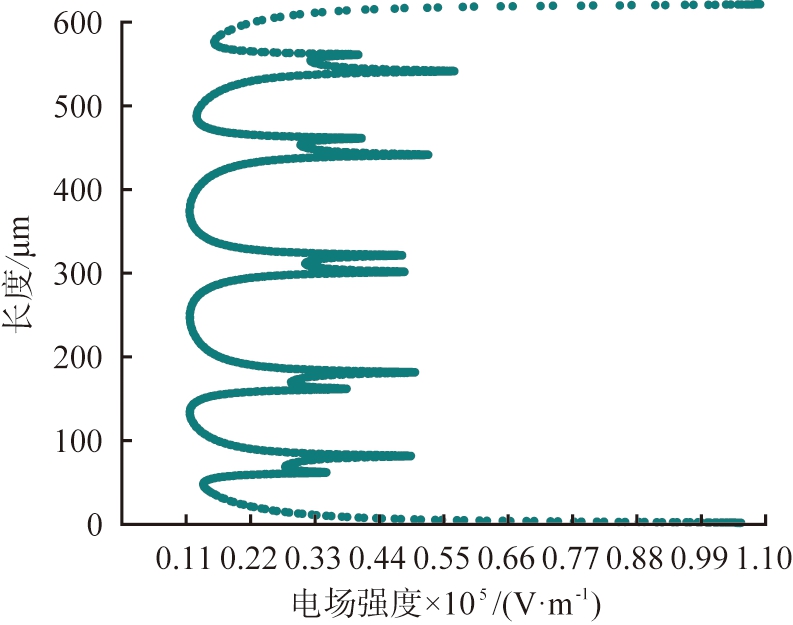
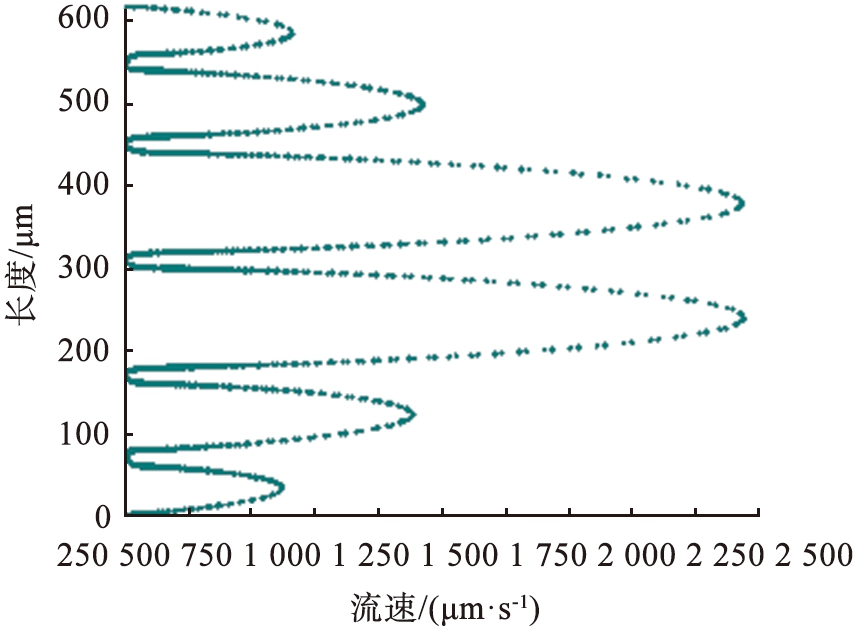
图2 系统参数随竖直位置的变化图
Fig.2 Plots of system parameters as a function of vertical position
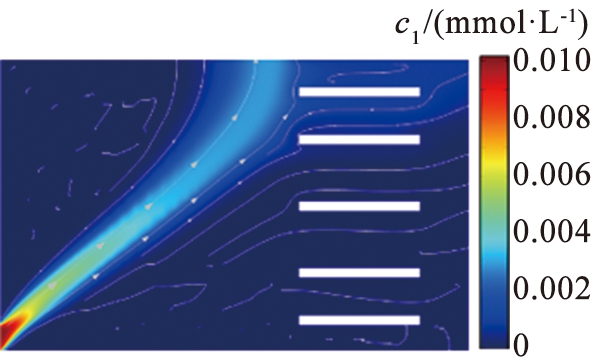
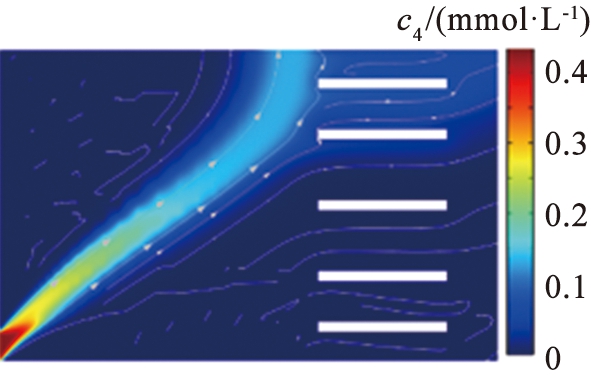
该电泳系统电场方向竖直向上,且从下至上越来越小,流场方向水平向右,水平障碍的设置使得边界水流速度较小,中间宽区域的水流速度最大,这种排布使得窄通道处的流速得到精准控制,避免速度显著增大出现涡旋导致流体回流现象,为离子提供更稳定、 更集中的分离区域。图2描述了电场强度和流速随竖直位置(x=619 μm,0≤y≤620 μm)的变化。在某些位置,电场强度和流速随位置均匀增加或减小。在障碍区域,由于电场线的偏转或弯曲以及通道宽度变窄,导致电场强度降低而水流速度急剧增加。在电压为11.5 V、 流速为990 μm/s的参数条件下,Mg2+和Li+的通量分布路径明显不同,浓度扩散区域呈现明显分叉,通过计算离子回收率可知,93%的Li+在右端出口处被分离,在该出口处Mg2+分离率仅为2.2%,97%的Mg2+在上端出口处被分离,而此处仅有3.5%的Li+被分离。由此可见,该系统实现了Mg2+和Li+的有效分离。
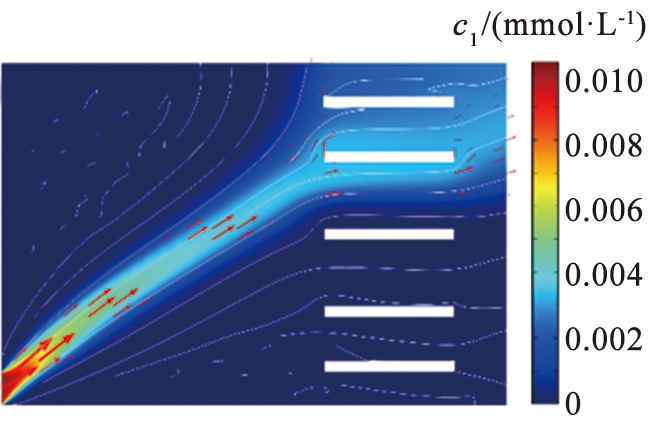
(a)锂离子
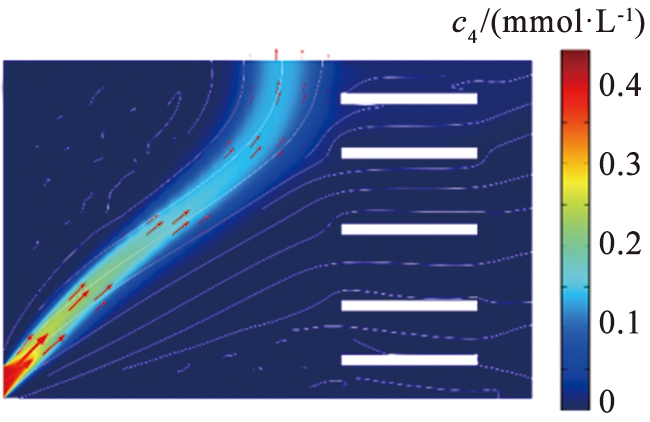
(b)镁离子
c1—锂离子浓度; c4—镁离子浓度。
图3 锂、 镁离子浓度图
Fig.3 Ion concentration diagram of lithiwm and magnesium
图3所示为电压为11.5 V、 流速为990 μm/s的条件下Li+和Mg2+的浓度分布。由于离子电泳淌度的差异,在电场作用下2种离子沿着与水平夹角不同的路径分离,Li+运行速度更快,Mg2+与水平轴夹角更大,Li+沿着右端出口扩散,2种离子在右上方的区域呈现分叉式分离。这种流速分布的特殊设计能够实现良好的分离效果,同时也为该系统的设计提供了新的思路。
2.2 外加电压对镁、锂分离效应的影响
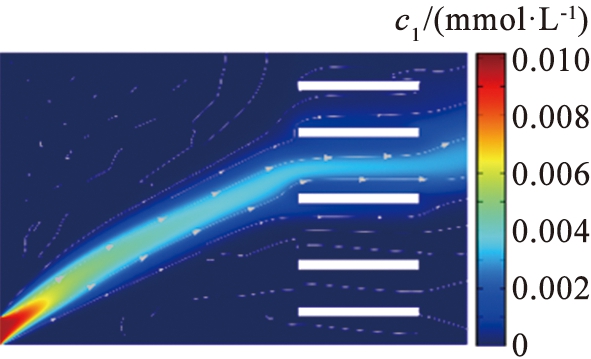
(a)V0=9.29 V
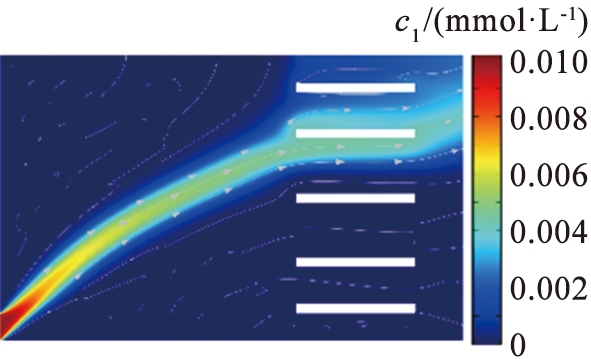
(b)V0=11.5 V
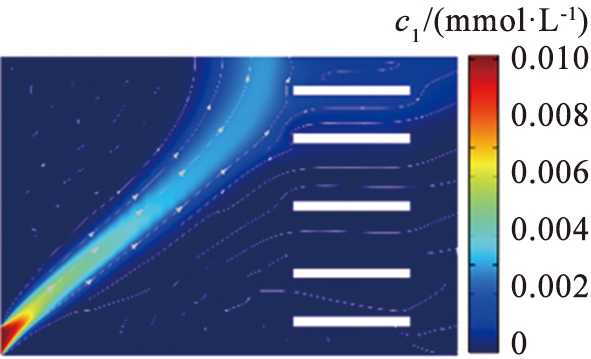
(c)V0=15.5 V
c1—锂离子浓度。
图4 不同电压下锂离子浓度分布图
Fig.4 Lithium concentration distribution map with different voltage
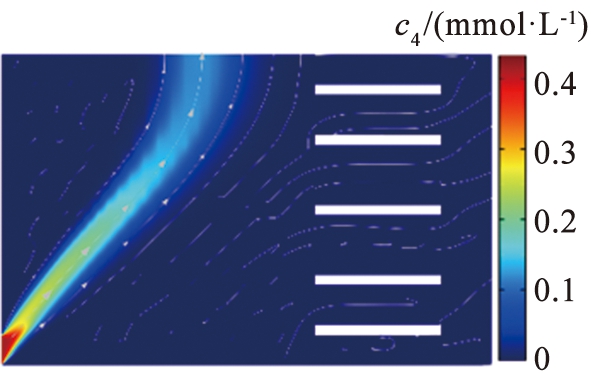
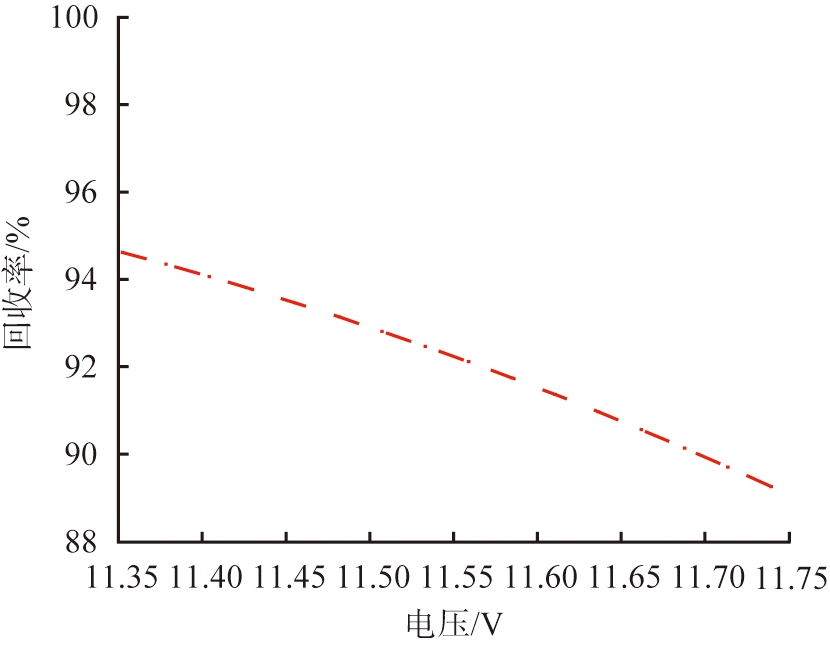
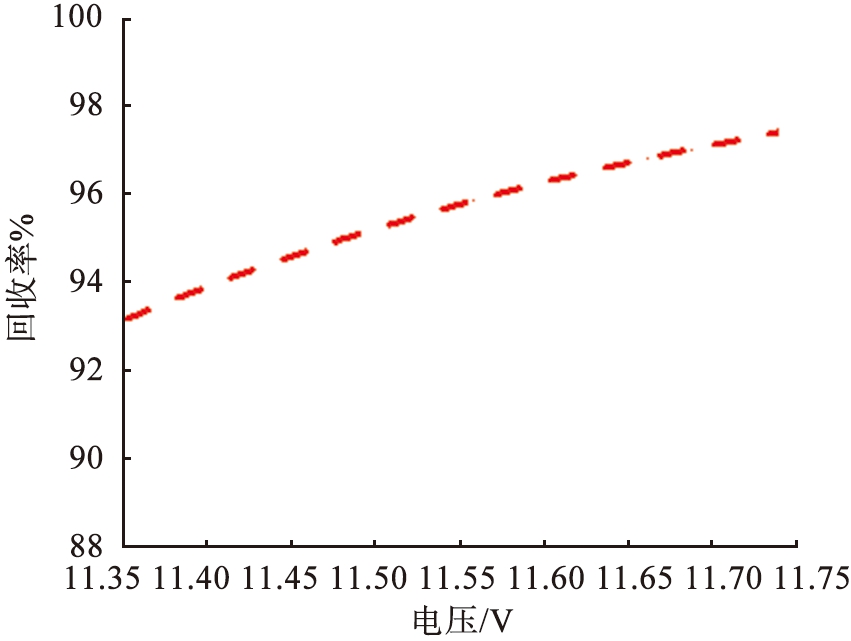
电压是影响镁、 锂分离的关键参数之一。 在参数影响的讨论中, 本文中采用控制变量法。 图4、 5所示为在流速为990 μm/s的条件下, 系统在不同电压下Li+和Mg2+的浓度分布。 结果显示, 在低电压下, 镁、 锂分离效果不明显。 过高或过低的电压导致离子扩散区域更宽, 无法实现镁、 锂分离。 图6所示为电压与离子回收率的关系。 根据图6中的计算结果可以得出,当u0=990 μm/s时,将V0从11.35 V增加至11.74 V,LLi从95%降低至89%,LMg从93%升高至97%,随着电压的增加,LLi逐渐减小,表明系统提取出来的Li+逐渐减少。当电压增加到11.5 V时,2种离子的回收率变化率都呈现减缓的趋势,在V0=11.5 V时,上端出口附近LLi约为6.2%,LMg约为95%。大部分Li+扩散至右端出口,大部分Mg2+在上端出口被排出,实现了Mg2+和Li+的有效分离,因此,为了保证系统的综合效果,本文中选取流速为990 μm/s、 电压为11.5 V这组参数作为镁、锂分离系统效果较好的结果值。
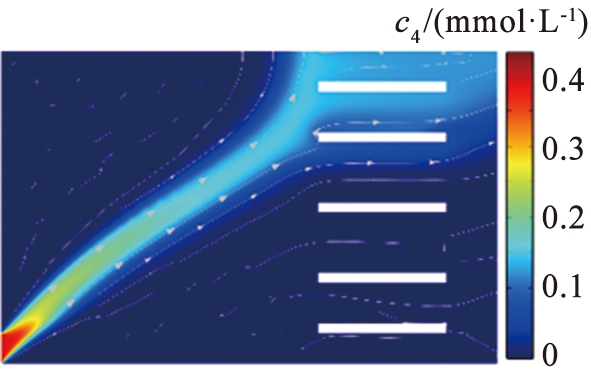
(a)V0=9.29 V
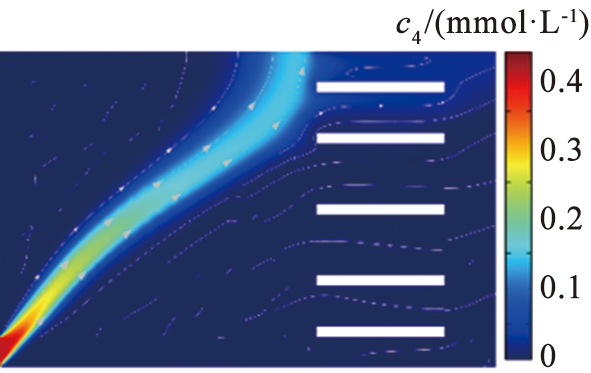
(b)V0=11.5 V
(c)V0=15.5 V
c4—镁离子浓度。
图5 不同电压下镁离子浓度分布图
Fig.5 Magnesium concentration distribution map with different voltage
2.3 水流速度对镁、 锂分离效应的影响
(a)锂离子
(b)镁离子
图6 电压与离子回收率的关系
Fig.6 Relationship between voltage and ion recovery rate
入口水流速度是影响系统性能的另一个重要参数。 图7、 8所示为在电压为15.5 V的条件下, 3组流速值条件下Li+和Mg2+ 的浓度分布情况。 结果显示, 在适当的水流速度下, 该系统能够实现良好的
(a)1 000 μm/s
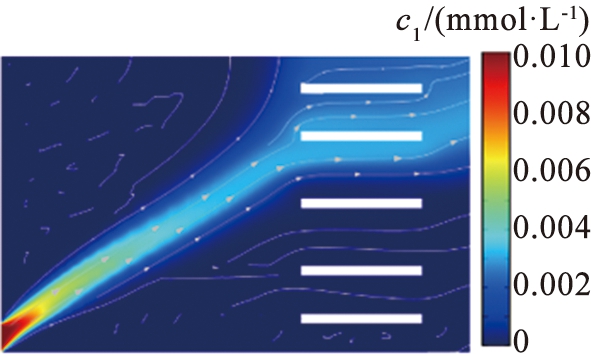
(b)1 350 μm/s
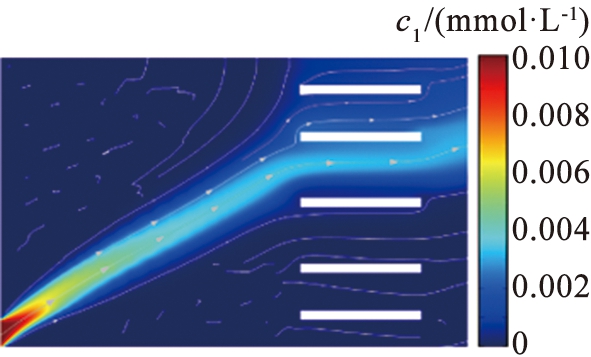
(c)1 500 μm/s
c1—锂离子浓度。
图7 不同入口流速下锂离子浓度分布图
Fig.7 Lithium concentration distribution map of different velocity
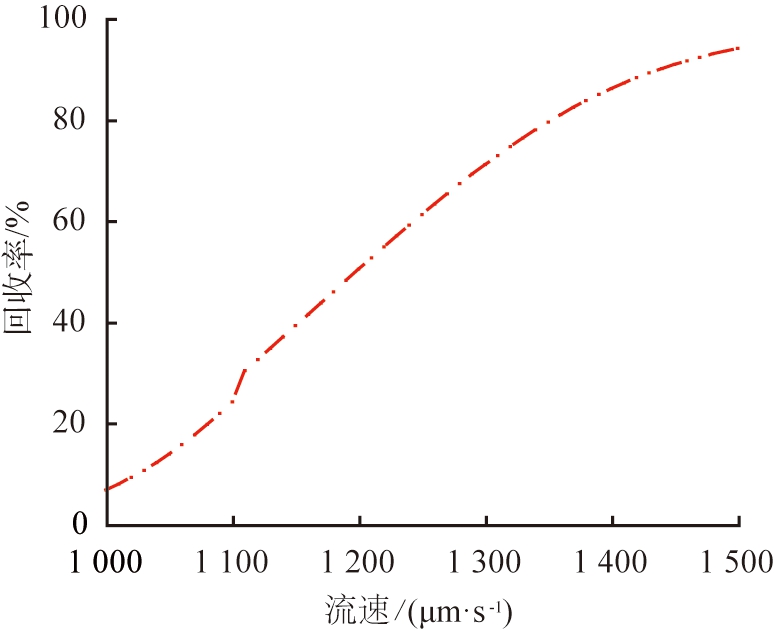
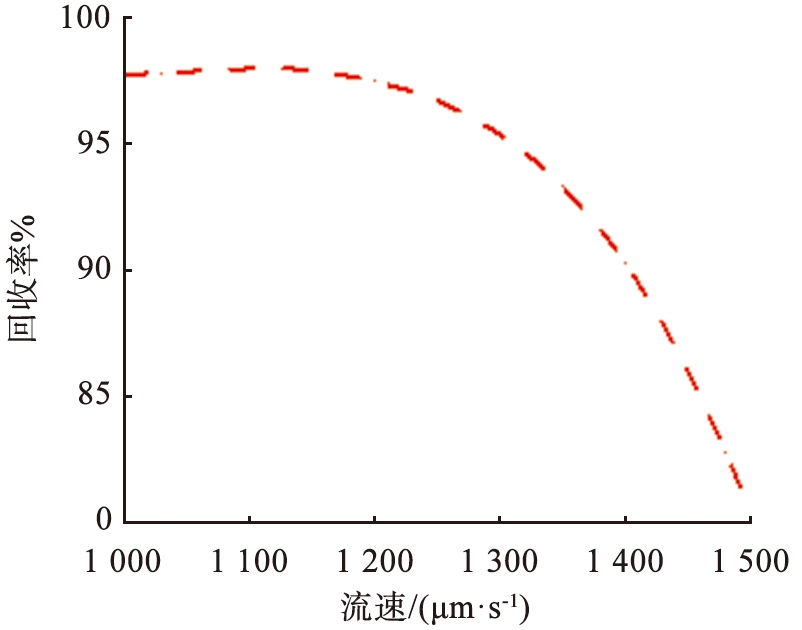
离子分离效果。 图9所示为流速与离子回收率的关系。 根据图9的结果可以看出, 当V0=15.5 V,u0=1 350 μm/s时, Li+在右端出口处回收率为80%,Mg2+在上端出口处回收率为93%,意味着在该参数条件下,大量的Mg2+被回收,同时大部分Li+能够在出口被收集。由于流场力不足以实现大量Li+在窄区域的平衡,当u0=1 000 μm/s时,Li+在右端出口处回收率仅为7%,且电场力将大量的Li+分布在靠近系统上端区域,继续将u0增加至1 500 μm/s,Li+回收率增加至94%,而Mg2+回收效果却下降,此时的Mg2+回收率为80%,因为在较高的水流速度下,过大的流场力被冲到其他区域,导致分离效果明显下降,而在过低的水流速度下,离子受到的流场力不足,因此,适当选择水流速度和外加电压是确保系统分离效率的关键。
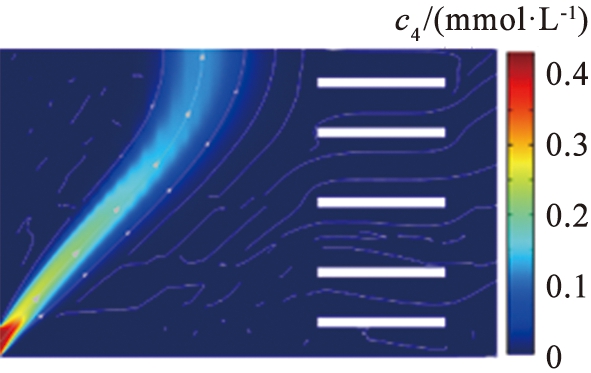
(a)1 000 μm/s
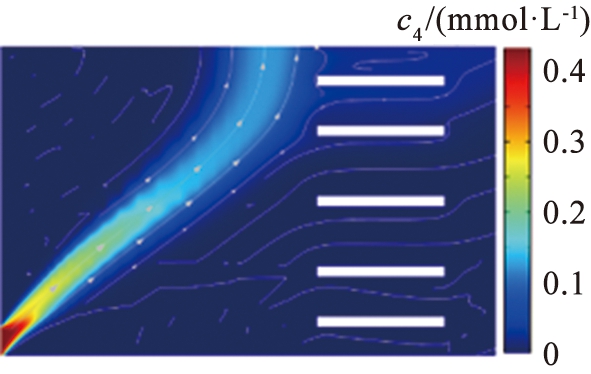
(b)1 350 μm/s
(c)1 500 μm/s
c4—镁离子浓度。
图8 不同入口流速下镁离子浓度分布图
Fig.8 Magnesium concentration distribution map of different velocity
(a)锂离子
(b)镁离子
图9 流速与离子回收率的关系
Fig.9 Relationship between velocity and ion recovery rate
2.4 障碍参数对镁、锂分离效应的影响
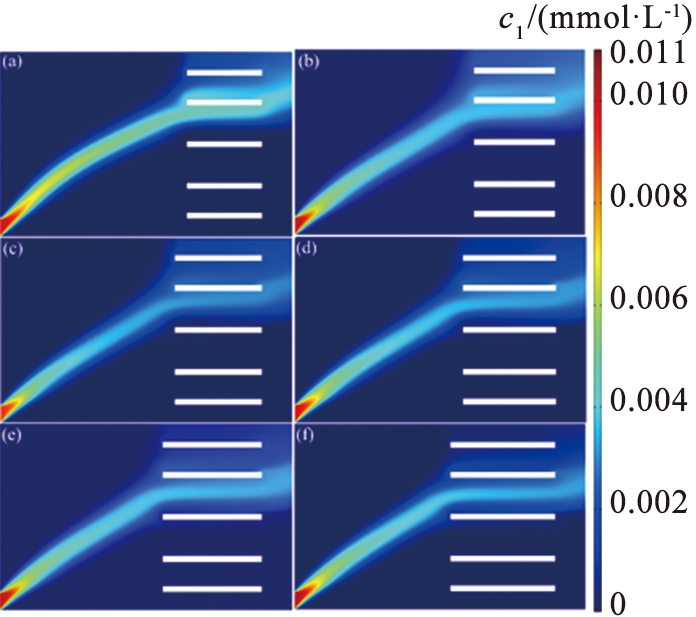
(a)锂离子
(b)镁离子
c1—锂离子浓度; c4—镁离子浓度。
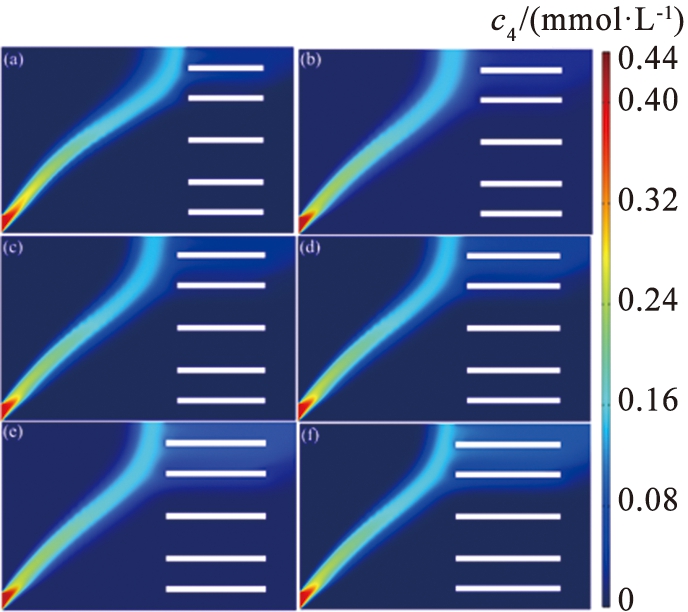
图10 不同障碍长度下的离子浓度图
Fig.10 Ion concentration diagram of different length of barrier
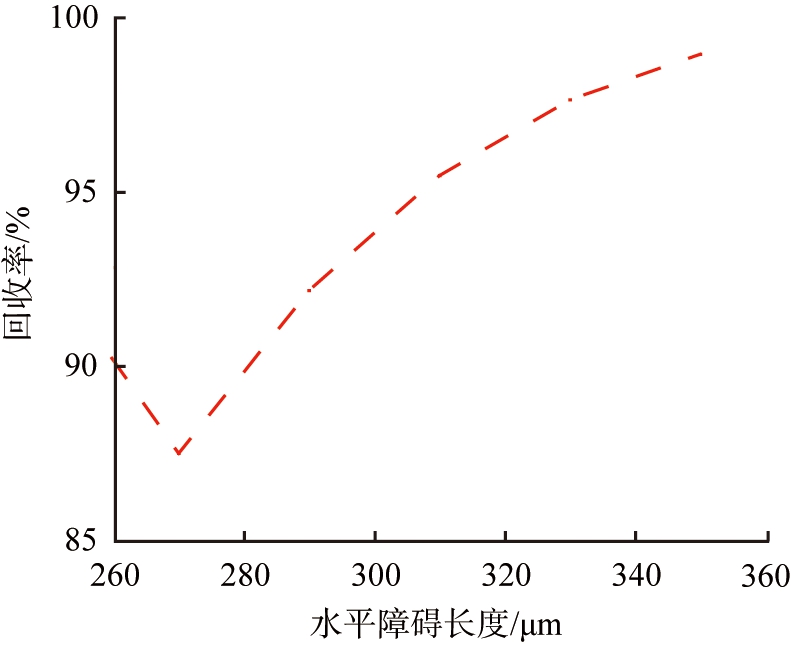
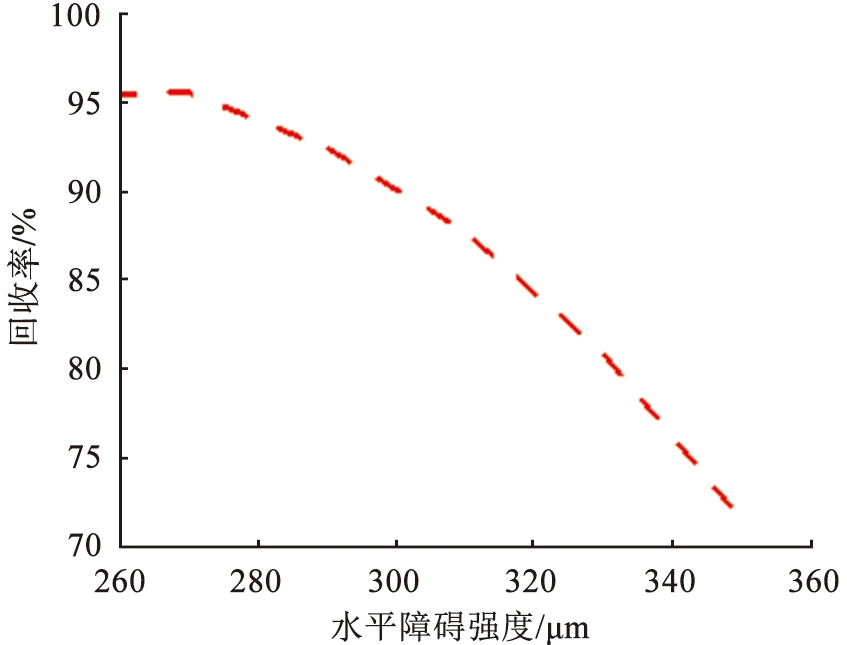
水平障碍的引入通过改变系统中的力场分布,将扩散宽度缩小,确保离子来流的路径与流速方向恰好重合,提高Li+的提取质量,使Li+具有更小的分离空间。选取一组参数: V0=11.5 V, u0=990 μm/s,并通过改变L2,研究该参数对系统分离效果的影响。图10所示为不同障碍长度下的离子浓度。由图可以看出, 随着障碍长度的增加, Li+的分离路径倾向于向模型下端移动, 而Mg2+倾向于靠近障碍区域。 图11中的数据表示, 离子回收率均超过70%, 当L2=270 μm时, LLi=87.53%, LMg=95.53%; 当L2=350 μm时, LLi=98.98%, LMg=71.65%。 其原因在于: 流体通过障碍发生局部流动阻力, 使得溶液在障碍前、 后的速度不同, 从而减小流速并增加涡流的形成, 较低的流速导致离子分离效率下降。 此外, 较长的障碍导致电场分布不均匀, 使离子迁移的方向和速率变得不稳定, 不利于分离效果。 相反, 较短的障碍减少了系统中的阻力, 导致流速增加, 流体流动更顺畅, 但可能会引起涡流或不均匀流动, 因此, 选择适当长度的障碍非常重要, 最佳长度应根据需实现的分离效率和目标镁、 锂浓度差异确定。
3 结论
(a)锂离子
(b)镁离子
图11 离子回收率随障碍长度的变化趋势
Fig.11 Changing trend of ion recovery rate with different length of barrier
本文中提出了一种电泳分离数值仿真系统, 通过调控力场分布实现镁、 锂分离。 该系统采用参数化结构设计, 并利用如H=az2的平方关系对障碍建模, 对参数进行优化, 以调整溶液中不同带电粒子的流场和电场分布。由于带电量和迁移率的差异,Mg2+和Li+受到不同的力场, 导致其迁移速度有所不同, 在系统中引入水平障碍, 窄化系统边界通道, 中间区域通道宽的设计可以使离子出口处流场更稳定, 离子分离区域更集中, 在窄区域实现Li+的显著力平衡, 导致离子扩散不受供水旋涡及溶液回流的影响, 水流方向接近于Li+分离轨迹, 保证Li+不受通道内部的影响, 具有更小的采样空间, 通过改变同样水流条件下离子呈直线的轨迹, 将Li+和Mg2+的迁移路径与水平方向呈现不同的夹角, 实现了不同离子的高效分离。
根据仿真结果,可以得出如下结论:在给定电压为11.5 V、流速为990 μm/s的参数设置下,该系统可以实现高达93%的Li+回收率,并将95%的Mg2+进行分离。当u0>1 440 μm/s时,Li+回收率可以超过90%,Mg2+的回收率在80%以上。这种方法有效克服了传统电泳系统中不同正电荷离子难以分离的问题,具有较高的选择性和较强的灵敏度,并有广泛的应用前景,为离子分离领域提供了新的思路和实践方法,推动该领域的发展。
同时,未来的研究可以进一步优化仿真结果,并致力于以下方面的探索:将仿真模拟过程中使用的稀释离子溶液适用于浓溶液,并考虑实际海水中的离子浓度。此外,加入离子提取或高浓度富集功能,实现离子的同时富集与分离;将该模型应用于工业领域,处理高MLR的盐湖卤水以及其他带电粒子的提取,为工业应用提供良好基础;进一步研究主要影响因素、性能优化和成本效益等方面,以提升系统整体性能;本研究为电泳系统在离子分离领域的应用提供了有益的参考,未来的工作应不断完善和改进相关方法和技术,以推动该系统在实际应用中的发展。
[1]TIAN L W, YU H, ZHANG W F, et al. The star material of lithium ion batteries,LiFePO4: basic properties, optimized modification and future prospects[J]. Materials Review, 2019, 33(11): 3561-3579.
[2]LI J B, MENG H J, PI Z J, et al. Application status and development trends of the lithium primary batteries[J]. Chinese Journal of Power Sources, 2018, 42(5): 725-727.
[3]王超君, 陈翔, 彭思侃, 等. 锂离子电池发展现状及其在航空领域的应用分析[J]. 航空材料学报, 2021, 41(3): 83-95.
WANG C J, CHEN X, PENG S K, et al. Development status of lithium-ion battery and its application in aviation[J]. Journal of Aerospace Materials, 2021, 41(3): 83-95.
[4]SONG M K, PARK S, ALAMGIR F M, et al. Nanostructured electrodes for lithium-ion and lithium-air batteries: the latest developments, challenges, and perspectives[J]. Materials Science &Engineering R-Reports, 2011, 72(11): 203-252.
[5]LI J, ZHU Q S, LI H Z. Development of typical lithium minerals roasting for high lithium extraction[J]. Scientia Sinica Chimica, 2017, 47(11): 1273-1283.
[6]OGAWA Y, KOIBUCHI H, SUTO K, et al. Effects of the chemical compositions of salars de uyuni and atacama brines on lithium concentration during evaporation[J]. Resource Geology, 2014, 64(2): 91-101.
[7]ZHAO Y, WU M Y, SHEN P X, et al. Composite anti-scaling membrane made of interpenetrating networks of nanofibers for selective separation of lithium[J]. Journal of Membrane Science, 2021, 618: 118668.
[8]辛娟, 李海朝, 张丽娟, 等. 高镁锂比盐湖卤水降镁研究[J]. 盐科学与化工, 2022, 51(2): 18-20.
XIN J, LI H C, ZHANG L J, et al. Study on magnesium reduction in brine with high magnesium-lithium ratio[J]. Salt Science and Chemistry, 2022, 51(2): 18-20.
[9]韦笑余. 高镁锂比盐湖卤水提锂新型萃取体系的开发及应用基础研究[D]. 北京:北京化工大学, 2021.
WEI X Y. Development and application of a novel extraction system for lithium extraction from brine with high magnesium-lithium ratio[D]. Beijing: Beijing University of Chemical Technology, 2021.
[10]王琪, 赵有璟, 刘洋, 等. 高镁锂比盐湖镁锂分离与锂提取技术研究进展[J]. 化工学报, 2021, 72(6): 2905-2921.
WANG Q, ZHAO Y J, LIU Y, et al. Research progress on Mg2+-Li+ separation and lithium extraction technology in high Mg2+-Li+ ratio salt lakes[J]. Journal of Chemical Engineering, 2021, 72(6): 2905-2921.
[11]张亮, 杨卉芃, 柳林, 等. 全球提锂技术进展[J]. 矿产保护与利用, 2020, 40(5): 24-31.
ZHANG L, YANG H F, LIU L, et al. Global advances in lithium extraction[J]. Mineral Conservation and Utilization, 2020, 40(5): 24-31.
[12]姚智俊. 结晶沉淀法处理化学镀镍废水的研究[J]. 科技传播, 2016, 8(8): 171-172.
YAO Z J. Research on the treatment of chemical nickel plating wastewater by crystallization precipitation[J]. Science and Technology Communication, 2016, 8(8): 171-172.
[13]HARVIANTO G R, KIM S H, JU C S. Solvent extraction and stripping of lithium ion from aqueous solution and its application to seawater[J]. Rare Metals, 2016, 35(12): 948-953.
[14]NAN J M, HAN D M, ZUO X X. Recovery of metal values from spent lithium-ion batteries with chemical deposition and solvent extraction[J]. Journal of Power Sources, 2005, 152: 278-284.
[15]SHI D, LI L J, SONG F G, et al. Mechanism study of extracting lithium from brine with N523-TBP mixed extraction system[J]. Journal of Salt Lake Research, 2017, 25(1): 57-63.
[16]SUN Y, WANG Y H, LIU Y, et al. Highly efficient lithium extraction from brine with a high sodium content by adsorption-coupled electrochemical technology[J]. ACS Sustainable Chemistry &Engineering, 2021, 9(33): 11022-11031.
[17]申明亮. 电解法与皮江法炼镁的效益比较及分析[J]. 有色冶金节能, 2009, 25(5): 6-9.
SHEN M L. Comparison and analysis of the benefits of magnesium refining by electrolysis and Pijiang method[J]. Energy Conservation in Non-ferrous Metallurgy, 2009, 25(5): 6-9.
[18]王勇. 离子膜电解法制取氢氧化锂工艺研发与应用[J]. 青海科技, 2020, 27(3): 43-47.
WANG Y. Development and application of lithium hydroxide production process by ionic membrane electrolysis[J]. Qinghai Science and Technology, 2020, 27(3): 43-47.
[19]NIE X Y, SUN S Y, SUN Z, et al. Ion-fractionation of lithium ions from magnesium ions by electrodialysis using monovalent selective ion-exchange membranes[J]. Desalination, 2017, 403: 128-135.
[20]SONG J F, ZHANG Y Y, LI X M, et al. Lithium separation by stable membrane extraction technology[J]. Membrane Science and Technology, 2012, 32(2): 107-108.
[21]SWAIN B. Separation and purification of lithium by solvent extraction and supported liquid membrane, analysis of their mechanism: a review[J]. Journal of Chemical Technology &Biotechnology, 2016, 91(10): 2549-2562.
[22]XU S S, SONG J F, BI Q Y, et al. Extraction of lithium from Chinese salt-lake brines by membranes: design and practice[J]. Journal of Membrane Science, 2021, 635: 119441.
[23]LI R, LIU F. Extracting lithium from salt lake brine via adsorption method[J]. Modern Chemical Industry, 2017, 37(8): 132-134.
[24]XIAO G P, TONG K F, ZHOU L S, et al. Adsorption and desorption behavior of lithium ion in spherical PVC-MnO2 ion sieve[J]. Industrial &Engineering Chemistry Research, 2012, 51(33): 10921-10929.
[25]LI Y, ZHAO Y J, WANG H Y, et al. The application of nanofiltration membrane for recovering lithium from salt lake brine[J]. Desalination, 2019, 468: 114081.
[26]YANG G, SHI H, LIU W Q, et al. Investigation of Mg2+/Li+ separation by nanofiltration[J]. Chinese Journal of Chemical Engineering, 2011, 19(4): 586-591.
[27]LI X W, CHAO Y H, CHEN L L, et al. Taming wettability of lithium ion sieve via different TiO2 precursors for effective Li+ recovery from aqueous lithium resources[J]. Chemical Engineering Journal, 2020, 392: 123731.
[28]CHUNG W J, TORREJOS R E C, PARK M J, et al. Continuous lithium mining from aqueous resources by an adsorbent filter with a 3D polymeric nanofiber network infused with ion sieves[J]. Chemical Engineering Journal, 2017, 309: 49-62.
[29]LAWAGON C P, NISOLA G M, MUN J, et al. Adsorptive Li+ mining from liquid resources by H2TiO3: equilibrium, kinetics, thermodynamics, and mechanisms[J]. Journal of Industrial and Engineering Chemistry, 2016, 35: 347-356.
[30]LIMJUCO L A, NISOLA G M, LAWAGON C P, et al. H2TiO3 composite adsorbent foam for efficient and continuous recovery of Li+ from liquid resources[J]. Colloids and Surfaces A: Physicochemical and Engineering Aspects, 2016, 504: 267-279.
[31]NISOLA G M, LIMJUCO L A, VIVAS E L, et al. Macroporous flexible polyvinyl alcohol lithium adsorbent foam composite prepared via surfactant blending and cryo-desiccation[J]. Chemical Engineering Journal, 2015, 280: 536-548.
[32]ZHAO X Y, FENG M H, JIAO Y X, et al. Lithium extraction from brine in an ionic selective desalination battery[J]. Desalination, 2020, 481:114360.
[33]HWANG C W, JEONG M H, KIM Y J, et al. Process design for lithium recovery using bipolar membrane electrodialysis system[J]. Separation and Purification Technology, 2016, 166: 34-40.
[34]SOMRANI A, HAMZAOUI A H, PONTIE M. Study on lithium separation from salt lake brines by nanofiltration (NF) and low pressure reverse osmosis (LPRO)[J]. Desalination, 2013, 317: 184-192.
[35]ZANGLE T A, MANI A, SANTIAGO J G. On the propagation of concentration polarization from microchannel-nanochannel interfaces. Part II: numerical and experimental study[J]. Langmuir, 2009, 25(6): 3909-3916.
[36]DAVIES C D, CROOKS R M. Focusing, sorting, and separating microplastics by serial faradaic ion concentration polarization[J]. Chemical Science, 2020, 11(21): 5547-5558.
[37]BERZINA B, ANAND R K. Tutorial review: enrichment and separation of neutral and charged species by ion concentration polarization focusing[J]. Analtica Chimica Acta, 2020, 1128: 149-173.
[38]LI M, ANAND R K. Recent advancements in ion concentration polarization[J]. Analyst, 2016, 141(12): 3496-3510.
[39]WANG Y C, STEVENS A L, HAN J Y. Million-fold preconcentration of proteins and peptides by nanofluidic filter[J]. Analytical Chemistry, 2005, 77(14): 4293-4299.
[40]GONG L Y, OUYANG W, LI Z R, et al. Direct numerical simulation of continuous lithium extraction from high Mg2+/Li+ ratio brines using microfluidic channels with ion concentration polarization[J]. Journal of Membrane Science, 2018, 556: 34-41.
[41]GONG L Y, LI Z R, HAN OYO. Numerical simulation of continuous extraction of highly concentrated Li+ from high Mg2+/Li+ ratio brines in an ion concentration polarization-based microfluidic system[J]. Separation and Purification Technology, 2019, 217: 174-182.
[42]TANG J, GONG L Y, JIANG J F, et al. Numerical simulation of electrokinetic desalination using microporous permselective membranes[J]. Desalination, 2020, 477: 114262.
[43]KIM B, KWAK R, KWON H J, et al. Corrigendum: purification of high salinity brine by multi-stage ion concentration polarization desalination[J]. Scientific Reports, 2018, 8: 46918.
[44]PAPADIMITRIOU V A, KRUIT S A, SEGERINK L I, et al. Droplet encapsulation of electrokinetically-focused analytes without loss of resolution[J]. Lab on a Chip, 2020, 20(12): 2209-2217.
[45]KIM S J, KO S H, KANG K H, et al. Direct seawater desalination by ion concentration polarization[J]. Nature Nanotechnology, 2013, 8(8): 609.
[46]KIM S J, LI L D, HAN J. Amplified electrokinetic response by concentration polarization near nanofluidic channel[J]. Langmuir, 2009, 25(13): 7759-7765.
[47]MANI A, ZANGLE T A, SANTIAGO J G. On the propagation of concentration polarization from microchannel-nanochannel interfaces. Part I: analytical model and characteristic analysis[J]. Langmuir, 2009, 25(6): 3898-3908.
[48]WONG C L, SORIANO A N, LI M H. Infinite dilution diffusion coefficients of [Bmim]-based ionic liquids in water and its molar conductivities[J]. Journal of the Taiwan Institute of Chemical Engineers, 2009, 40(1): 77-83.
[49]DRUZGALSKI C L, ANDERSEN M B, MANI A. Direct numerical simulation of electroconvective instability and hydrodynamic chaos near an ion-selective surface[J]. Physics of Fluids, 2013, 25(11): 110804.
[50]RUBINSTEIN I, ZALTZMAN B. Electro-osmotically induced convection at a permselective membrane[J]. Physical Review E, 2000, 62(2): 2238-2251.