近年来,随着环境污染问题的加剧,挥发性有机化合物(volatile organic compounds, VOCs)已成为主要的大气污染物之一。VOCs主要包含苯系物、醇类、醛类、卤代烃等,这些物质大多有毒有害,损害人体健康。此外,VOCs还会导致温室效应,形成光化学烟雾,对生态安全造成严重破坏[1]。甲苯作为一种典型的VOCs污染物,主要来源于机动车尾气、石化和制药工业排放等,因此,有必要开发一种高效稳定的方法以净化甲苯[2]。目前,可用于净化甲苯的方法主要有吸附[3-4]、 膜分离[5]、 生物降解[6]、 光催化氧化[7-8]、 催化燃烧法[9-11]。其中,催化燃烧法操作温度较低、 副产物较少且净化效率更高,是一种高效的净化甲苯方法[12]。催化剂是催化燃烧法的核心,催化燃烧法采用的催化剂主要分为负载型贵金属[9,13-14]和过渡金属氧化物[2,10]。与过渡金属氧化物相比,贵金属具有更优异的低温催化燃烧活性,但较差的热稳定性、较高的成本和易中毒等缺点限制了贵金属实际应用,因此,过渡金属氧化物受到科研工作者的广泛关注[15]。
铈锰固溶体作为一种复合金属氧化物, 具有较丰富的氧空位和较强的Ce-Mn间协同作用, 因此, 诸多研究[16-18]通过不同的制备方法合成了不同的铈锰固溶体催化剂, 并用于VOCs催化燃烧领域, 其中水热法、 热分解法和共沉淀法以其合成方法简单且稳定性高等优点备受关注。 Wan等[16]采用水热法合成了一种具有纳米棒状结构的CeO2-MnOx催化剂, 结果表明, CeO2-MnOx催化剂具有较丰富的氧空位和较高的晶格氧迁移率, 在氯苯催化燃烧反应中表现出优异的活性。 Zhang等[17]通过热分解法合成了棒状 Mn3Ce2Ox催化剂, 在高湿度条件下的甲苯催化燃烧反应中表现出优异的催化活性和稳定性。 Gino等[18]采用共沉淀法制备了Ce-Mn复合氧化物催化剂并将其用于正己烷催化燃烧反应, Ce、 Mn间强烈的金属相互作用有利于Ce-Mn复合氧化物催化剂低温可还原性的提高, 使其获得更好的催化正己烷燃烧活性, 故此, 将铈锰固溶体用于甲苯催化燃烧反应引起广泛关注。 Li等[19]研究了制备方法对La2CoMnO6-CeO2催化剂的甲烷催化燃烧活性的影响, 结果表明, 沉淀法制备的催化剂性能要优于溶胶-凝胶法和浸渍法制备的,这是由于沉淀法可以促进CeO2的高度分散,从而加速了氧的循环。Wang等[20]通过不同方法制备了用于氯乙烯催化燃烧的LaMnO3催化剂,其中溶胶-凝胶法所制备的LaMnO3具有更丰富的Mn4+和表面氧空位,分别有利于氯乙烯和分子氧在催化剂上的吸附和活化,从而表现出优异的催化燃烧性能。为了探寻一种较为优异的铈锰固溶体催化剂合成方法,开发一种用于甲苯催化燃烧反应的高效催化剂,本研究中通过水热法、热分解法和共沉淀法制备了一系列铈锰固溶体催化剂,并测试其对甲苯的催化燃烧性能,以选出较好的铈锰固溶体催化剂制备方法;再通过各种表征手段进一步分析催化剂的表面元素组成、氧空位、氧化还原性能等物理化学性质,系统性地探究制备方法对铈锰固溶体的甲苯催化燃烧活性的影响。
1 实验
1.1 试剂
硝酸铈(Ce(NO3)2·6H2O, 纯度为99.5%(质量分数, 下同), 上海阿拉丁生化科技有限公司); 氯化锰(MnCl2·4H2O, 纯度为99.0%, 国药集团化学试剂有限公司); 氢氧化钠(NaOH)、 氨水(NH3·H2O)、 无水乙醇(C2H5OH)、 甲苯(C7H8)(均为分析纯, 广州化学试剂厂); 石英砂(SiO2, 纯度为99.5%, 上海津远石英砂有限公司); 去离子水(H2O, 实验室自制)。
1.2 催化剂的制备
水热法制备Ce0.7Mn0.3O2。分别将1.83 g的Ce(NO3)3·6H2O和0.36 g的MnCl2·4H2O固体粉末溶于30 mL去离子水中,得到Ce3+和Mn2+共存的混合溶液。然后,向以上溶液中滴加浓度为6 mol/L的NaOH溶液,直到溶液的pH 达到11,并在室温下继续搅拌3 h。将搅拌后的溶液转移至水热反应釜中,并将其置于110 ℃的烘箱中保持24 h。待反应结束后,将釜底产物进行离心、洗涤、干燥后得到前驱体粉末。最后,对前驱体进行煅烧后获得最终产物,煅烧条件为550 ℃下恒温3 h。将所得产物记为S-Ce0.7Mn0.3O2。
热分解法制备Ce0.7Mn0.3O2。将Ce3+和Mn2+共存的混合溶液(参照水热法中的配制方法)充分搅拌均匀,然后将该溶液置于60 ℃的烘箱中干燥,待水溶液蒸干后可得到前驱体粉末。最后对前驱体进行煅烧,煅烧条件同上,得到最终产物,记为R-Ce0.7Mn0.3O2。
共沉淀法制备Ce0.7Mn0.3O2。配制Ce3+和Mn2+共存的混合溶液(参照水热法中的配制方法),并搅拌均匀。然后,向该溶液中缓慢滴加质量分数为25%的氨水,直至溶液的pH=11,继续搅拌3 h。将所得的混合溶液静置24 h,进一步通过抽滤、干燥可得到前驱体粉末。最后对前驱体进行煅烧,煅烧条件同上,得到最终产物,记为G-Ce0.7Mn0.3O2。
1.3 催化剂的表征
采用X射线衍射仪(XRD,荷兰马尔文帕纳科公司)对样品进行物相分析,以Cu靶为辐射源,管电流和管电压分别为15 mA和40 kV;采用场发射扫描电子显微镜(FESEM,日本日立公司)和场发射透射电子显微镜(FETEM,美国FEI公司)观察样品的形貌和微观结构;利用比表面积及孔径分析仪(美国康塔公司)测试样品的比表面积和平均孔径;利用化学吸附仪(美国麦克公司)对样品进行氢气程序升温还原测试(H2-TPR),测试方法:将30 mg的样品在He气中预处理1 h,预处理温度为300 ℃,待降至室温后,将He气更换为体积流量为50 mL/min、氢气的体积分数为5%的氢-氩混合气,测试温度为40~900 ℃,升温速率为10 ℃/min;采用X射线光电子能谱仪(XPS,美国赛默飞世尔科技公司)分析样品的表面元素组成、价态和相对含量,测试条件:电流和电压分别为10 mA和15 kV,以Al靶为辐射源,束斑为500 μm,以C 1s(284.8 eV)为基准对各元素谱线的结合能进行荷电校正;采用原位傅里叶变换红外光谱仪(In-situ FTIR,美国赛默飞世尔科技公司)实时检测甲苯氧化反应过程中吸附在催化剂表面的各种中间产物,测试条件:先将样品在250 ℃的氮气氛中预处理1 h,待降温至100 ℃以下,通入体积分数为1‰的甲苯-氮气混合气后开始升温检测。
1.4 催化燃烧甲苯的活性评价
催化燃烧甲苯反应的活性评价在固定床微型反应器中进行,石英管的内径为8 mm。称取100 mg的样品颗粒与等质量的石英砂,均匀混合后置于石英管中部,样品颗粒与石英砂的粒径均为250~425 μm。在催化反应进行之前,先将样品颗粒在250 ℃的空气气氛下预处理1 h。待降温至80 ℃以下,通入甲苯体积分数为1‰的甲苯-空气混合气,质量空速为30 L/(g·h)。催化反应在常压下进行,并采取分段升温逐点进行测试。采用气相色谱仪(美国安捷伦公司)检测反应前后甲苯的体积分数,甲苯转化率
(1)
式中: φi和φo分别为进口和出口处的甲苯体积分数。
2 催化剂的表征
2.1 催化剂的形貌与组织结构
图1为水热法制备的CeO2与不同方法制备的3种Ce0.7Mn0.3O2样品的XRD图谱。 从图1(a)可以看出, 3种Ce0.7Mn0.3O2样品的XRD衍射峰均与萤石结构的CeO2(JCPDS No.810792)相匹配, 未发现任何锰氧化物(如MnO2、 Mn2O3、 Mn3O4等)的衍射峰。 与水热法制备的纯相CeO2相比(图1(b)), 3种Ce0.7Mn0.3O2样品的(111)衍射峰均向更高的Bragg角方向偏移,说明Mn离子进入了CeO2晶格, 形成了铈锰固溶体。 由于Ce3+(1.03 nm)、 Ce4+(0.8 nm)的离子半径均大于Mn2+(0.67 nm)、 Mn3+(0.58 nm)、Mn4+(0.54 nm)的, 因此, Mn离子进入CeO2晶格中会减小CeO2的晶格常数, 从而导致Ce0.7Mn0.3O2样品的衍射峰向更高的Bragg角方向移动[21-22]。
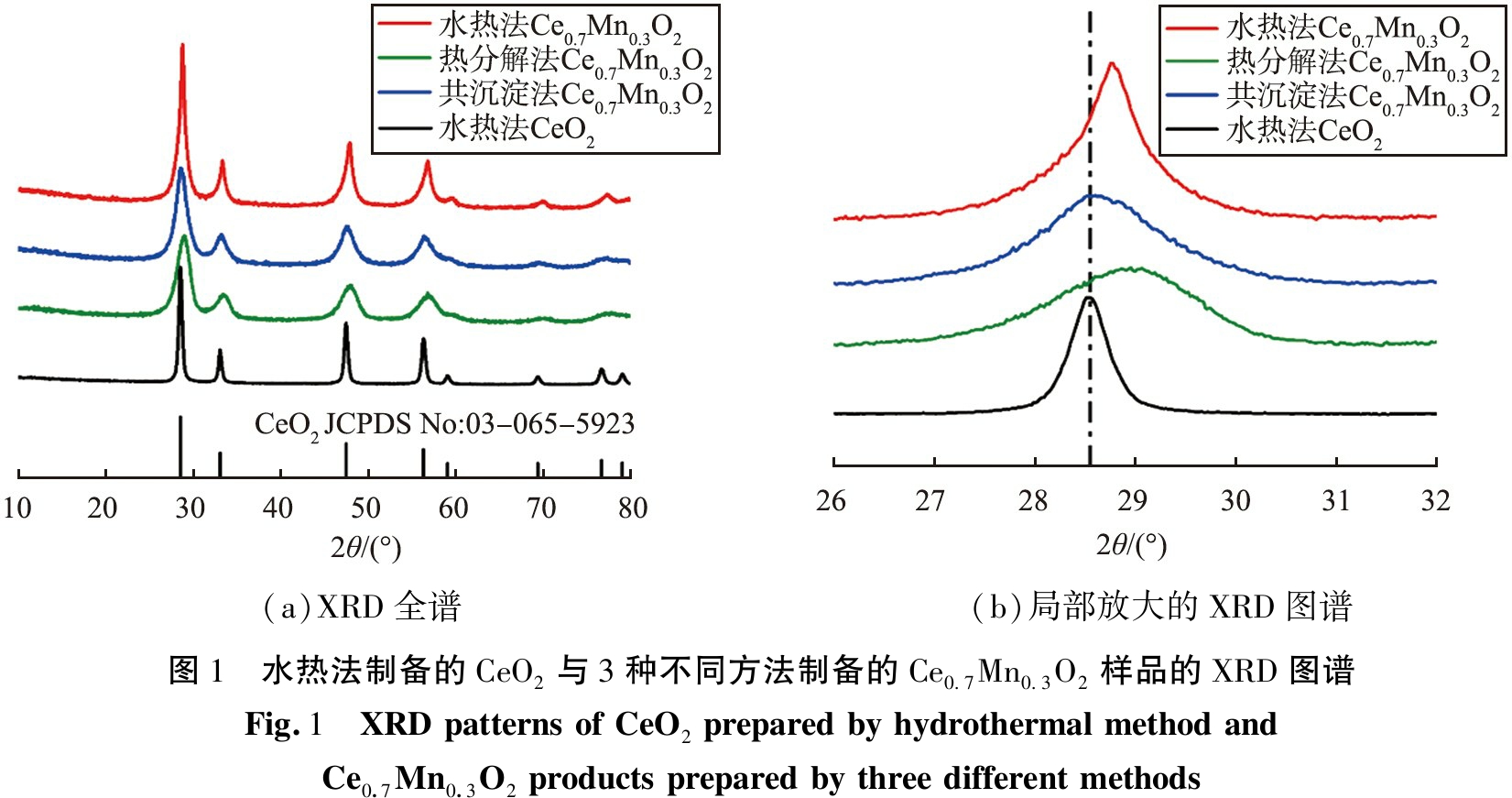
(a)XRD全谱(b)局部放大的XRD图谱图1 水热法制备的CeO2与3种不同方法制备的Ce0.7Mn0.3O2样品的XRD图谱Fig.1 XRD patterns of CeO2 prepared by hydrothermal method and Ce0.7Mn0.3O2 products prepared by three different methods
通过FESEM和HR-FETEM对Ce0.7Mn0.3O2样品的微观形貌和结构进行分析, 图2为3种样品的FESEM图像。 由图可以看出, 通过3种不同方法制备的Ce0.7Mn0.3O2样品具有相似的纳米颗粒形貌, 均由粒径为10 nm左右的纳米颗粒团聚形成。 3种样品的HR-FESEM图像如图3所示。
从图3(a)可以观察到, S-Ce0.7Mn0.3O2样品具有清晰的晶格条纹,其晶面间距分别为0.310、 0.271、 0.163 nm,分别与CeO2的(111)、 (200)、 (311)晶面相对应。 从图3(b)、 3(c)也可以观察到归属于CeO2的(111)和(200)晶面的晶格条纹, 然而, 在3种样品均中未观察到归属于锰氧化物的晶格条纹。 结合XRD分析结果可知, 3种Ce0.7Mn0.3O2样品中的Mn离子并非以锰氧化物的形式高度分散于萤石结构CeO2表面, 而是成功取代了CeO2中的Ce离子形成铈锰固溶体。 此外, 还利用能谱仪分析了3种Ce0.7Mn0.3O2样品的元素分布, 如图4所示。 由图可以看到, 各样品的Ce、 Mn、 O信号均匀分布, 表明Mn元素在CeO2上高度分散。

(a)水热法(b)热分解法(c)共沉淀法图2 3种不同方法制备的Ce0.7Mn0.3O2样品的FESEM图像Fig.2 FESEM images of Ce0.7Mn0.3O2 products prepared by three different methods
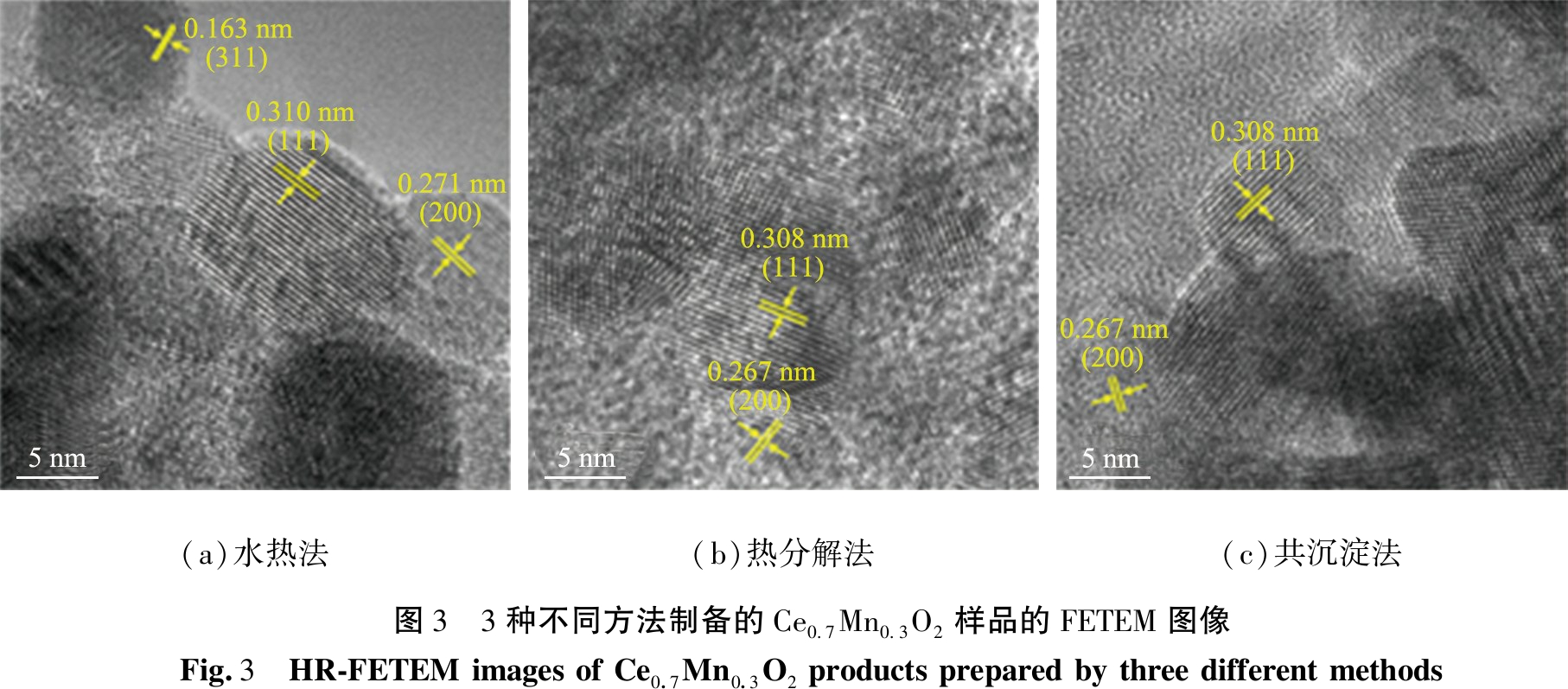
(a)水热法(b)热分解法(c)共沉淀法图3 3种不同方法制备的Ce0.7Mn0.3O2样品的FETEM图像Fig.3 HR-FETEM images of Ce0.7Mn0.3O2 products prepared by three different methods

(a)水热法(b)热分解法(c)共沉淀法图4 3种不同方法制备的Ce0.7Mn0.3O2样品的元素分布图Fig.4 Element distribution images of Ce0.7Mn0.3O2 products prepared by three different methods
对Ce0.7Mn0.3O2样品进行氮气物理吸附-脱附测试,并分析其比表面积和孔径分布,如图5所示。从图5(a)可以看出,3种Ce0.7Mn0.3O2样品均呈现Ⅳ型等温吸附-脱附曲线,表明3种Ce0.7Mn0.3O2样品都存在介孔结构。此外,3种Ce0.7Mn0.3O2样品的回滞环均属于H3型,表明3种样品均为纳米颗粒的非刚性聚集体,与FESEM观察到的结果相对应[23]。通过氮气物理-吸脱附测试计算出Ce0.7Mn0.3O2样品的结构参数,如表1所示。由表可以看到,3种 Ce0.7Mn0.3O2样品的比表面积由大到小依次为S-Ce0.7Mn0.3O2(93.87 m2/g)、 G-Ce0.7Mn0.3O2(91.20 m2/g)、 R-Ce0.7Mn0.3O2(64.19 m2/g)。据相关文献[2, 24-25]报道,更大的比表面积往往有利于催化剂反应活性位点的暴露,促进反应物分子在催化剂表面更好地吸附、扩散和活化。由于S-Ce0.7Mn0.3O2具有更大的比表面积,因此,S-Ce0.7Mn0.3O2可能在多相催化氧化反应中展现出更优异的催化活性。
2.2 催化剂的活性评价
对3种催化剂进行甲苯催化燃烧活性测试, 图6(a)为不同温度下3种催化剂的甲苯转化率, 图6(b)为3种催化剂在甲苯转化率为20%时的Arrhenius曲线, 表2为3种催化剂的t10、 t90(甲苯转化率分别为10%、 90%的反应温度)和通过Arrhenius曲线计算出的表观活化能Ea。 由图6(a)可以看出, 随着反应温度的升高, 3种催化剂的甲苯转化率均不断提高。 通过比较t10和t90可知(见表2), S-Ce0.7Mn0.3O2具有更低的t10(175 ℃)和t90(218 ℃),因此,S-Ce0.7Mn0.3O2具有更优异的甲苯催化燃烧活性; R-Ce0.7Mn0.3O2的催化活性低于S-Ce0.7Mn0.3O2,其t10、 t90分别为208、 246 ℃;G-Ce0.7Mn0.3O2的催化性能最差, 其t10、 t90分别为220、 269 ℃。 Ea也可以用于比较催化剂的催化能力, Ea越低催化剂越容易将甲苯氧化分解。 由表2可以看出, S-Ce0.7Mn0.3O2的表观活化能仅为37.98 kJ·mol-1, 显著低于R-Ce0.7Mn0.3O2 (73.69 kJ·mol-1)和G-Ce0.7Mn0.3O2(76.25 kJ·mol-1)的, 表明通过水热法制备的S-Ce0.7Mn0.3O2催化剂催化活性最好, 这与催化活性测试结果相吻合。 以上结果表明, 水热法制备的Ce0.7Mn0.3O2具有最佳的甲苯催化燃烧活性。 此外, 虽然G-Ce0.7Mn0.3O2具有较大的比表面积, 但是其催化甲苯燃烧活性是最差的, 说明比表面积不是影响铈锰固溶体甲苯催化燃烧活性的主要因素。
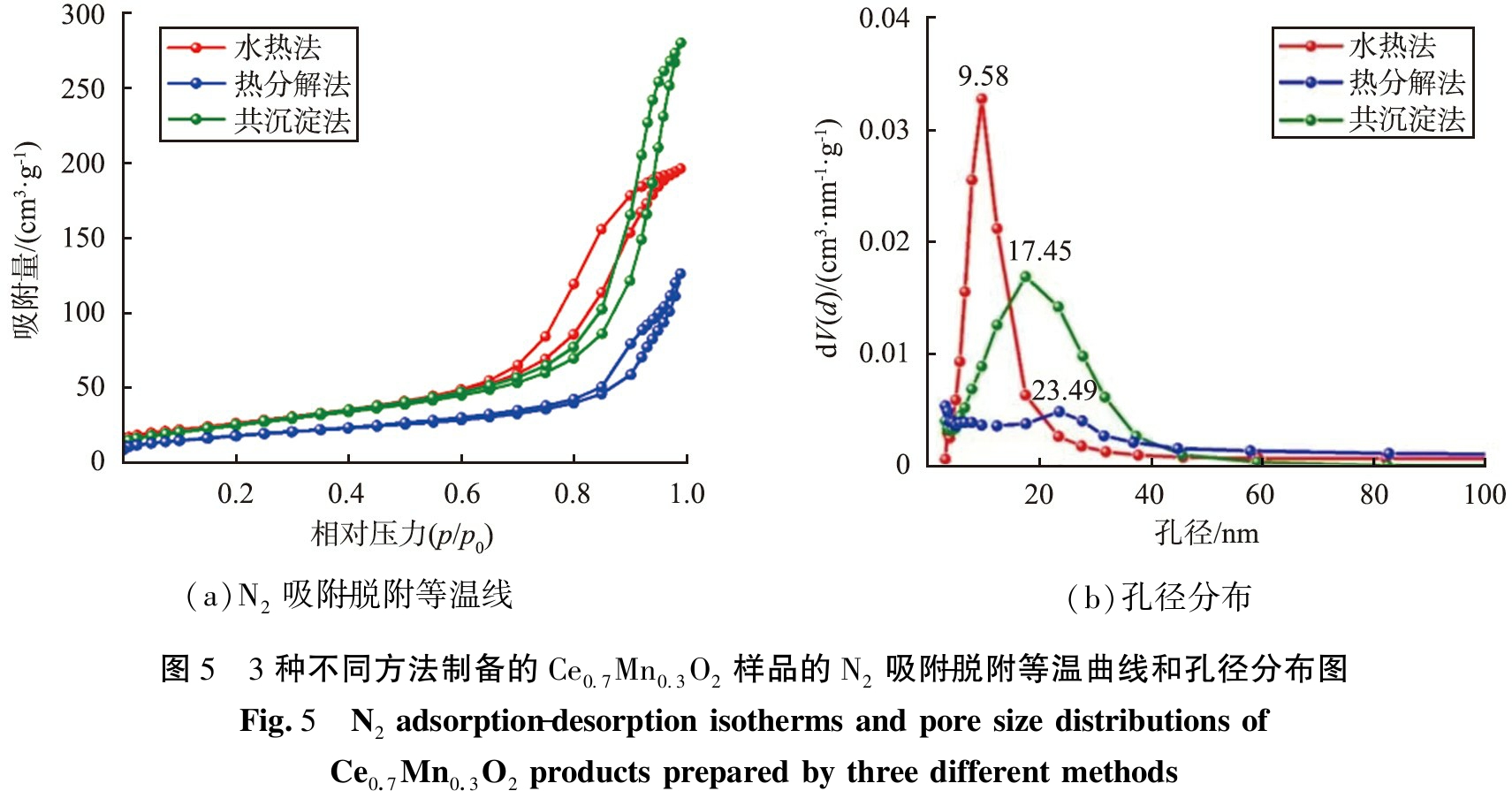
(a)N2吸附-脱附等温线(b)孔径分布图5 3种不同方法制备的Ce0.7Mn0.3O2样品的N2吸附-脱附等温曲线和孔径分布图Fig.5 N2 adsorption-desorption isotherms and pore size distributions of Ce0.7Mn0.3O2 products prepared by three different methods
表1 3种不同方法制备的Ce0.7Mn0.3O2样品的结构参数
Tab.1 Structural parameters of Ce0.7Mn0.3O2 products prepared by three different methods

制备方法比表面积/(m2·g-1)孔径/nm水热法93.879.58热分解法64.1923.49共沉淀法91.2017.45
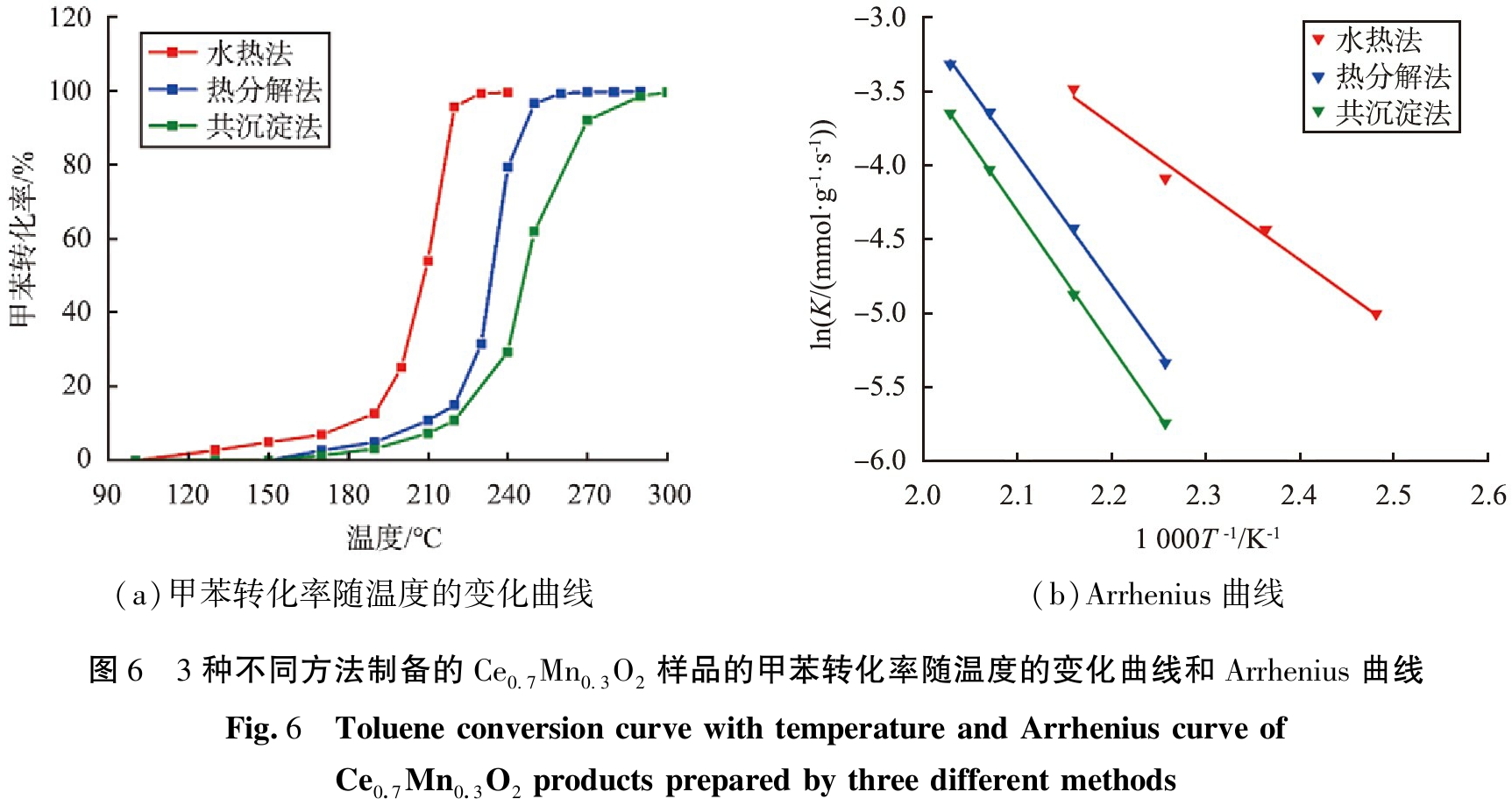
(a)甲苯转化率随温度的变化曲线(b)Arrhenius曲线图6 3种不同方法制备的Ce0.7Mn0.3O2样品的甲苯转化率随温度的变化曲线和Arrhenius曲线Fig.6 Toluene conversion curve with temperature and Arrhenius curve of Ce0.7Mn0.3O2 products prepared by three different methods
表2 3种不同方法制备的Ce0.7Mn0.3O2样品的反应温度及表观活化能
Tab.2 Reaction temperature and apparent activation energy of Ce0.7Mn0.3O2 products prepared by three different methods
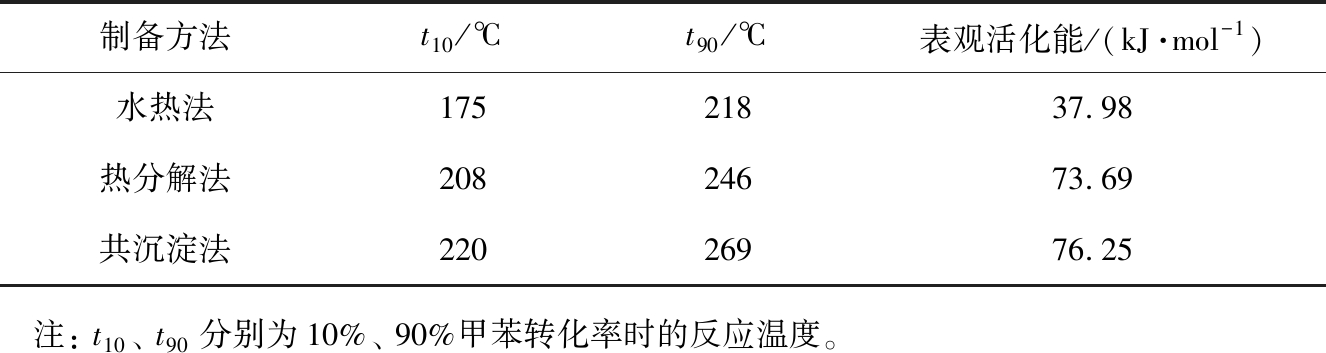
制备方法t10/℃t90/℃表观活化能/(kJ·mol-1)水热法17521837.98热分解法20824673.69共沉淀法22026976.25 注: t10、 t90分别为10%、 90%甲苯转化率时的反应温度。
对S-Ce0.7Mn0.3O2催化剂进行50 h的催化燃烧甲苯稳定性测试, 0~50 h的甲苯转化率的变化曲线如图7所示。由图可知,在220 ℃的反应温度下,S-Ce0.7Mn0.3O2催化剂在经过50 h的甲苯催化燃烧反应测试后,甲苯转化率仍可以保持在90 %左右,并未出现明显的失活现象,表明S-Ce0.7Mn0.3O2催化剂在甲苯催化燃烧反应中具有良好的催化稳定性。
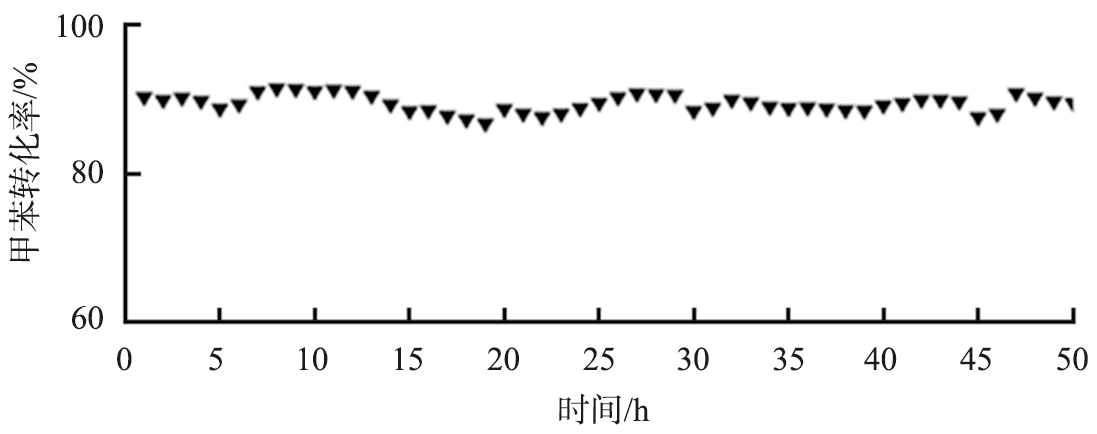
图7 反应时间对S-Ce0.7Mn0.3O2催化剂甲苯转化率的影响
Fig.7 Effect of reaction time on toluene conversion of S-Ce0.7Mn0.3O2 catalyst
2.3 催化剂的表面化学性质
图8为3种Ce0.7Mn0.3O2催化剂的Ce、 Mn和O元素的XPS能谱图。对催化剂表面元素的化学状态进行分析后,进一步对不同元素不同价态的能谱进行积分后计算相对含量,表3为Ce0.7Mn0.3O2催化剂的表面元素组成。由表可知,3种Ce0.7Mn0.3O2催化剂表面Mn与Ce元素物质的量的比由高到低依次为S-Ce0.7Mn0.3O2(0.298)、 R-Ce0.7Mn0.3O2(0.265)、 G-Ce0.7Mn0.3O2(0.201),此结果与3种催化剂的催化燃烧甲苯活性顺序一致。相关研究[26-28]表明,含锰双金属氧化物表面Mn含量的提高能够有效提升其催化燃烧VOCs性能,因此,3种Ce0.7Mn0.3O2催化剂具有不同的表面Mn含量,可能是其催化燃烧甲苯活性产生差异的原因。图8(a)为3种Ce0.7Mn0.3O2催化剂Ce 3d轨道的XPS能谱图,由图可以看出,3种Ce0.7Mn0.3O2催化剂表面的铈元素分别以Ce3+、 Ce4+这2种价态离子形式存在[29-30],而由表3可以看出,3种Ce0.7Mn0.3O2催化剂表面的Ce3+相对含量非常相近,表明制备方法对合成的铈锰固溶体中铈的价态无明显影响。
图8(b)为3种Ce0.7Mn0.3O2催化剂Mn 2p3/2轨道的XPS能谱图。 由图可以看出, Mn 2p3/2能谱分为结合能分别在644.8、 642.1、 640.9 eV的3个子峰, 依次归因于振激峰、 Mn4+和Mn3+[31]。 由表3的计算结果可以看出, 不同Ce0.7Mn0.3O2催化剂表面Mn3+和Mn的物质的量比由高到低依次为: S-Ce0.7Mn0.3O2(0.606)、 R-Ce0.7Mn0.3O2(0.585)、 G-Ce0.7Mn0.3O2(0.556)。 由此可见, S-Ce0.7Mn0.3O2催化剂的表面Mn3+相对含量最高。 根据静电平衡理论, 较高的Mn3+相对含量意味着较高浓度的表面氧空位, 因此, 催化剂的表面Mn3+相对含量可以作为催化剂表面氧空位浓度的评估参数之一[32]。 S-Ce0.7Mn0.3O2的表面Mn3+相对含量最高, 表明其具有最丰富的表面氧空位。
图8(c)为3种Ce0.7Mn0.3O2催化剂O 1s轨道的XPS的能谱图。 由图可以看出, O 1s能谱图被分为结合能分别在529.3、 531.8、 533.6 eV处的3个衍射峰, 依次归因于晶格氧(OL)、 化学吸附氧(OS)和吸附H2O(OA)[20-22, 33]。 在甲苯催化燃烧反应中, 催化剂的化学吸附氧作为活性氧, 可以增强催化剂的甲苯催化燃烧性能[34]。 表3中的计算结果表明, Ce0.7Mn0.3O2催化剂的OS相对含量有较大差异, 不同Ce0.7Mn0.3O2催化剂表面OS和OL的物质的量比由高到低依次为: S-Ce0.7Mn0.3O2(0.311)、 R-Ce0.7Mn0.3O2(0.232)、 G-Ce0.7Mn0.3O2(0.211), 这表明S-Ce0.7Mn0.3O2的表面具有更丰富的化学吸附氧。 结合对Mn 2p3/2和O 1s的分析结果, 水热法制备Ce0.7Mn0.3O2催化剂具有最丰富的氧空位和化学吸附氧, 因此具有最好的催化燃烧甲苯活性。
2.4 催化剂的氧化还原性能
采用H2-TPR表征探究3种Ce0.7Mn0.3O2催化剂的氧化还原特性,图9为3种Ce0.7Mn0.3O2催化剂的H2-TPR曲线图。由图可以看出, 3种Ce0.7Mn0.3O2催化剂的H2-TPR曲线峰型相似, 均有3个还原峰出现。 将3个还原峰按照温度从低到高依次标记为a、 b、 c, 分别对应3个阶段: 1)Mn4+→Mn3+; 2)Mn3+→Mn2+以及CeO2化学吸附氧的还原过程和3)CeO2→Ce2O3[35-37]。

(a)Ce 3d(b)Mn 2p3/2(c) O 1s图8 3种不同方法制备的Ce0.7Mn0.3O2样品的XPS能谱图Fig.8 XPS spectra of Ce0.7Mn0.3O2 products prepared by three different methods
表3 3种不同方法制备的Ce0.7Mn0.3O2样品表面各元素物质的量比
Tab.3 Ratio of amount of substance each element on surface of Ce0.7Mn0.3O2 products prepared by three different methods
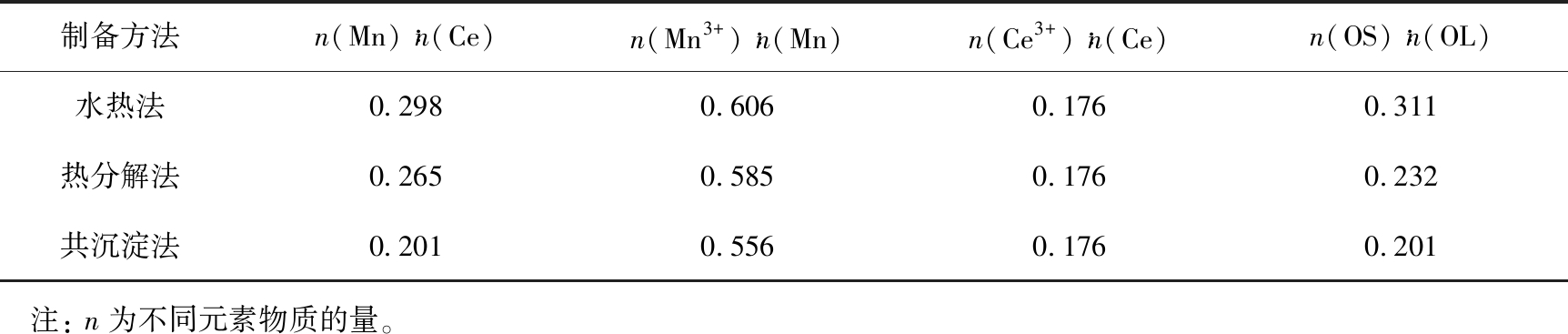
制备方法n(Mn)∶n(Ce)n(Mn3+)∶n(Mn)n(Ce3+)∶n(Ce)n(OS)∶n(OL)水热法0.2980.6060.1760.311热分解法0.2650.5850.1760.232共沉淀法0.2010.5560.1760.201 注: n为不同元素物质的量。
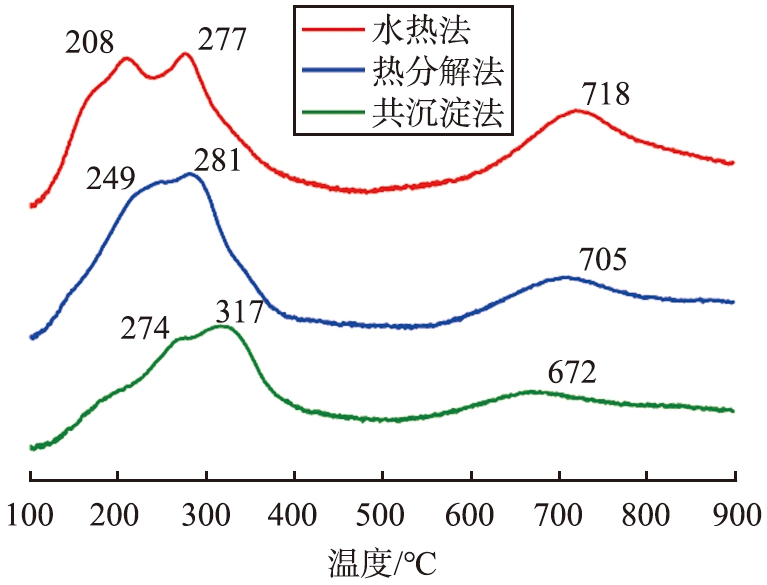
图9 3种不同方法制备的Ce0.7Mn0.3O2样品的H2-TPR曲线图
Fig.9 H2-TPR curves of Ce0.7Mn0.3O2 products prepared by three different methods
a峰的还原峰温度越低, 催化剂的低温还原性越好。 由图9可知, 3种催化剂的a峰峰顶温度由低到高依次为: S-Ce0.7Mn0.3O2(208 ℃)、 R-Ce0.7Mn0.3O2(249 ℃)、 G-Ce0.7Mn0.3O2(274 ℃), S-Ce0.7Mn0.3O2催化剂的低温还原峰封顶温度远低于R-Ce0.7Mn0.3O2和G-Ce0.7Mn0.3O2催化剂的, 表明该样品的低温还原性最好。 根据H2程序升温还原曲线计算出S-Ce0.7Mn0.3O2、 R-Ce0.7Mn0.3O2、 G-Ce0.7Mn0.3O2催化剂的耗氢量依次为2.00、 1.91、 1.54 mmol/g,由此可见, S-Ce0.7Mn0.3O2催化剂具有最高的耗氢量。相关研究[37]表明,催化剂的低温还原性越好, 表面晶格氧流动性越好, 而催化剂的耗氢量越大, 表明其储氧量越大。 高晶格氧流动性和高储氧量都能促使催化剂获得更好的VOCs催化燃烧反应活性,S-Ce0.7Mn0.3O2催化剂具有最佳的晶格氧流动性和最丰富的储氧量, 增强了其在甲苯催化燃烧反应中的催化活性。这可能是由于Ce和Mn之间的相互作用削弱了Ce—O键之间的作用力,使CeO2中的活性氧更容易释放并参与甲苯的催化燃烧反应[38]。
2.5 原位红外分析
甲苯-氮气气氛下,不同反应温度时, S-Ce0.7Mn0.3O2催化剂的原位红外光谱图如图10所示。图中3 067 cm-1处的峰归因于甲苯芳香环上甲基的拉伸振动, 表明甲苯分子在催化剂上发生了物理吸附[39]。1 530~1 570 cm-1处的峰归因于羧酸盐基团的对称拉伸振动,表明甲苯发生氧化生成了苯甲酸盐[40]。1 400 cm-1附近的峰归因于单齿碳酸盐的形成, 是苯甲酸盐发生进一步转化的产物[41]。2 356 cm-1处的峰归因于CO2的反对称拉伸振动,表明甲苯的最终氧化产物为CO2[42]。
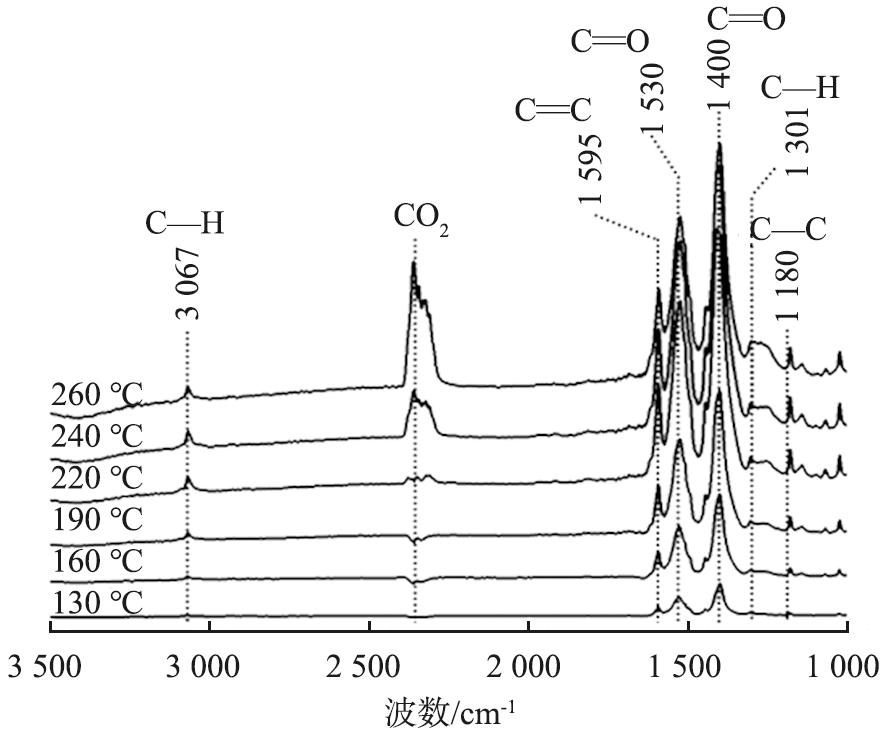
图10 甲苯-氮气气氛下不同反应温度时S-Ce0.7Mn0.3O2催化剂的原位红外光谱图
Fig.10 In situ infrared spectra of S-Ce0.7Mn0.3O2 catalyst at different reaction temperatures in toluene-nitrogen atmosphere
从图10可以看到, 在不同温度下, S-Ce0.7Mn0.3O2上的甲苯吸附峰强度始终较低, 这可能是因为S-Ce0.7Mn0.3O2的催化活性较好, 甲苯在吸附后很快被氧化, 所以未能产生较强的吸附峰。 此外, 尽管没有分子氧参与反应, 在130~220 ℃时仍能观察到苯甲酸盐和碳酸盐的特征峰, 且碳酸盐的峰强度要比苯甲酸盐的强度高, 说明甲苯被催化剂的表面晶格氧氧化形成苯甲酸盐后, 苯甲酸盐又优先转化为碳酸盐。 而当温度继续升至220 ℃以上时, 苯甲酸盐和碳酸盐的吸附峰强度有所下降, CO2特征峰明显增强, 表明碳酸盐被进一步氧化为CO2和H2O。 上述结果表明, 甲苯在S-Ce0.7Mn0.3O2催化剂上发生的催化燃烧反应遵循Marse-van Krevelen反应机制。 结合其他表征分析结果, S-Ce0.7Mn0.3O2上丰富的氧空位和表面晶格氧的高流动性有利于甲苯在催化剂上被快速氧化裂解, 从而在甲苯催化燃烧反应中表现出优异的活性。
3 结论
通过水热法、 热分解法和共沉淀法制备了3种铈锰固溶体催化剂,对其甲苯催化燃烧性能进行测试,并通过各种表征手段进一步分析催化剂的表面元素组成、 氧空位、 氧化还原性能等物理化学性质,探究制备方法对铈锰固溶体的甲苯催化燃烧活性和物理化学性质的影响,得出如下结论。
1)采用水热法、共沉淀法和热分解法均合成了纳米颗粒形貌的铈锰固溶体。
2)制备方法会影响铈锰固溶体催化剂的表面元素的化学价态和氧化还原特性,从而影响催化剂的甲苯催化燃烧性能。
3)水热法制备的S-Ce0.7Mn0.3O2催化剂具有更大的比表面积(93.87 m2/g)、 较强的低温还原性能、 更丰富的氧空位和较强的晶格氧流动性。
4)当甲苯体积分数为1‰、 质量空速为30 L·g-1·h-1时,S-Ce0.7Mn0.3O2催化剂的甲苯完全燃烧温度t90为218 ℃,优于热分解法(246 ℃)和共沉淀法(269 ℃);此外,S-Ce0.7Mn0.3O2催化剂在50 h甲苯催化燃烧反应测试后甲苯转化率仍保持在90 %左右,具有良好的催化稳定性。
5)甲苯在S-Ce0.7Mn0.3O2催化剂上发生的催化燃烧反应遵循体Marse-van Krevelen反应机理:甲苯在催化剂表面吸附后,首先被表面晶格氧氧化为苯甲酸,随后苯环被破坏,苯甲酸裂解产生碳酸盐,最后被完全氧化为CO2和H2O。
此外,制备方法还会对铈锰固溶体催化剂的比表面积和孔道结构产生影响,这会影响催化剂反应活性位点的暴露和反应物分子在催化剂内部的吸附和扩散,因此,未来可以进一步优化各制备方法,使通过不同制备方法制备的铈锰固溶体催化剂的比表面积和孔道结构相近或一致,消除制备方法对催化剂比表面积和孔道结构的影响,从而更深入地探究铈锰固溶体的表面化学结构对其甲苯催化燃烧性能的影响。
[1]LIU B J, JI J, ZHANG B G, et al. Catalytic ozonation of VOCs at low temperature: a comprehensive review[J]. Journal of Hazardous Materials, 2022, 422: 126847.
[2]MENG L Q, ZHAO H B. Low-temperature complete removal of toluene over highly active nanoparticles CuO-TiO2 synthesized via flame spray pyrolysis[J]. Applied Catalysis B: Environmental, 2019, 264: 118427.
[3]JIN Z H, WANG B D, MA L, et al. Air pre-oxidation induced high yield N-doped porous biochar for improving toluene adsorption[J]. Chemical Engineering Journal, 2020, 385: 123843.
[4]KIM J M, KIM J H, LEE C Y, et al. Toluene and acetaldehyde removal from air on to graphene-based adsorbents with microsized pores[J]. Journal of Hazardous Materials, 2018, 344: 458-465.
[5]FRAHN J, MALSCH G, MATUSCHEWSKI H, et al. Separation of aromatic/aliphatic hydrocarbons by photo-modified poly(acrylonitrile) membranes[J]. Journal of Membrane Science, 2004, 234(1/2): 55-65.
[6]WANNER P, ARAVENA R, FERNANDES J, et al. Assessing toluene biodegradation under temporally varying redox conditions in a fractured bedrock aquifer using stable isotope methods[J]. Water Research, 2019, 165: 114986.
[7]XIE R J, LEI D X, ZHAN Y J, et al. Efficient photocatalytic oxidation of gaseous toluene over F-doped TiO2 in a wet scrubbing process[J]. Chemical Engineering Journal, 2020, 386: 121025.
[8]ZHONG L X, BRANCHO J J, BATTERMAN S, et al. Experimental and modeling study of visible light responsive photocatalytic oxidation (PCO) materials for toluene degradation[J]. Applied Catalysis B: Environmental, 2017, 216: 122-132.
[9]CHEN C Y, ZHU J, CHEN F, et al. Enhanced performance in catalytic combustion of toluene over mesoporous Beta zeolite-supported platinum catalyst[J]. Applied Catalysis B: Environmental, 2013, 140/141: 199-205.
[10]FENG S Y, LIU J D, GAO B. Synergistic mechanism of Cu-Mn-Ce oxides in mesoporous ceramic base catalyst for VOCs microwave catalytic combustion[J]. Chemical Engineering Journal, 2022, 429: 132302.
[11]XIAO M L, YANG X Q, PENG Y, et al. Confining shell-sandwiched Ag clusters in MnO2-CeO2 hollow spheres to boost activity and stability of toluene combustion[J]. Nano Research, 2022, 15(8): 7042-7051.
[12]![]() A, DROZDEK M, DUDEK B, et al. Cobalt-containing BEA zeolite for catalytic combustion of toluene[J]. Applied Catalysis B: Environmental, 2017, 212: 59-67.
A, DROZDEK M, DUDEK B, et al. Cobalt-containing BEA zeolite for catalytic combustion of toluene[J]. Applied Catalysis B: Environmental, 2017, 212: 59-67.
[13]MALDONADO-HODAR F J. Removing aromatic and oxygenated VOCs from polluted air stream using Pt-carbon aerogels: assessment of their performance as adsorbents and combustion catalysts[J]. Journal of Hazardous Materials, 2011, 194: 216-222.
[14]ZHAO S, HU F Y, LI J H. Hierarchical core-shell Al2O3@Pd-CoAlO microspheres for low-temperature toluene combustion[J]. ACS Catalysis, 2016, 6(6): 3433-3441.
[15]WANG Y Q, XUE Y F, ZHAO C C, et al. Catalytic combustion of toluene with La0.8Ce0.2MnO3 supported on CeO2 with different morphologies[J]. Chemical Engineering Journal, 2016, 300: 300-305.
[16]WAN J, TAO F, SHI Y J. Designed preparation of nano rod shaped CeO2-MnOx catalysts with different Ce/Mn ratios and its highly efficient catalytic performance for chlorobenzene complete oxidation: new insights into structure-activity correlations[J]. Chemical Engineering Journal, 202, 433P3: 1333788.
[17]ZHANG X D, BI F K, ZHU Z Q, et al. The promoting effect of H2O on rod-like MnCeOx derived from MOFs for toluene oxidation: a combined experimental and theoretical investigation[J]. Applied Catalysis B: Environmental, 2021, 297: 120393.
[18]GINO P, ROMULO C, MARIA R, et al. Preparation by co-precipitation of Ce-Mn based catalysts for combustion of n-hexane[J]. Materials Research Bulletin: An International Journal Reporting Research on Crystal Growth and Materials Preparation and Characterization, 2015, 70(10):621-632.
[19]LI J J, HU R S, ZHANG J G, et al. Influence of preparation methods of La2CoMnO6/CeO2 on the methane catalytic combustion[J]. Fuel, 2016, 178: 148-154.
[20]WANG L, XIE H K, WANG X D, et al. Preparation of LaMnO3 for catalytic combustion of vinyl chloride[J]. Chinese Journal of Catalysis, 2017, 38(8): 1406-1412.
[21]LUO Y J, LIN D F, ZHENG Y B, et al. MnO2 nanoparticles encapsuled in spheres of Ce-Mn solid solution: efficient catalyst and good water tolerance for low-temperature toluene oxidation[J]. Applied Surface Science, 2020, 504: 144481.
[22]WANG J G, YANG S F, SUN H H, et al. Highly improved soot combustion performance over synergetic MnxCe1-xO2 solid solutions within mesoporous nanosheets[J]. Journal of Colloid and Interface Science, 2020, 577: 355-367.
[23]TANHAEI M, MAHJOUB A R, SAFARIFARD V. Energy-efficient sonochemical approach for the preparation of nanohybrid composites from graphene oxide and metal-organic framework[J]. Inorganic Chemistry Communications, 2019, 102: 185-191.
[24]ZHANG C H, GUO Y L, GUO Y, et al. LaMnO3 perovskite oxides prepared by different methods for catalytic oxidation of toluene[J]. Applied Catalysis B: Environmental, 2014, 148/149: 490-498.
[25]LI R Z, ZHANG L, ZHU S M, et al. Layered δ-MnO2 as an active catalyst for toluene catalytic combustion[J]. Applied Catalysis A: General, 2020, 602: 117715.
[26]CHOJNACKA A, MOLENDA M, CHMIELARZ L, et al. Ceria based novel nanocomposites catalysts MnxCe1-xO2/α-Al2O3 for low-temperature combustion of methanol[J]. Catalysis Today, 2015, 257: 104-110.
[27]WANG X Y, QIAN K, LI D. Catalytic combustion of chlorobenzene over MnOx-CeO2 mixed oxide catalysts[J]. Applied Catalysis B: Environmental, 2009, 86(3): 166-175.
[28]ZHANG W L, LI M Y, WANG X T, et al. Boosting catalytic toluene combustion over Mn doped Co3O4 spinel catalysts: Improved mobility of surface oxygen due to formation of Mn—O—Co bonds[J]. Applied Surface Science, 2022, 590: 153140.
[29]XIAO W D, GUO Q L, WANG E G. Transformation of CeO2(1 1 1) to Ce2O3 (0 0 0 1) films[J]. Chemical Physics Letters, 2003, 368(5/6): 527-531.
[30]PFAU A, SCHIERBAUM K D. The electronic structure of stoichiometric and reduced CeO2 surfaces: an XPS, UPS and HREELS study[J]. Surface Science, 1994, 321(1/2): 71-80.
[31]DU H W, WANG Y, ARANDIYAN H, et al. Design and synthesis of CeO2 nanowire/MnO2 nanosheet heterogeneous structure for enhanced catalytic properties[J]. Materials Today Communications, 2017, 11: 103-111.
[32]DONG C, QU Z P, JIANG X, et al. Tuning oxygen vacancy concentration of MnO2 through metal doping for improved toluene oxidation[J]. Journal of Hazardous Materials, 2020, 391: 122181.
[33]GENUINO H C, MENG Y, HORVATH D T, et al. Enhancement of catalytic activities of octahedral molecular sieve manganese oxide for total and preferential CO oxidation through vanadium Ion framework substitution[J]. Chem Cat Chem, 2013, 5(8): 2306-2317.
[34]MO S P, ZHANG Q, LI J Q, et al. Highly efficient mesoporous MnO2 catalysts for the total toluene oxidation: oxygen-vacancy defect engineering and involved intermediates using in situ DRIFTS[J]. Applied Catalysis B: Environmental, 2020, 264: 118464.
[35]CHEN J, CHEN X, YAN D X, et al. A facile strategy of enhancing interaction between cerium and manganese oxides for catalytic removal of gaseous organic contaminants[J]. Applied Catalysis B: Environmental, 2019, 250: 396-407.
[36]SHEN Q, ZHANG L Y, SUN N N, et al. Hollow MnOx-CeO2 mixed oxides as highly efficient catalysts in NO oxidation[J]. Chemical Engineering Journal, 2017, 322: 46-55.
[37]DU J P, QU Z P, DONG C, et al. Low-temperature abatement of toluene over Mn-Ce oxides catalysts synthesized by a modified hydrothermal approach[J]. Applied Surface Science, 2018, 433: 1025-1035.
[38]LI X L, NIU Y F, ZHANG C W, et al. Catalytic combustion of toluene over broccoli-shaped Ce1Mn3Ox solid solution[J]. Chem Cat Chem, 2021, 13(19): 4223-4236.
[39]MO S P, ZHANG Q, LI J Q, et al. Highly efficient mesoporous MnO2 catalysts for the total toluene oxidation: oxygen-vacancy defect engineering and involved intermediates using in situ DRIFTS[J]. Applied Catalysis B: Environmental, 2020, 264: 44-58.
[40]FAN J, REN Q M, MO S P, et al. Transient in-situ DRIFTS investigation of catalytic oxidation of toluene over α-, γ- and β-MnO2[J]. Chem Cat Chem, 2020, 12(4): 1046-1054.
[41]WANG P F, WANG J, AN X W, et al. Generation of abundant defects in Mn-Co mixed oxides by a facile agar-gel method for highly efficient catalysis of total toluene oxidation[J]. Applied Catalysis B: Environmental, 2021, 282: 58-65.
[42]SUN H, LIU Z G, CHEN S, et al. The role of lattice oxygen on the activity and selectivity of the OMS-2 catalyst for the total oxidation of toluene[J]. Chemical Engineering Journal, 2015, 270: 58-65.