目前,氢氧化钙(Ca(OH)2)已经发展成为一种极其重要的无机化工产品, 广泛应用于化学蓄热材料[1]、 废水处理[2]、 烟气脱酸性气体[3]、 垃圾焚烧[4]、 文物及石材保护[5]、 牙科医用材料[6]等领域。 Ca(OH)2粉末表面粗糙, 粉末易团聚, 晶体颗粒极易长大, 比表面积较小, 由生石灰消化制成的Ca(OH)2的比表面积小于15 m2/g[7], 但近年来学者对石灰消化过程进行改良, 制成了高比表面积的Ca(OH)2[8]。 在烟气干法脱硫过程中, 由于普通Ca(OH)2比表面积小, 孔容和孔径小, 因此脱硫效率低。 主流使用的干法脱硫剂是价格昂贵的碳酸氢钠(NaHCO3)。 如何使用工业级生石灰低成本生产高比表面积的Ca(OH)2, 从而替代NaHCO3干法脱硫是目前研究的热点, 因此制备高比表面积、 高孔隙率和小粒径尺寸的Ca(OH)2粉体对烟气净化及相关方面的应用具有重要意义,其中石灰消化条件对消化产物Ca(OH)2性能有重要影响。
影响石灰消化效果的因素主要包括生石灰原料颗粒大小[9]、 反应温度[10]、 转速[11]、 水与石灰的质量比(水灰比)[12]和消化时间[13]等。 卢丽君等[14]通过控制消化时间、 水灰比、 搅拌速度、 去离子水的初始温度等消化条件的变化, 考察不同消化条件对纯生石灰消化制成的Ca(OH)2的晶型和比表面积的影响。 薛健等[15]认为纯石灰消化产物Ca(OH)2的粒径和比表面积与消化工艺参数有关。 谷丽等[16]对石灰消化水温、 水灰比、 陈化时间等因素对氢氧化钙活性的影响进行研究, 当初始消化温度为84 ℃、水灰比为5∶1时, 石灰消化产物Ca(OH)2的分散性较好, 活性较高。 魏仁零等[17]用正交试验法研究消化工艺参数对分析纯石灰干式消化速度及消石灰结构性能的影响, 其中消化参数对消化结果的影响从大到小排序为消化时间、 水灰比、 搅拌速度、 消化用水初始温度。 马跃强等[18]考察了搅拌强度、 消化用水初始温度、 水灰比等消化条件对纯生石灰的消化活性和烧结烟气脱硫效率的影响, 当搅拌转速为250 r/min、 消化用水初始温度为25 ℃、 水灰比为6∶1时, 烟气脱硫效率达到92.5%。
目前国内外学者集中于对纯生石灰进行消化特性的研究, 制成的Ca(OH)2的比表面积较小, 同时消化条件对Ca(OH)2的表面特性、 晶型结构等影响也没有得到深入分析, 而实际工况使用低成本的工业级生石灰消化制成Ca(OH)2较多, 研究工业级石灰消化特性及使用工业级石灰制成高比表Ca(OH)2是十分必要的。 本文中在自制消化装置中, 加入添加剂对工业级石灰进行调质, 制成高比表Ca(OH)2, 采用控制变量法, 系统地研究不同消化条件如水灰比、 消化时间、 去离子水的初始温度、 生石灰粒径、 搅拌转速等因素对高比表Ca(OH)2性能的影响, 经比表面积、 粒度分布、 晶型、 表面形貌测试等表征手段寻找最佳石灰消化参数, 从而得到了高比表Ca(OH)2最优的制备条件, 为高比表Ca(OH)2的制备研究提供理论依据, 为实现高比表Ca(OH)2的工业生产提供参考数据。
1 实验
1.1 主要试剂材料与仪器设备
材料: 生石灰(山西辰瑞晟公司气烘回转窑); 添加剂、 盐酸、 蔗糖(均为分析纯,天津市科密欧化学试剂有限公司)。
仪器设备: V-SorbX800型孔径分析测试仪(北京金埃谱公司); Zetium型X射线荧光光谱仪(荷兰帕纳科公司); UltimanIV型X-射线衍射仪(日本理学公司); Sync型激光粒度分布测试仪(美国麦奇克公司); S-570型电子扫描电镜(日本日立公司)。
1.2 方法
1.2.1 石灰有效钙及活性度的测定
将块状生石灰进行破碎后,称取一定质量,测定其有效钙含量和活性度。根据GB/T 5762—2012《建材用石灰石、 生石灰和熟石灰化学分析方法》[19]测定生石灰样品的有效钙含量。称取质量为1 g的试样,用水将试样消化并分散,通过与蔗糖反应,石灰被溶解并形成蔗糖钙,然后以酚酞为指示剂,用盐酸标准滴溶液滴定蔗糖钙,石灰有效钙含量计算公式为
(1)
式中: w为有效氧化钙的质量分数; T为盐酸标准滴定溶液对氧化钙的滴定度; V13为滴定时消耗盐酸标准滴定溶液的体积; m17为试料的质量。
根据DL/T 323—2010 《干法烟气脱硫用生石灰的活性测定方法》[20]测定生石灰样品的活性度。称取质量为150 g的生石灰样品,进行消化实验,读取温度。生石灰的活性指在规定条件下进行消化时,最大温升与所需时间的比值计算式为
(2)
式中: A为生石灰的活性; tmax为生石灰加水后达到的最高温度; t0为初始温度; t为达到最高温度所需的时间。
1.2.2 石灰消化
称取质量为50 g的生石灰, 将添加剂倒入相应水灰比的去离子水中混合均匀后, 倒入盛有生石灰的消化反应器中进行消化, 搅拌器混合生石灰和高温水溶液, 在消化反应器中进行消化得到高比表面积、 高活性的Ca(OH)2粉末; 保持其他消化条件相同, 水灰比控制为0.4、 0.5、 0.6、 0.7、 0.8、 0.9、 1.0, 将样品依次记为1-1、 1-2、 1-3、 1-4、 1-5、 1-6、 1-7;保持其他消化条件相同,消化时间选取5、 10、 15、 20、 25、 30 min,将样品依次记为2-1、 2-2、 2-3、 2-4、 2-5、 2-6;保持其他消化条件相同,去离子水的初始温度选取20、 40、 60、 80、 90 ℃,将样品依次记为3-1、 3-2、 3-3、 3-4、 3-5;保持其他消化条件相同,生石灰的初始粒径选取>75~150、 >48~75、 38~48 μm,将样品依次记为4-1、 4-2、 4-3;保持其他消化条件相同,搅拌转速选取40、 60、 80、 100、 120 r/min,将样品依次记为5-1、 5-2、 5-3、 5-4、 5-5。 表1所示为实验所制备的样品编号及详细的消化条件。
表1 制备的样品编号及详细的消化条件
Tab.1 Sample numbers and detailed digestion conditions
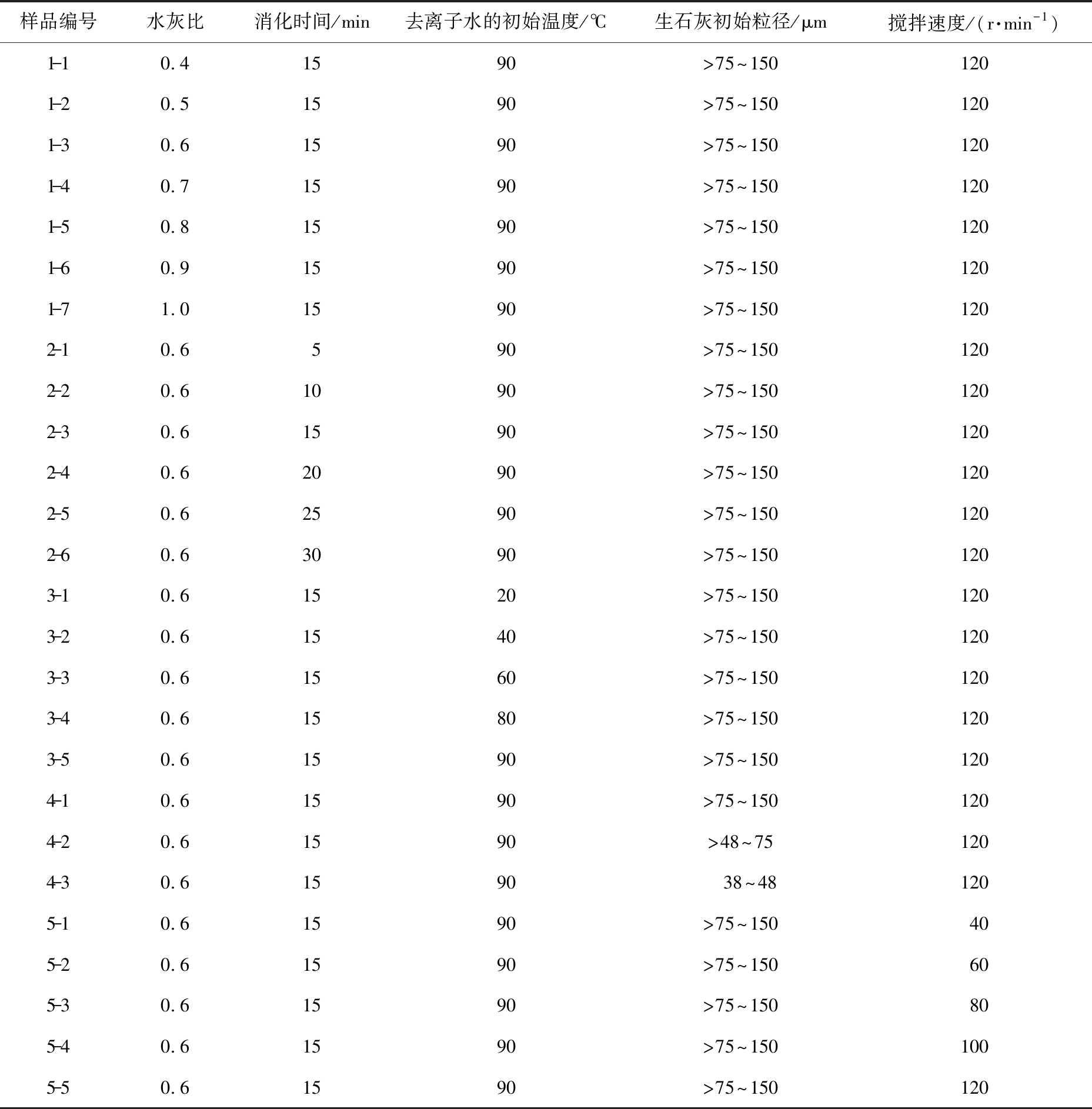
样品编号水灰比消化时间/min去离子水的初始温度/℃生石灰初始粒径/μm搅拌速度/(r·min-1)1-10.41590>75~1501201-20.51590>75~1501201-30.61590>75~1501201-40.71590>75~1501201-50.81590>75~1501201-60.91590>75~1501201-71.01590>75~1501202-10.6590>75~1501202-20.61090>75~1501202-30.61590>75~1501202-40.62090>75~1501202-50.62590>75~1501202-60.63090>75~1501203-10.61520>75~1501203-20.61540>75~1501203-30.61560>75~1501203-40.61580>75~1501203-50.61590>75~1501204-10.61590>75~1501204-20.61590>48~751204-30.61590 38~481205-10.61590>75~150405-20.61590>75~150605-30.61590>75~150805-40.61590>75~1501005-50.61590>75~150120
1.2.3 氢氧化物的表征
采用孔径分析测试仪测试Ca(OH)2的比表面积和孔径分布。 使用X射线荧光光谱仪测试氧化钙(CaO)原料的成分组成, 对样品进行压片,定性半定量法测试全元素, 以氧化物的形式进行分析。 Ca(OH)2的晶型结构使用X射线衍射仪测试。 采用激光粒度分布测试仪测试Ca(OH)2的粒度分布, 由于Ca(OH)2微溶于水, Ca(OH)2样品测量方法为干法测量。 扫描电镜用于表征Ca(OH)2的微观形貌和表面结构。
2 结果与分析
2.1 生石灰物相分析
使用X射线荧光光谱仪测试破碎后生石灰样品的化学成分,得出样品中CaO含量(质量分数,下同)为95.48%左右,MgO含量为3.23%, SiO2含量为0.588%, Al2O3含量为0.325%, Fe2O3含量为0.255%。由于MgO含量小于5%,样品属于钙质石灰。
对破碎后的生石灰样品进行盐酸滴定实验,测定有效钙含量,经过3次平行实验,结果见表2所示。由表可知,生石灰有效钙含量为86.63%,含量较高,有效钙是指能迅速水解形成Ca(OH)2并具有活性的CaO。由于煅烧温度的原因,有些CaO遇水后并不能迅速发生水解反应,这种游离在水中的CaO又称为过烧CaO,石灰中还含有少量的硅酸钙、铝酸钙等钙化合物,都属于非活性的钙盐,因此样品的CaO含量大于有效钙含量。
对破碎后的生石灰样品进行活性测试,经过3次平行实验,结果如图1所示。由图看出,生石灰在4 min时温度升高了47.3 ℃,生石灰的活性为23.67 ℃/min,将活性测试升至60 ℃以上的反应时间记为t60,3次测试中,样品在1 min内温度均升至60 ℃以上,即t60为60 s。
采用X射线衍射仪测定生石灰样品的XRD图谱,如图2所示。由图可知,生石灰含有Ca(OH)2和MgO的特征衍射峰,由于生石灰吸潮,与空气中的水分反应生成Ca(OH)2,MgO为生石灰样品中固有物质,生石灰特征衍射峰与CaO标准卡片一一对应,说明生石灰样品中主要成分为CaO,生石灰的活性和有效钙含量很高,证明生石灰的品质优良。
表2 生石灰样品的有效钙含量
Tab.2 Available calcium content of quicklime sample
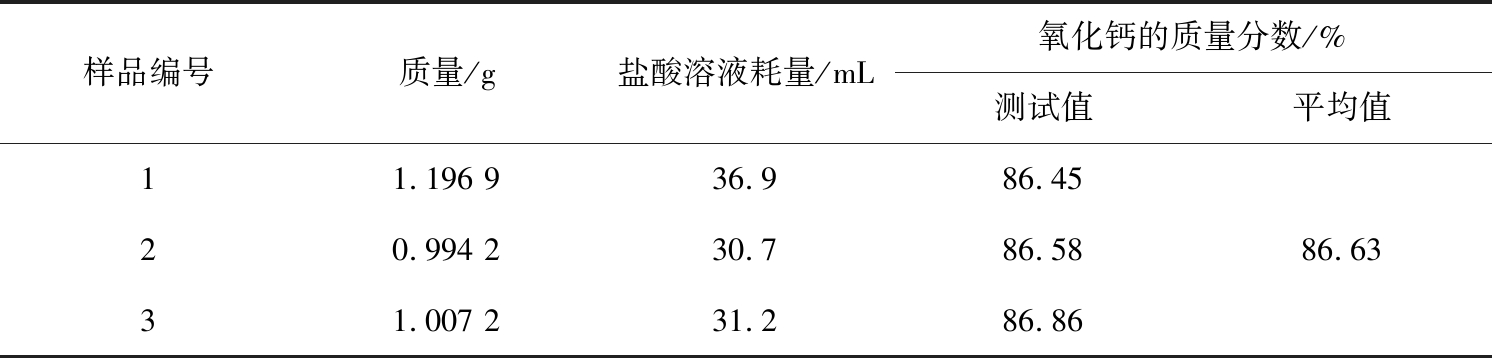
样品编号质量/g盐酸溶液耗量/mL氧化钙的质量分数/%测试值平均值11.196 936.986.4520.994 230.786.5831.007 231.286.8686.63
2.2 水灰比对Ca(OH)2性能的影响
当其他消化条件相同时(去离子水的初始温度、 消化时间、 石灰初始粒径范围、 搅拌转速),进行样品1-1、 1-2、 1-3、 1-4、 1-5、 1-6、 1-7的7组实验。 水灰比对石灰消化反应速率的影响如图3所示。 从不同水灰比下消化体系的温度变化趋势可以看出: 水灰比为0.4时, 由于加水量少, 生石灰的消化速率慢, 在前2 min内达到最高温升; 当水灰比从0.5升至1.0时, 消化反应在前1 min内, 反应温度均达到最高温升, 消化反应体系最高温度范围为70~80 ℃。 当水灰比为1.0时, 在1 min内消化温升达到54 ℃,生石灰消化过程中晶形的形成是瞬间的, 达到最高温升后续的搅拌放热过程属于Ca(OH)2晶体的陈化过程。
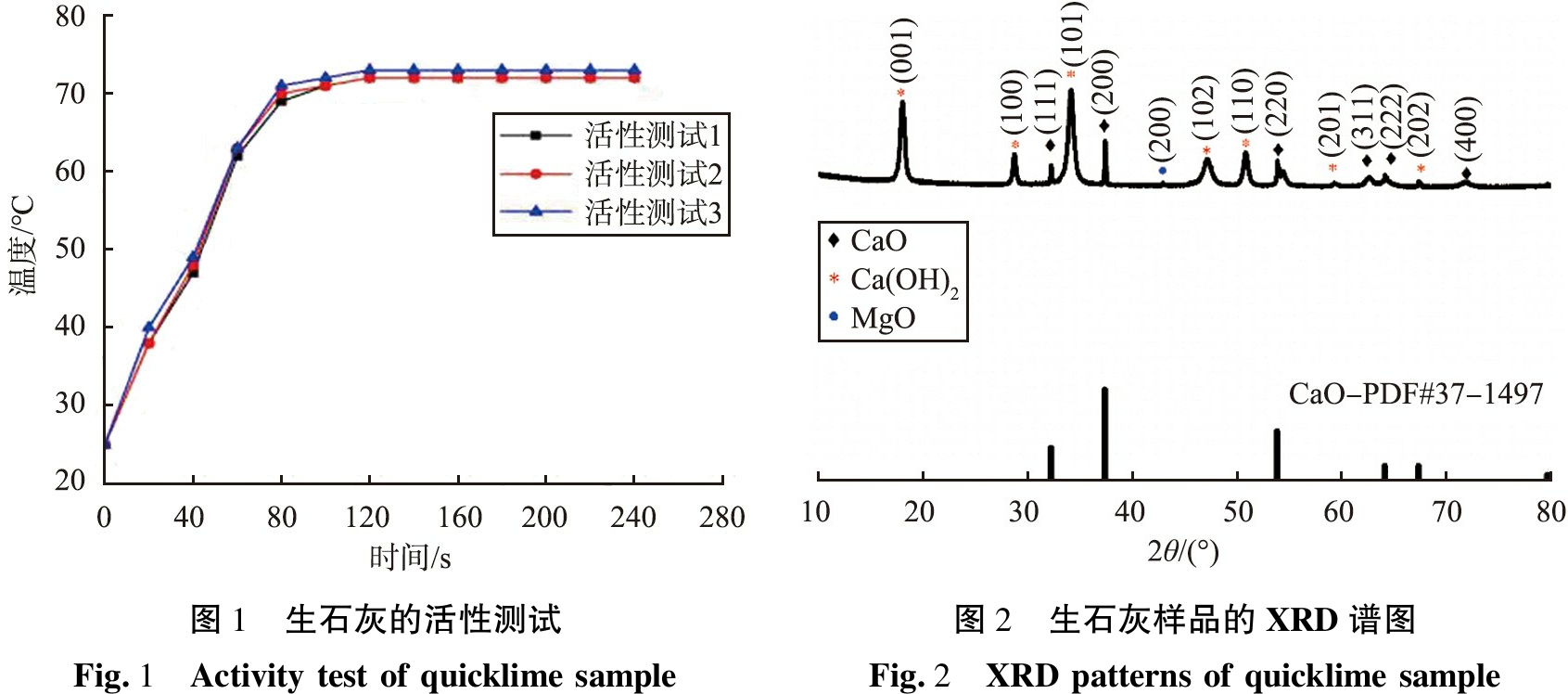
图1 生石灰的活性测试Fig.1 Activity test of quicklime sample图2 生石灰样品的XRD谱图Fig.2 XRD patterns of quicklime sample
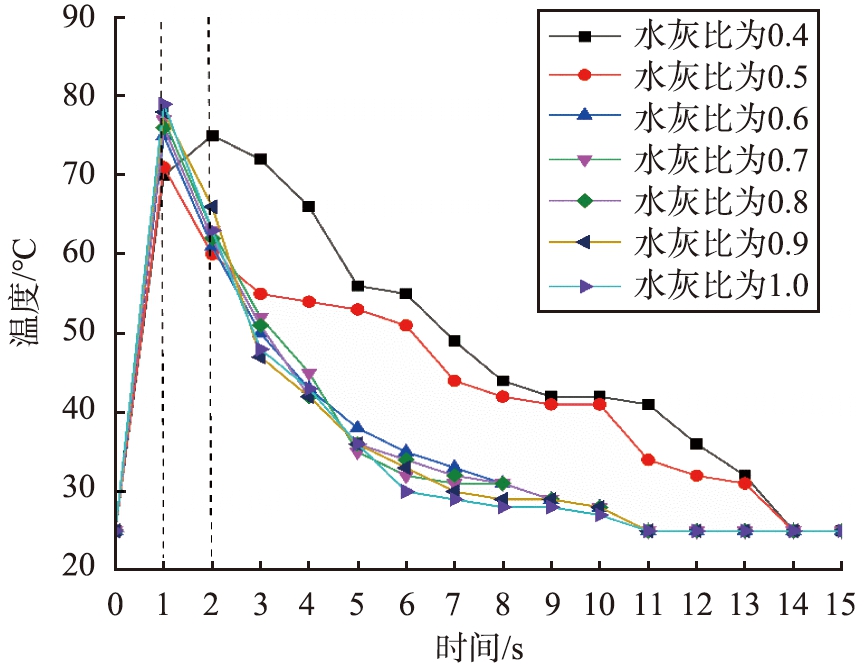
图3 不同水灰比消化体系的温度变化
Fig.3 Temperature variation of digestion system under different water-lime ratios
通过比表面积分析仪测量7个样品的比表面积、 比孔容积和平均孔径, 如表3所示。 在保证其他消化条件(去离子水的初始温度、 消化时间、 生石灰初始粒径范围、 搅拌转速)相同时, Ca(OH)2的比表面积随水灰比的增加呈先增大后减小的趋势。 当水灰比过小时, 加水量不足造成生成的Ca(OH)2因缺水而烧死, 所生成的致密Ca(OH)2薄膜阻碍了石灰消化反应[21]。 水灰比从0.4增加到0.6时,样品的孔容和孔径迅速增大, 比表面积不断增大, 当水灰比为0.6时, Ca(OH)2的比表面积最大, 达到26.382 m2/g,当水灰比升高至0.7时, Ca(OH)2的比表面积逐渐减小, 孔容和孔径减小。 随着水灰比进一步加大, Ca(OH)2含水率进一步增加, 吸附于颗粒表面的液体使Ca(OH)2颗粒间团聚形成大颗粒, 从而降低了Ca(OH)2的比表面积[14]。
表3 不同水灰比制成的Ca(OH)2比表面积、比孔容积、平均孔径
Tab.3 Ca(OH)2 specific surface area, specific pore volume and average pore diameter prepared with different water-lime ratios
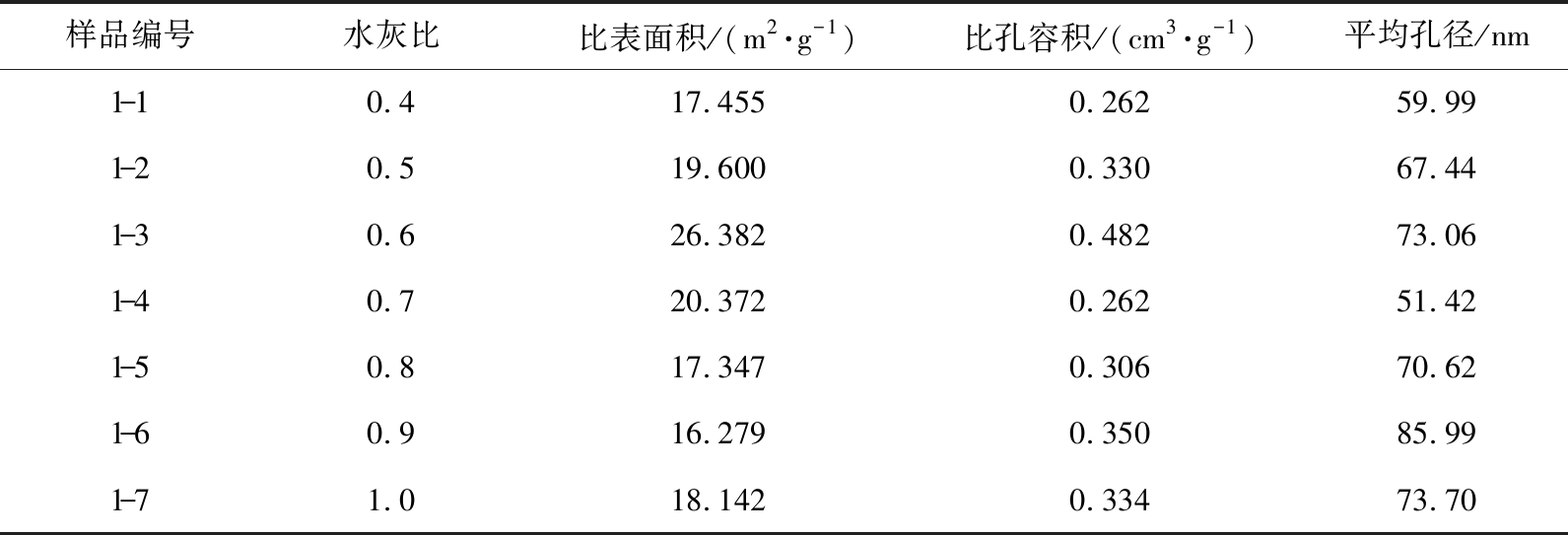
样品编号水灰比比表面积/(m2·g-1)比孔容积/(cm3·g-1)平均孔径/nm1-10.417.4550.26259.991-20.519.6000.33067.441-30.626.3820.48273.061-40.720.3720.26251.421-50.817.3470.30670.621-60.916.2790.35085.991-71.018.1420.33473.70
通过激光粒度仪测量6个样品的粒度分布(样品1-1—1-6),如图4所示。水灰比从0.4增加到0.9时, 中位粒径d50呈先减小后增大的趋势, d50分别为8.13、 9.11、 6.69、 9.01、 23.42、 47.34 μm,水灰比为0.6时,Ca(OH)2的粒度分布最集中,6 μm左右分布最多,而水灰比为0.8和0.9制成的Ca(OH)2在100 μm以后也有较多分布, 水量过多,会导致消化温度的降低,消化速度放缓,从而导致Ca(OH)2粒子易团聚,颗粒变大,影响了Ca(OH)2的分散性。
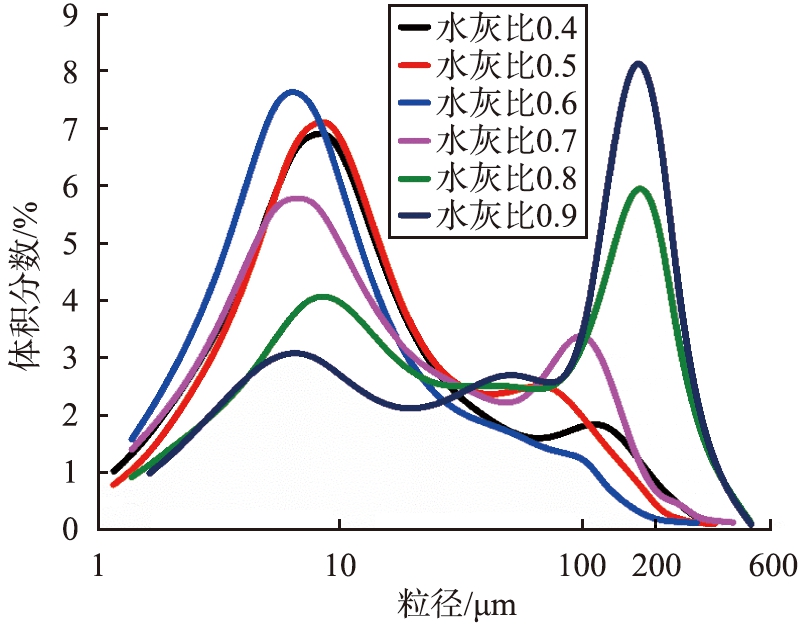
图4 不同水灰比制成的Ca(OH)2粒度分布
Fig.4 Particle size distribution of Ca(OH)2 prepared with different water-lime ratios
通过X射线衍射仪测量5个样品的谱图(样品1-1—1-5),如图5所示。 消化实验得到Ca(OH)2的特征衍射峰与Ca(OH)2标准卡片一一对应, 说明添加剂未对石灰消化过程产生的晶体结构造成影响, 物种分散良好, 晶粒尺寸随水灰比的增加呈先减小后增大的趋势, 当水灰比为0.7时,Ca(OH)2的平均晶粒尺寸最小, 为13.8 nm。图中(001)晶面的半峰全宽增加,表明Ca(OH)2六边形晶体沿基面优先排列, (001)面是六边形的基面[22]。 水灰比从0.4升至0.8时,生石灰消化制成的Ca(OH)2未存在CaO的衍射峰, 说明消化效果好。水灰比由0.4上升至0.6时, MgO的(200)峰面由宽变窄, 水灰比为0.6时, MgO的(200)晶面特征衍射峰最强, 晶粒最大, 结晶度最好, 结构紧密, 晶格完整,MgO活性较低;当水灰比继续上升至0.8时,MgO峰面趋于平缓, 晶粒减小,MgO活性的增大对Ca(OH)2的比表面积有不利影响[23],综合考虑Ca(OH)2的比表面积、 粒度分布、 晶型等因素,选取最佳水灰比为0.6。
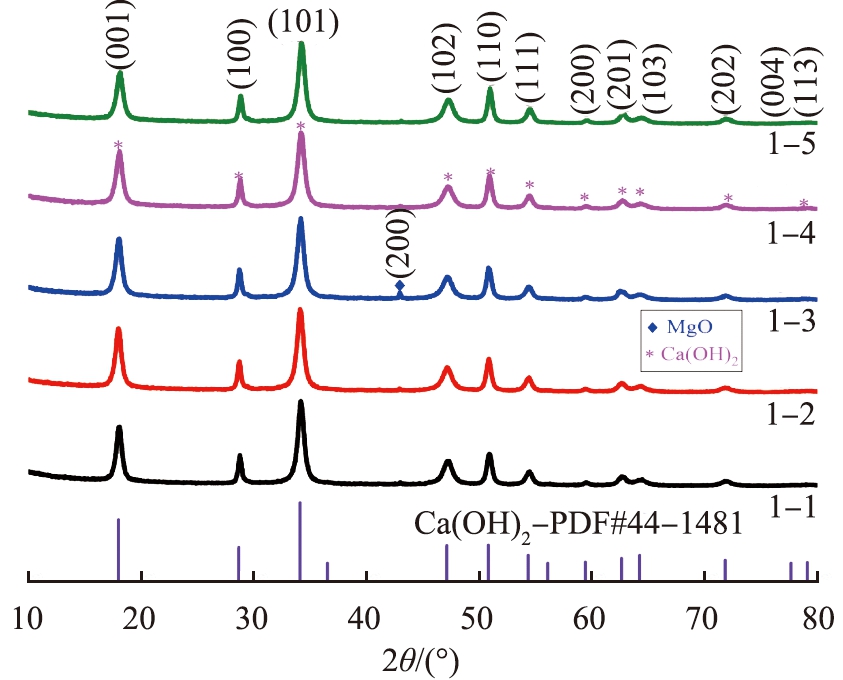
图5 不同水灰比制成的Ca(OH)2的XRD谱图
Fig.5 XRD patterns of Ca(OH)2 prepared with different water-lime ratios
2.3 消化时间对Ca(OH)2性能的影响
当其他消化条件相同时(水灰比、 生石灰初始粒径范围、 去离子水的初始温度、 搅拌转速), 进行样品2-1—2-6的6组实验, 采用比表面积分析仪测量6个样品的比表面积、 比孔容积和平均孔径, 结果见表4。 由表可知, Ca(OH)2的比表面积随着石灰消化时间的推移呈先增大后减小的趋势。当消化时间从5 min增加到15 min后, Ca(OH)2的比表面积、 比孔容积和孔径均增大, 当消化时间为15 min时, Ca(OH)2的比表面积最大,随着消化时间继续增加,Ca(OH)2的比表面积逐渐减小。消化时间短,石灰消化不充分,比表面积较小;消化时间过长,则会产生粉末结团现象,从而使Ca(OH)2的比表面积和孔隙率减小[24],应合理控制消化时间在10~15 min。
表4 不同消化时间制成的Ca(OH)2的比表面积、 比孔容积、 平均孔径
Tab.4 Ca(OH)2 specific surface area, specific pore volume and average pore diameter prepared with different digestion time
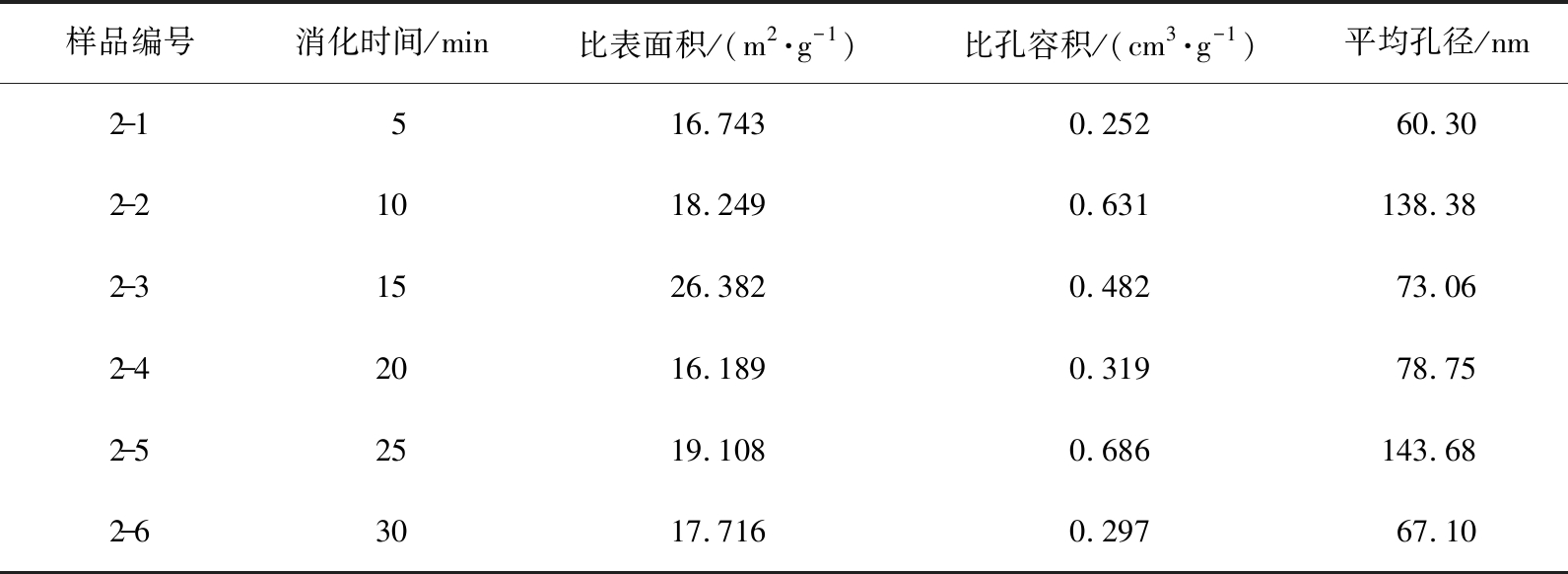
样品编号消化时间/min比表面积/(m2·g-1)比孔容积/(cm3·g-1)平均孔径/nm2-1516.7430.25260.302-21018.2490.631138.38 2-31526.3820.48273.062-42016.1890.31978.752-52519.1080.686143.68 2-63017.7160.29767.10
不同消化时间制成的Ca(OH)2的N2吸附-解吸等温线和孔径分布如图6所示,根据国际纯粹与应用化学联合会(IUPAC)提出的物理吸附等温线分类,本实验制成的Ca(OH)2均为Ⅲ型等温线,吸附质与吸附剂相互之间的作用微弱,随着消化时间从5 min增加到15 min,孔径分布区间变窄,孔体积最大;当消化时间延长至25 min时,制成的Ca(OH)2的孔径分布区间减小,孔体积减小。
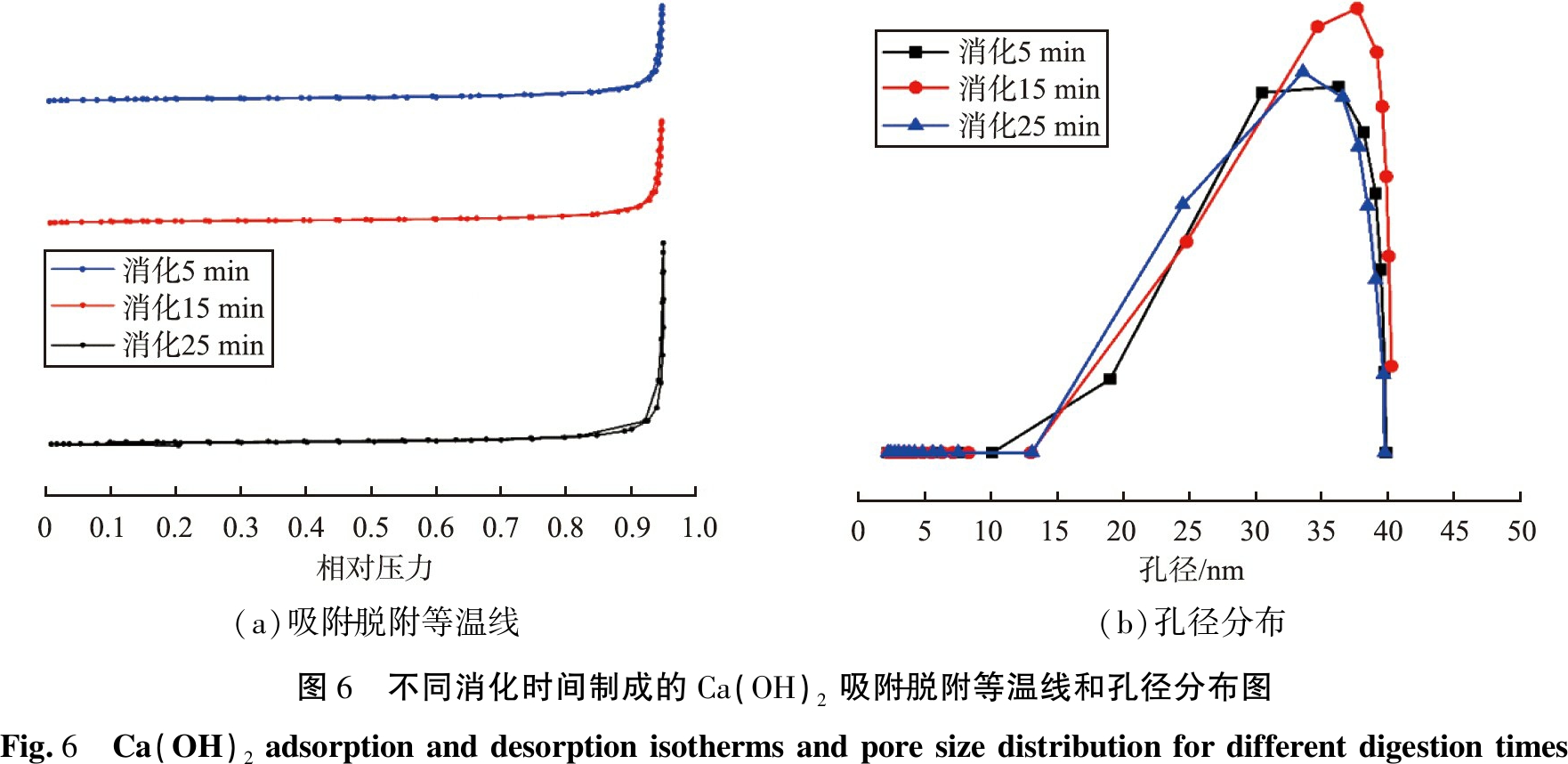
(a)吸附-脱附等温线(b)孔径分布图6 不同消化时间制成的Ca(OH)2吸附-脱附等温线和孔径分布图Fig.6 Ca(OH)2 adsorption and desorption isotherms and pore size distribution for different digestion times
通过激光粒度仪测量3个样品的粒度分布(样品2-1、 样品2-3、 样品2-5),如图7所示。随着消化时间的增加,Ca(OH)2的粒度先减小后增大,Ca(OH)2的d50分别为17.3、 7.01、 14.39 μm。随着消化过程的进行,Ca(OH)2的粉体表面很容易发生团聚现象[16]。在消化5 min后,继续适度延长消化时间可减小Ca(OH)2的粒径; 消化15 min时,Ca(OH)2的粒径明显减小;当消化25 min时,Ca(OH)2的分散性变差。
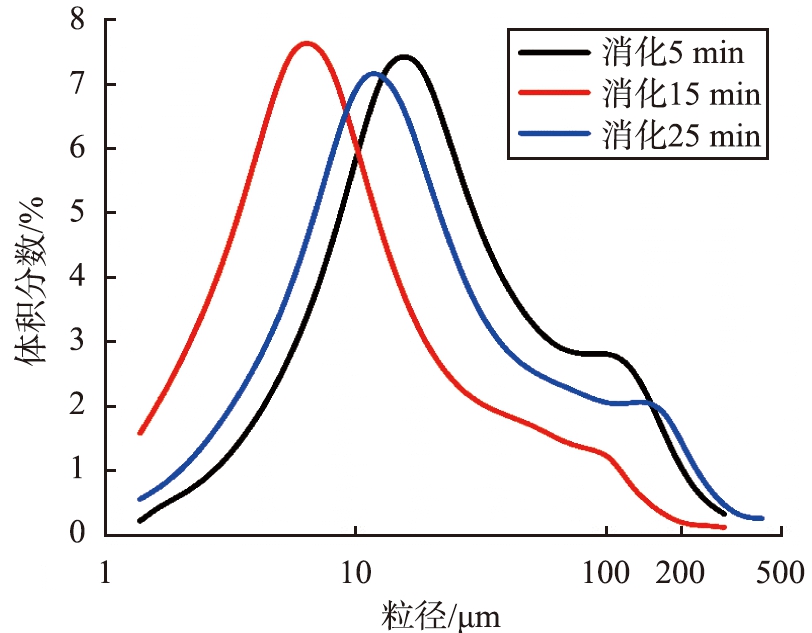
图7 不同消化时间制成的Ca(OH)2粒度分布
Fig.7 Particle size distribution of Ca(OH)2 prepared at different digestion times
通过X射线衍射仪测量4个样品的谱图(样品2-1、 样品2-2、 样品2-3、 样品2-5),如图8所示。由图可知,不同消化时间实验得到Ca(OH)2的特征衍射峰与Ca(OH)2的标准卡片一一对应,通过计算Ca(OH)2的平均晶粒尺寸,晶粒尺寸随消化时间的延长呈先减小后增大的趋势,当消化时间为15 min时,Ca(OH)2的平均晶粒尺寸最小,为14.7 nm。不同消化时间下均检测出MgO的(200)晶面特征衍射峰,在衍射角度2θ=75°~80°处,Ca(OH)2的标准(004)、 (113)晶型的特征峰较小。经对比发现消化5 min得到的Ca(OH)2与消化25 min的Ca(OH)2晶型一致,推测石灰消化反应在消化反应器中高速搅拌5 min内反应完全,晶体逐渐生长稳定,石灰消化是一个快速剧烈的反应过程。综合考虑Ca(OH)2的比表面积、粒度分布、晶型等因素,选取最佳石灰消化时间为15 min。
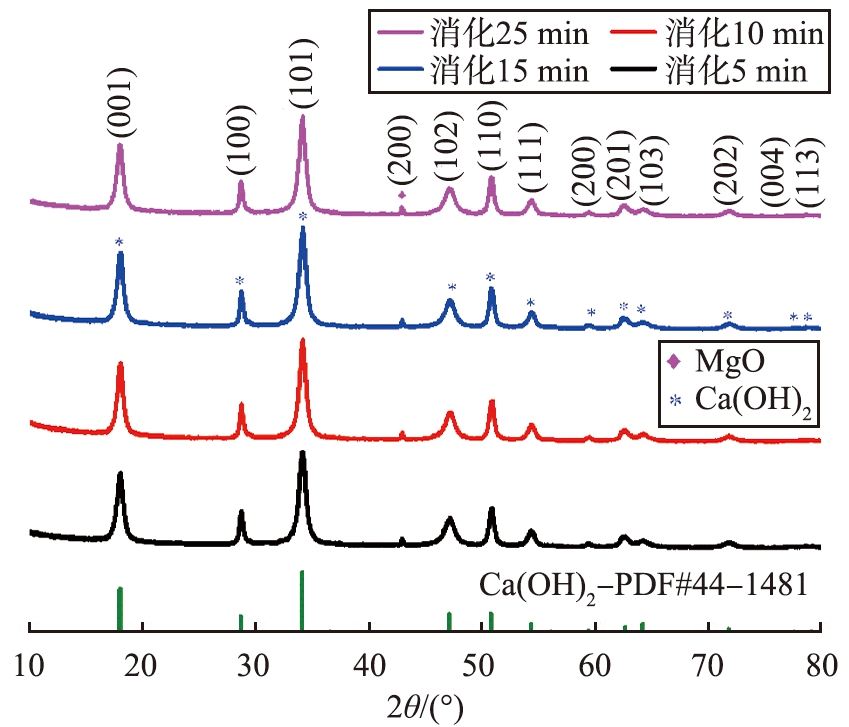
图8 不同消化时间制成的Ca(OH)2的XRD谱图
Fig.8 XRD patterns of Ca(OH)2 prepared at different digestion times
2.4 去离子水的初始温度对Ca(OH)2性能的影响
当其他消化条件相同时(水灰比、生石灰初始粒径范围、消化时间、搅拌转速),进行样品3-1—3-5的5组实验,去离子水的初始温度会影响石灰消化反应速率,如图9所示。在前1 min内,水温在60、 80、 90 ℃时, 消化反应温度随着去离子水初始温度的升高而不断上升。 水温在20、 40 ℃时, 消化反应温度经3 min才达到最高温升。 去离子水初始温度的升高加快了生石灰的消化反应速度, 升高水温会增加Ca2+和OH-的平均动能, 加速它们在溶液中的扩散速率并增加它们的相互碰撞频率[25]。当消化时间在10 min以后,消化反应温度降到最低,说明石灰消化是快速放热的过程,反应达到最高温升后在1 min内温度就开始下降,10 min后降到室温,反应体系达到热平衡。
通过比表面积分析仪测量5个样品的比表面积、 比孔容积和平均孔径, 如表5所示。 Ca(OH)2的比表面积随去离子水初始温度的增加而增大, 较低的水温使得消化反应速率较小, 因而影响了晶体成核速率[17]。 去离子水的初始温度从20 ℃上升到60 ℃, 比表面积增大不明显, 水温为80 ℃消化得到的Ca(OH)2比表面积为25.379 m2/g, 当水温为90 ℃, Ca(OH)2的比表面积达到最大。
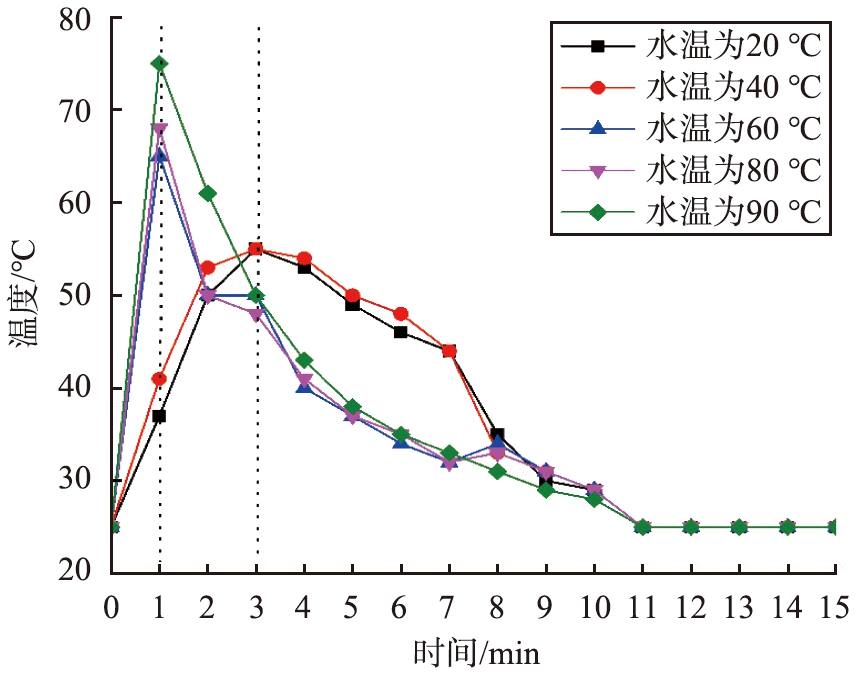
图9 不同去离子水初始温度的消化体系的温度变化
Fig.9 Temperature change of digestion system with different initial temperature of deionized water
表5 不同去离子水初始温度制成的Ca(OH)2比表面积、 比孔容积、 平均孔径
Tab.5 Ca(OH)2 specific surface area, specific pore volume and average pore diameter prepared at different initial temperature of deionized water
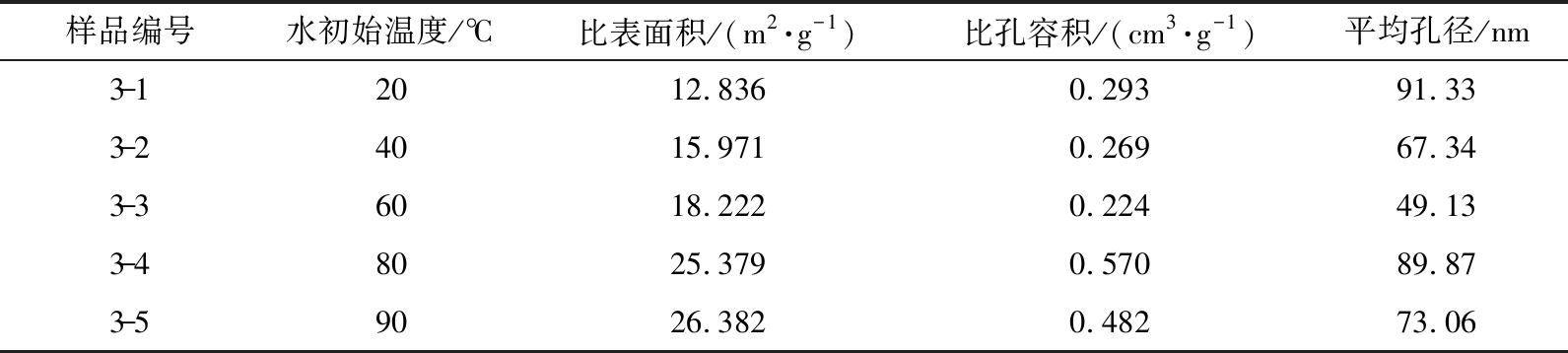
样品编号水初始温度/℃比表面积/(m2·g-1)比孔容积/(cm3·g-1)平均孔径/nm3-12012.8360.29391.333-24015.9710.26967.343-36018.2220.22449.133-48025.3790.57089.873-59026.3820.48273.06
通过激光粒度仪测量5个样品的粒度分布(样品3-1—3-5),如图10所示。d50分别为56.78、 6.69、 3.56、 12.56、 6.69 μm,去离子水温为20 ℃时Ca(OH)2的d50过大,推测水温过低使反应中产生的蒸汽不足以为生石灰消化提供大量热量,颗粒间互相黏结,粒径增大[26]。当去离子水的初始温度提升至40 ℃以上时,消化得到Ca(OH)2的粒度范围明显减小,说明去离子水温的升高有助于石灰消化Ca(OH)2的粒径减小,消化水温的升高,伴随反应过程的放热,消化体系的温度也逐渐升高,使得水分开始气化,蒸汽的膨化作用使生石灰和水的混合物膨胀充分,参与反应的颗粒界面增加[27]。当去离子水的初始温度升至90 ℃时,Ca(OH)2的粒度减小。
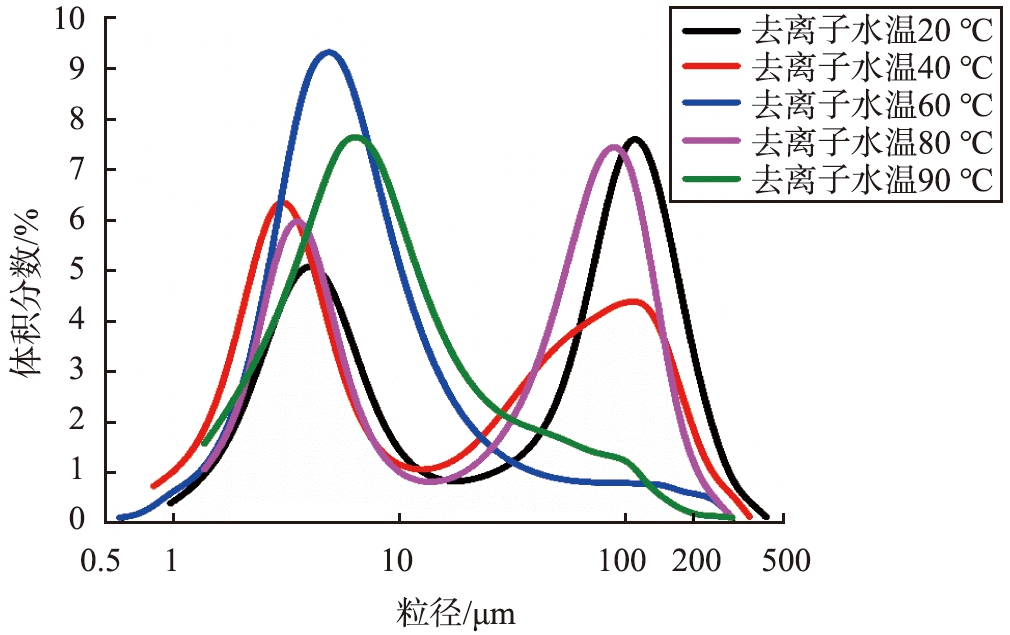
图10 不同去离子水初始温度制成的Ca(OH)2粒度分布
Fig.10 Particle size distribution of Ca(OH)2 prepared at different initial temperature of deionized water
通过X射线衍射仪测量了初始水温为20、 40、 80和90 ℃时所得Ca(OH)2的XRD谱图,如图11所示。Ca(OH)2的晶粒尺寸随水温度的上升呈先减小后增大的趋势, 当水温为80 ℃时, Ca(OH)2的平均晶粒尺寸最小, 为13.8 nm。 水温为40 ℃时检测到衍射角2θ为39.4°时, 出现CaO的特征峰, 说明消化反应不完全, 不同水温下均检测出MgO的(200)晶面特征衍射峰。水温从20~90 ℃变化时,对于(001)、 (100)、 (101)、 (102)、 (110)、 (111)、 (200)、 (201)、 (103)、 (202)晶面影响不大。 在衍射角度2θ为75°~80°处, 不同水温消化得到的Ca(OH)2 (004)、(113)晶面的特征峰较小, 经过与标准卡片的衍射峰对比, 推测水温升高对Ca(OH)2的晶型生长影响较小, 综合考虑Ca(OH)2的比表面积、 粒度分布、 晶型等因素, 选取最佳去离子水的初始温度为90 ℃。
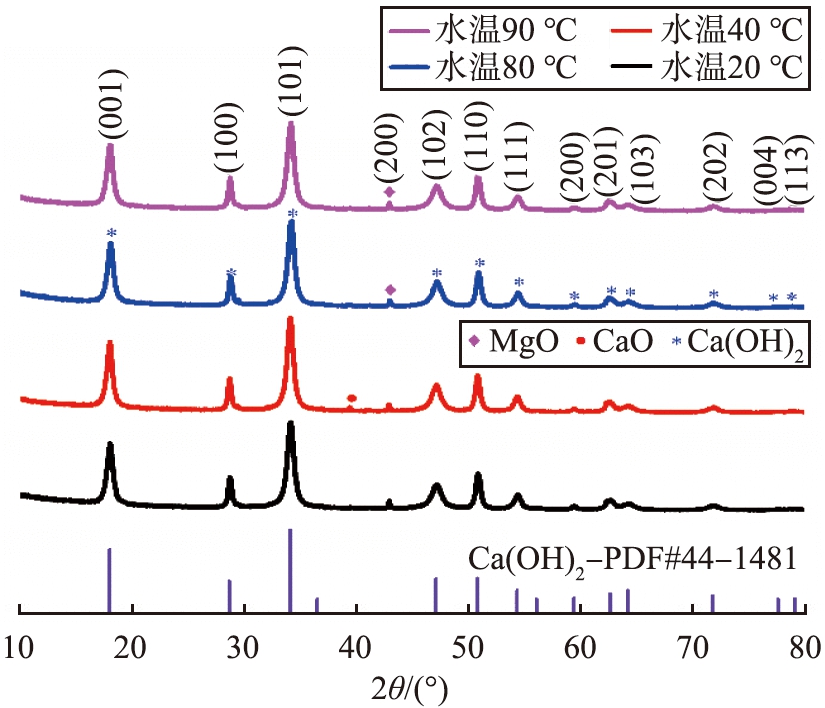
图11 不同去离子水初始温度制成的Ca(OH)2的XRD谱图
Fig.11 XRD patterns of Ca(OH)2 prepared at different initial temperatures of deionized water
2.5 生石灰的初始粒径对Ca(OH)2性能的影响
当其他消化条件相同时(水灰比、 消化时间、 去离子水的初始温度、 搅拌转速),通过比表面积分析仪测量样品4-1、 4-2和4-3的比表面积、 比孔容积和孔径,如表6所示。生石灰的初始粒径越小,反应表面积越大,加快反应产物(Ca2+和OH-)的扩散,同时消化反应放出大量热量,使溶液温度迅速升高,又促进产物的扩散,从而加快了石灰的消化过程[28]。样品经过破碎筛分后, Ca(OH)2的比表面积随着生石灰初始粒径减小而逐渐减小,初始粒径为75~150 μm制成的Ca(OH)2比表面积最大。
表6 不同生石灰初始粒径制成的Ca(OH)2比表面积、 比孔容积、 平均孔径
Tab.6 Ca(OH)2 specific surface area, specific pore volume and average pore diameter prepared from different initial particle sizes of CaO

样品编号生石灰初始粒径/μm比表面积/(m2·g-1)比孔容积/(cm3·g-1)平均孔径/nm4-1>75~15026.3820.48273.064-2>48 ~7523.6840.15753.244-3 38~4821.7040.13531.39
通过激光粒度仪测量3个样品的粒度分布(样品4-1、 样品4-2、 样品4-3),如图12所示。d50分别为6.69、 7.01、 7.15 μm。当样品CaO初始粒径从150 μm减小至38 μm, 制成的Ca(OH)2的d50值随着CaO初始粒径的减小而增大,初始粒径为>75~150 μm的CaO制成的Ca(OH)2特征粒度d50最小,且只有一个体积分数峰值,分布均匀。
通过扫描电镜测量3个样品的谱图(样品4-1、 样品4-2、 样品4-3),如图13所示。在放大倍数为4 000倍时, >75~150、 >48~75和38~48 μm的初始粒径生石灰制成的Ca(OH)2有明显的团聚现象,3种样品的表面均为疏松多孔,石灰在消化过程中,大量放热产生蒸汽冲破熟石灰表面,从而形成了熟石灰多孔疏松状的表面形态,这些微孔提供了较大的比表面积,使Ca(OH)2表面整体呈现一个多孔隙、大比表面积的结构[29]。综合考虑Ca(OH)2的比表面积、 粒度分布、 表面形貌等因素,选取生石灰最佳初始粒径为>75~150 μm。
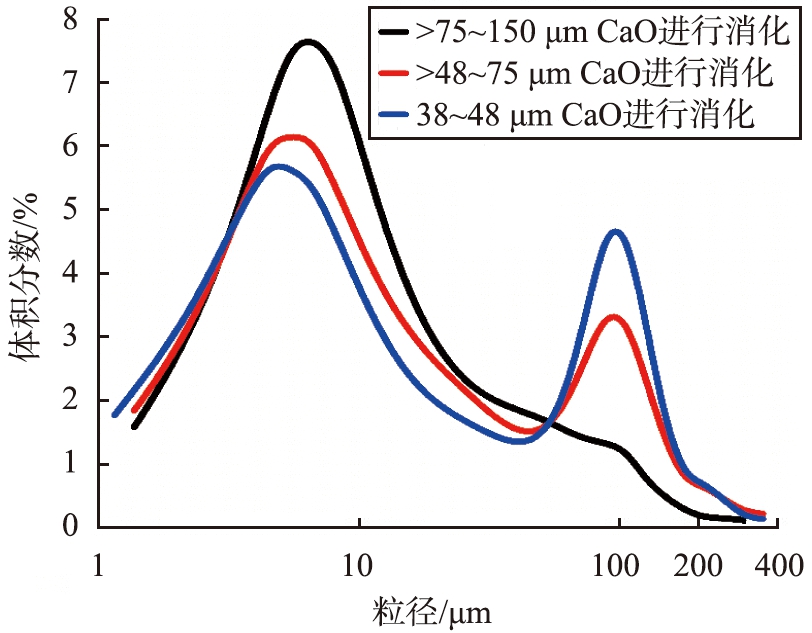
图12 不同生石灰初始粒径制成的Ca(OH)2粒度分布
Fig.12 Particle sizedistribution of Ca(OH)2 prepared with different initial particle sizes of quicklime

(a)>75~150 μm(b)>48~75 μm(c)38~48 μm图13 不同生石灰初始粒径制成的Ca(OH)2扫描电镜图像Fig.13 SEM images of Ca(OH)2 prepared with different initial particle sizes of quicklime
2.6 搅拌转速对Ca(OH)2性能的影响
当其他消化条件相同时(水灰比、 生石灰初始粒径范围、 消化时间、 去离子水的初始温度), 通过比表面积分析仪测量样品5-1—5-5的比表面积、 比孔容积和孔径, 如表7所示。 Ca(OH)2的比表面积随搅拌转速的增加呈先减小后增大的趋势。 在水合反应过程中, 搅拌速度的大小对孔容、 孔径的影响更多的是起到混合扩散的作用[30]。 当搅拌转速从40 r/min增加到60 r/min时, Ca(OH)2的比表面积、 孔容、 孔径减小, 搅拌转速上升至80~100 r/min, 比表面积为23~24 m2/g, 在转速为120 r/min时升至26.382 m2/g。 石灰消化反应会造成颗粒内部和表层体积膨胀破裂, 放出大量热量, 使得Ca(OH)2的颗粒粒径减小, 比表面积增大。
表7 不同搅拌转速制成的Ca(OH)2比表面积、 比孔容积、 平均孔径
Tab.7 Ca(OH)2 specific surface area, specific pore volume and average pore diameter prepared at different stirring speeds
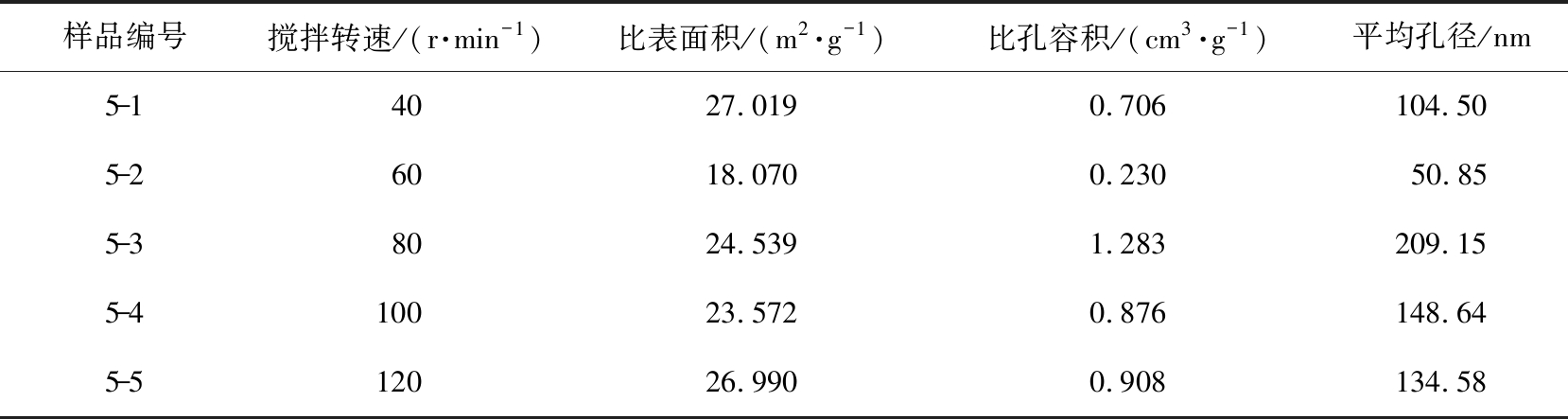
样品编号搅拌转速/(r·min-1)比表面积/(m2·g-1)比孔容积/(cm3·g-1)平均孔径/nm5-14027.0190.706104.505-26018.0700.23050.855-38024.5391.283209.155-4100 23.5720.876148.645-5120 26.9900.908134.58
通过激光粒度仪测量5个样品的粒度分布(样品5-1—5-5), 如图14所示。 当搅拌转速从40 r/min增加到120 r/min时, Ca(OH)2在粒径为10 μm左右的分布更集中,d50分别为10.62、 7.76、 10.13、 7.01、 6.69 μm,说明搅拌转速的提高有助于石灰消化,产生更小的Ca(OH)2粉末。
通过X射线衍射仪测量5个样品的谱图(样品5-1~5-5), 如图15和表8所示。 当搅拌转速从40 r/min增加到120 r/min时, Ca(OH)2的含量增大,消化更完全,晶粒尺寸先增加后减小。由图可知,样品5-1、 5-2、 5-3在衍射角度2θ为32.2°和37.3°处仍有CaO的特征衍射峰,说明低搅拌转速对石灰消化反应不利,搅拌不均匀导致反应后残留氧化钙,随着搅拌转速的增大到100 r/min时,未出现氧化钙的特征峰。综合考虑Ca(OH)2的比表面积、 粒度分布、 晶型等因素,选取最佳搅拌转速为120 r/min。
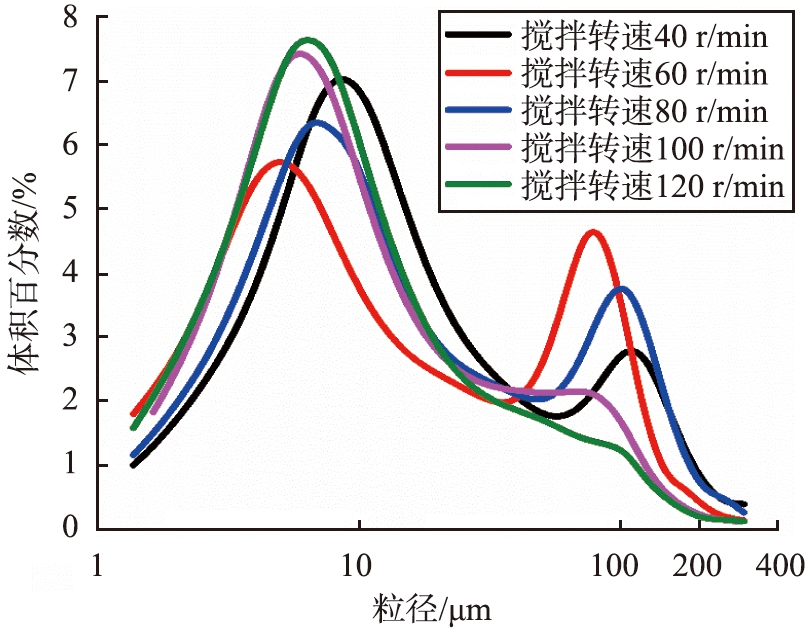
图14 不同搅拌转速制成的Ca(OH)2粒度分布
Fig.14 Particle size distribution of Ca(OH)2 prepared at different stirring speeds
表8 不同搅拌转速对Ca(OH)2晶型的影响
Tab.8 Effect of different stirring speeds on Ca(OH)2 crystal form
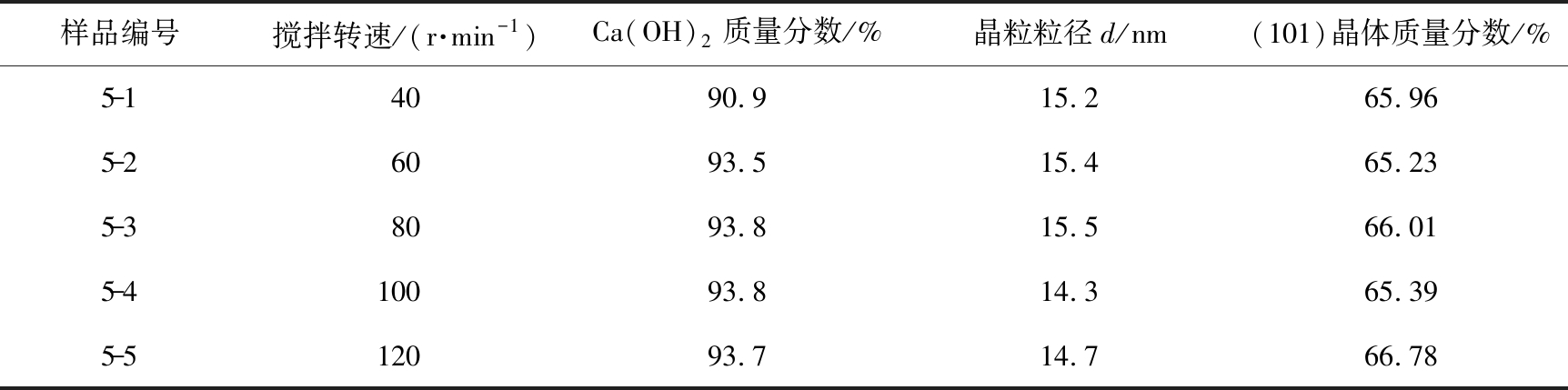
样品编号搅拌转速/(r·min-1)Ca(OH)2质量分数/%晶粒粒径d/nm(101)晶体质量分数/%5-14090.915.265.965-26093.515.465.235-38093.815.566.015-4100 93.814.365.395-5120 93.714.766.78
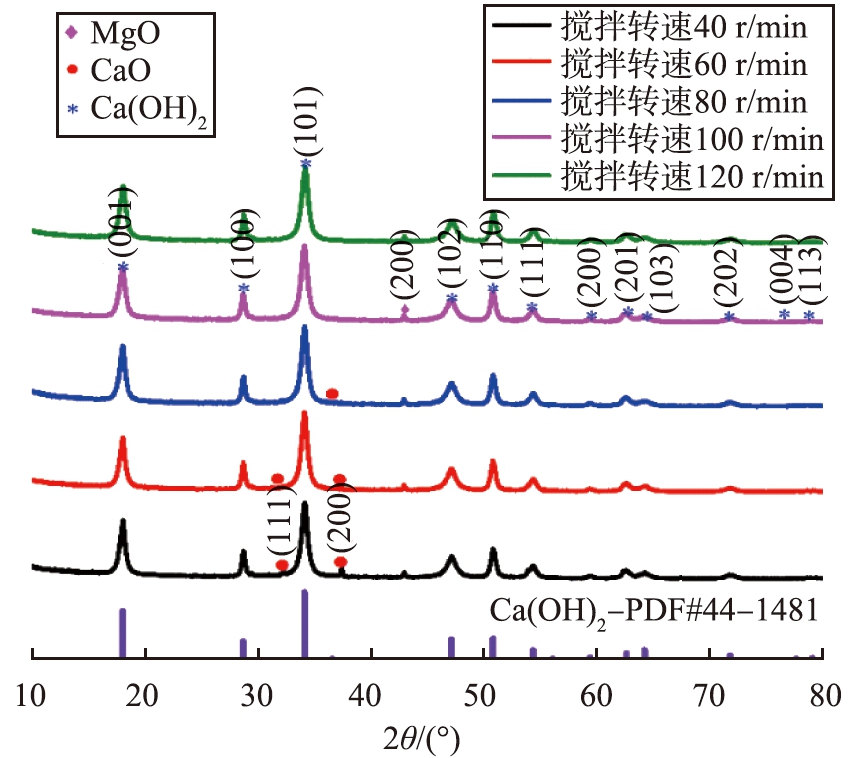
图15 不同搅拌转速制成的Ca(OH)2的XRD谱图
Fig.15 XRD patterns of Ca(OH)2 prepared at different stirring speeds
3 讨论
以高比表面积Ca(OH)2作为研究对象,依靠比表面积、粒度分布、晶型、表面形貌测试等表征手段,系统研究不同消化条件的水灰比、消化时间、去离子水的初始温度、生石灰粒径、搅拌转速等因素对高比表Ca(OH)2性能的影响,是对现有石灰消化条件对高比表Ca(OH)2性能研究体系的有力补充,在一定程度上弥补了现有研究的不足,同时也能为高比表Ca(OH)2的生产提供参考依据。研究结果表明: 1)在自制消化装置中,加入添加剂对工业级石灰进行调质,制成的Ca(OH)2具有高比表面积和疏松多孔及晶粒小的特点; 2)不同的消化条件对高比表Ca(OH)2的性能影响均不同,其中,水灰比的升高有助于石灰消化放热,提高消化体系温度;消化时间为15 min时,Ca(OH)2的粒径明显减小,平均晶粒尺寸最小;去离子水的初始温度对Ca(OH)2的比表面积影响最大,水初始温度的升高加快了生石灰的消化反应速度;生石灰的粒径对高比表Ca(OH)2的性能影响较小;低搅拌转速导致搅拌不均匀,反应后残留氧化钙。
与已有研究成果[14-16]相比,我们采用了成本更低的工业级生石灰作为原料,在石灰消化过程中加入一定剂量的添加剂,更为全面地研究了石灰消化条件对高比表Ca(OH)2性能的影响,得到了高比表Ca(OH)2最优的制备条件。
接下来需进一步研究: 1)对本实验制备出的高比表面积的Ca(OH)2进行脱硫性能测试; 2)对添加剂影响石灰消化过程进行深入分析,并寻找更多成本低廉的添加剂,优化高比表面积Ca(OH)2的性能,同时对三级工业石灰消化器进行改造,从而实现高比表面积Ca(OH)2的工业生产。
4 结论
结合比表面积、 粒度分布、 晶型及表面形貌分析,本实验制成的Ca(OH)2具有高比表面积和疏松多孔及晶粒小的特点。
1)水灰比的升高有助于石灰消化放热,提高消化体系温度。随着水灰比的增加,Ca(OH)2的比表面积先增加后减小,d50和晶粒尺寸先减小后增加。
2)当消化时间从5 min延长至15 min时,Ca(OH)2的比表面积最大,粒径明显减小,平均晶粒尺寸最小。
3)去离子水初始温度的升高加快了生石灰的消化反应速度, 温升增大。 当去离子水的初始温度从20 ℃上升到90 ℃时, Ca(OH)2比表面积达到最大, 粒度减小, 但水温升高对Ca(OH)2的晶型生长影响较小。
4)Ca(OH)2的比表面积随着生石灰初始粒径的减小而逐渐减小, 形成多孔疏松状的表面形态。 Ca(OH)2的比表面积随搅拌转速的增加呈先减小后增大的趋势, Ca(OH)2的粒度随搅拌转速的增加而减小,XRD谱图表明,低搅拌转速对石灰消化反应不利,搅拌不均匀导致反应后残留氧化钙。
5)当水灰比为0.6、 消化时间为15 min、 去离子水的初始温度为90 ℃、 生石灰的初始粒径为75~150 μm、 搅拌速度为120 r/min时, 石灰消化产物Ca(OH)2的比表面积为26.990 m2/g, 比孔容积为0.908 cm3/g。
[1]MARUYAMA A, KUROSAWA R, RYU J. Effect of lithium compound addition on the dehydration and hydration of calcium hydroxide as a chemical heat storage material[J]. ACS Omega, 2020, 5(17): 9820-9829.
[2]GAUTAM R K, SINGH A K, TIWARI I. Nanoscale layered double hydroxide modified hybrid nanomaterials for wastewater treatment: a review[J]. Journal of Molecular Liquids, 2022, 350: 118505.
[3]DAL POZZO A, MORICONE R, ANTONIONI G, et al. Hydrogen chloride removal from flue gas by low-temperature reaction with calcium hydroxide[J]. Energy &Fuels, 2018, 32(1): 747-756.
[4]周昭志, 池涌, 汤元君, 等. 钙基添加剂对生活垃圾热解过程含氯污染物排放的影响[J]. 现代化工, 2020, 40(9): 121-125.
ZHOU Z Z, CHI Y, TANG Y J, et al .Effect of calcium-based additives on emission of chlorine-containing contaminants during MSW pyrolysis[J]. Modern Chemical Industry, 2020, 40(9): 121-125.
[5]EL BAKKARI M, BINDIGANAVILE V, BOLUK Y. Facile synthesis of calcium hydroxide nanoparticles onto TEMPO-oxidized cellulose nanofibers for heritage conservation[J]. ACS Omega, 2019, 4(24): 20606-20611.
[6]MOHAMMADI Z, DUMMER P M H. Properties and applications of calcium hydroxide in endodontics and dental traumatology[J]. International Endodontic Journal, 2011, 44(8): 697-730.
[7]侯瑞琴, 杜玉成, 刘铮, 等. 纳米氢氧化钙颗粒制备、 表征及NOx捕获性能研究[J]. 非金属矿, 2010, 33(5): 5-7, 12.
HOU R Q, DU Y C, LIU Z, et al. Study on preparation and characterization of nano-Ca(OH)2 and its adsorption performance to NOX[J]. Non-Metallic Mines, 2010, 33(5): 5-7, 12.
[8]RENEDO M J, FERN NDEZ-FERRERAS J. Characterization and behavior of modified calcium-hydroxide-based sorbents in a dry desulfurization process[J]. Energy &Fuels, 2016, 30(8): 6350-6354.
NDEZ-FERRERAS J. Characterization and behavior of modified calcium-hydroxide-based sorbents in a dry desulfurization process[J]. Energy &Fuels, 2016, 30(8): 6350-6354.
[9]YAN J, YUAN W, LIU J, et al. An integrated process of chemical precipitation and sulfate reduction for treatment of flue gas desulphurization wastewater from coal-fired power plant[J]. Journal of Cleaner Production, 2019, 228: 63-72.
[10]FERN NDEZ I, GAREA A, IRABIEN A. SO2 reaction with Ca(OH)2 at medium temperatures (300~425 ℃): kinetic behaviour[J]. Chemical Engineering Science, 1998, 53(10): 1869-1881.
NDEZ I, GAREA A, IRABIEN A. SO2 reaction with Ca(OH)2 at medium temperatures (300~425 ℃): kinetic behaviour[J]. Chemical Engineering Science, 1998, 53(10): 1869-1881.
[11]GAREA A, HERRERA J L, MARQUES J A, et al. Kinetics of dry flue gas desulfurization at low temperatures using Ca(OH)2: competitive reactions of sulfation and carbonation[J]. Chemical Engineering Science, 2001, 56(4): 1387-1393.
[12]CHEN L, STEHOUWER R, TONG X, et al. Surface coal mine land reclamation using a dry flue gas desulfurization product: short-term and long-term water responses[J]. Chemosphere, 2015, 134: 459-465.
[13]SALEHI E, EIDI B, SOLEIMANI Z. An integrated process consisting of Mg(OH)2-impregnated ceramic foam filters as adsorbent and Mg(OH)2 as scrubbing solution for intensified desulfurization of flue gas[J]. Separation and Purification Technology, 2019, 216: 34-42.
[14]卢丽君, 方宏辉, 吴英. 生石灰干式消化工艺优化实验研究[J]. 武钢技术, 2014, 52(2): 33-36.
LU L J, FANG H H, WU Y. Experimental study of the dry lime digestion process optimization[J]. Wisco Technology, 2014, 52(2): 33-36.
[15]薛健, 高翔, 刘海蛟, 等. 石灰干式消化过程参数对消化产物特性影响的实验研究[J]. 能源工程, 2006(4): 44-48.
XUE J, GAO X, LIU H J, et al. An experimental study of the effect of hydration procedure parameters of lime dry hydration on hydration production’s properties[J]. Energy Engineering, 2006(4): 44-48.
[16]谷丽, 刘润静, 郭志伟. 石灰消化条件对氢氧化钙活性的影响[J]. 中国粉体技术, 2012, 18(4): 62-65, 69.
GU L, LIU R J, GUO Z W. Effect of lime slaking conditions on activity of calcium hydroxide[J]. China Powder Science and Technology, 2012, 18(4): 62-65, 69.
[17]魏仁零, 吴晓琴, 陈云, 等. 石灰干式消化工艺参数优化选择[J]. 武汉科技大学学报, 2011, 34(6): 473-477.
WEI R L,WU X Q, CHEN Y, et al. Selection and optimzation of technological parameters for dry slaking of quicklime[J]. Journal of Wuhan University of Science and Technology, 2011, 34(6): 473-477.
[18]马跃强, 易红宏, 唐晓龙, 等. 生石灰消化特性及其对SDA法烟气脱硫性能的研究[J]. 现代化工, 2018, 38(3): 169-172.
MA Y Q, YI H H, TANG X L, et al. Hydration characteristics of quicklime and its performance in flue gas desulfurization by SDA method[J]. Modern Chemical Industry, 2018, 38(3): 169-172.
[19]中国建筑材料联合会. 建材用石灰石、 生石灰和熟石灰化学分析方法: GB/T 5762—2012[S]. 北京: 中国标准出版社, 2013.
China Building Materials Federation. Methods for chemical analysis of limestone, quicklime and hydrated lime for building materials industry: GB/T 5762—2012[S].Beijing: China Standards Press, 2013
[20]国家能源局. 干法烟气脱硫用生石灰的活性测定方法: DL/T323—2010[S]. 北京: 中国电力出版社, 2011.
National Energy Administration. Measurement method for activity of quicklime used in dry flue gas desulfurization: DL/T323—2010[S]. Beijing: China Electric Power Press, 2011.
[21]钟伟飞. 石灰消化工艺参数及氢氧化钙溶解速率实验研究[D]. 杭州: 浙江大学, 2004.
ZHONG W F. Experimental study of operating parameters of lime slaking process and dissolution rate of calcium hydroxide[D]. Hangzhou: Zhengjiang University, 2004.
[22]SALVADORI B, DEI L. Synthesis of Ca(OH)2 nanoparticles from diols[J]. Langmuir, 2001, 17(8): 2371-2374.
[23]L HMUS H, R
HMUS H, R NI A, KALLAVUS U, et al. A trend to the production of calcium hydroxide and precipitated calcium carbonate with defined properties[J]. The Canadian Journal of Chemical Engineering, 2002, 80(5): 911-919.
NI A, KALLAVUS U, et al. A trend to the production of calcium hydroxide and precipitated calcium carbonate with defined properties[J]. The Canadian Journal of Chemical Engineering, 2002, 80(5): 911-919.
[24]滕斌, 高翔, 刘海蛟, 等. 消化过程参数对脱硫剂颗粒特性影响的试验研究[J]. 燃烧科学与技术, 2003(6): 529-534.
TENG B, GAO X, LIU H J, et al. Experimental study of the effect of hydration procedure parameters on desulfurizer’s structural properties[J]. Journal of Combustion Science and Technology, 2003(6): 529-534.
[25]SHI H, ZHAO Y, LI W. Effects of temperature on the hydration characteristics of free lime[J]. Cement and Concrete Research, 2002, 32(5): 789-793.
[26]XU M, HUAI X, CAI J. Agglomeration behavior of calcium hydroxide/calcium oxide as thermochemical heat storage material: a reactive molecular dynamics study[J]. The Journal of Physical Chemistry C, 2017, 121(5): 3025-3033.
[27]梁宝瑞, 宋存义, 赵荣志, 等. 基于密相半干法脱硫工艺的生石灰消化及改性[J]. 环境工程学报, 2013, 7(2): 673-678.
LIANG B R, SONG C Y, ZHAO R Z, et al. Digestion and modification of lime based on dense semi-dry desulfurization process[J]. Chinese Journal of Environmental Engineering, 2013, 7(2): 673-678.
[28]钟伟飞, 吴忠标. 石灰消化工艺的研究与优化[J]. 环境污染与防治, 2004(6): 424-436.
ZHONG W F, WU Z B. Study and optimization of lime slaking technology[J]. Environmental Pollution &Control, 2004(6): 424-436.
[29]郝志飞, 张印民, 张永锋, 等. 湿法改性制备高比表面积氢氧化钙及表征[J]. 无机盐工业, 2015, 47(12): 19-21.
HAO Z F, ZHANG Y M, ZHANG Y F, et al. Wet modified preparation and characterization of calcium hydroxide with high specific surface area[J]. Inorganic Chemicals Industry, 2015, 47(12): 19-21.
[30]冀文亮. 高钙粉煤灰/Ca(OH)2水合对脱硫剂性能影响的研究[D]. 昆明: 昆明理工大学, 2013.
JI W L. Study on the effect of high calcium fly ash/Ca(OH)2 hydration on the performance of desulfurization agent[D]. Kunming:Kunming University of Science and Technology, 2013.