多肽药物药理活性好,药效专一性高,毒副作用小,在治疗疾病时具有良好的应用前景[1-2],然而,多肽药物存在易被酶降解、 半衰期短、 稳定性弱、 组织屏障通透性差等不足,造成在临床应用上生物利用率低、 给药频繁、 患者依从性低等问题[3-5]。 纳米缓释制剂能够提高药物组织的滞留性和屏障穿透性,延长药物的作用时间,进而改善多肽药物存在的问题,是多肽药物制剂研发的重点方向[6-8]。
人血清白蛋白(human serum albumin, HSA)是人体血浆中含量最丰富的蛋白,由585个氨基酸构成,半衰期约为19 d,具有安全无毒、 生物相容性好、 低免疫原性等优点,是理想的药物载体[9-10]。人血清白蛋白纳米颗粒(HSA-NPs)的制备方法有反溶剂法、 自组装法、 乳化法、 凝胶法、 纳米喷雾干燥法和纳米白蛋白结合技术法等。反溶剂法通过向HSA溶液中添加反溶剂来降低HSA的溶解度,使HSA从水相脱溶、析出而获得纳米颗粒,工艺简单,制备的颗粒粒径较小,相较于其他方法具有明显的优势[11-13]。
将HSA制备成纳米载体并与多肽药物结合,能显著提高多肽药物在体内的稳定性及活性,避免过早被机体降解清除,延长体内的释放与作用时间[14-16]。此外,临床研究表明,HSA与奥曲肽(octreotide, OCT)等多肽药物联合用药,能够发挥更优的治疗效果[17]。目前,以HSA为载体负载多肽药物的纳米缓释药剂研究尚处于起步阶段。
本文中利用乙醇-水反溶剂法制备HSA-NPs,比较不同交联剂的交联性能,探讨白蛋白质量浓度、 醇水体积比、 脱溶温度、 溶剂pH、 交联时间等工艺参数对HSA-NPs性能的影响,获得制备HSA-NPs的优选工艺参数;选取OCT作为多肽模型药物,通过浸渍吸附-冷冻干燥法构建HSA-OCT微粉制剂,初步探索制剂的药物负载与释放效应,为研发OCT及多肽药物缓释制剂提供研究基础。
1 实验
1.1 试剂材料
药物:人血清白蛋白(HSA,质量分数为99%,上海吉至生化科技有限公司); 奥曲肽(OCT,质量分数为99.1%,批号为2018053003-1,浙江湃肽生物有限公司)。
交联剂:戊二醛溶液(体积分数为50%,上海麦克林生化科技有限公司); 1, 6-己二异氰酸酯(体积分数为99%,北京百灵威公司); 1-乙基-(3-二甲基氨基丙基)碳二亚胺盐酸盐(EDC)、 京尼平(质量分数为98%、 上海阿拉丁生化科技股份有限公司); 葡萄糖(分析纯,北京化工厂)。
其他试剂: 无水乙醇、 氢氧化钠、 盐酸(分析纯,北京化工厂); 乙腈、 高氯酸(色谱纯,德国Merck公司); PBS缓冲液(pH为7.4)(武汉赛维尔生物科技有限公司)。
1.2 颗粒制备
1.2.1 白蛋白纳米颗粒
称取适量HSA, 溶于pH为3~11的水溶液中(用质量分数为0.1%的氢氧化钠和盐酸溶液调节), 配成质量浓度为5、 10、 20、 50 g/L的HSA溶液; 以转速为500 r/min进行搅拌, 分别按醇水体积比为1∶1、 2∶1、 2.5∶1、 3∶1、 4∶1、 6∶1、 8∶1向HSA溶液中加入反溶剂无水乙醇; 待溶液出现蓝色乳光, 加入交联剂, 反应时间分别为3、 6、 12、 24 h, 最后旋转蒸发除去乙醇, 得到胶体溶液; 将胶体溶液在转速为18 000 r/min条件下离心处理20 min, 并用纯水洗涤, 利用LGJ-18型真空冷冻干燥仪(北京松源华兴科技公司)冻干得到HSA-NPs冻干粉。
1.2.2 白蛋白-奥曲肽微粉制剂
采用浸渍吸附-冷冻干燥法制备白蛋白-奥曲肽微粉制剂。取50 mg冻干后的HSA-NPs,加入30 mL质量浓度为3.33 g/L的OCT溶液, 在室温条件下以转速为500 r/min搅拌12 h, 得到载有OCT的HSA-NPs混悬液; 最后将混悬液进行离心处理除去上清液, 冻干后得HSA-OCT微粉制剂。
1.3 颗粒表征
利用BT-90+型动态光散射纳米激光粒度仪(丹东百特仪器有限公司)测量HSA-NPs的粒径和多分散指数(PDI), 对比不同时间点平均粒径和PDI的变化情况, 研究纳米颗粒的储存稳定性; 采用ZS90型纳米粒度电位仪(英国马尔文仪器有限公司)测量HSA-NPs的Zeta电势; 使用SU8020型扫描电镜(日本Hitachi公司)观察HSA-NPs冻干粉和HSA-OCT微粉制剂的微观形貌。
1.4 白蛋白颗粒的综合评价方法
运用Z分综合评价法,从颗粒的性能、工艺稳定性2个方面筛选最优工艺条件。颗粒性能以平均粒径小、 PDI值低为优;工艺稳定性用多次实验所得平均粒径和PDI值的相对标准偏差(RSD)值表示,RSD值越小工艺越稳定。将各指标的Z分等权相加得到Z分,Z分越大评价结果越优。单个指标的Z分的计算公式为
(1)
式中: Xi为测试值;![]() 为全部数据的平均值;S为标准偏差。
为全部数据的平均值;S为标准偏差。
1.5 白蛋白-奥曲肽微粉制剂的评价方法
1.5.1 载药量测定
采用1260型高效液相色谱法(美国Agilent公司)测定HSA-NPs中OCT的质量浓度。色谱柱Eclipse plus C18尺寸为φ4.6 mm×250 mm(直径×长度), 色谱柱内的填料间孔径为5 μm, 检测波长为210 nm, 柱温为25 ℃; 流动相中, 乙腈与质量分数为0.25%的高氯酸水溶液的体积比为30∶70,流量为1 mL/min,待检测溶液的进样体积为5 μL[18]。
取一定质量的HSA-OCT制剂置于离心管,加入纯水溶解后超声处理40 min并静置一段时间,通过分析溶液中OCT的质量浓度测定载药量。
1.5.2 药物体外释放性能的测定
药物体外释放性能参照药物体外溶出度进行评定[19]。 取一定质量的HSA-OCT微粉制剂装入透析袋, 加入PBS溶液至充盈透析袋, 保证药物制剂完全润湿; 扎紧透析袋两端并浸没在100 mL(溶出介质总体积)的PBS溶液中, 将装有全部溶出介质容器置于磁力搅拌机上, 在37 ℃恒温条件下以转速为100 r/min进行搅拌。 按照设定的时间节点, 每次取出1 mL溶出介质后再补充1 mL新鲜介质, 分析溶出介质中OCT的质量浓度。 HSA-OCT微粉制剂的累计溶出度Q的计算公式为
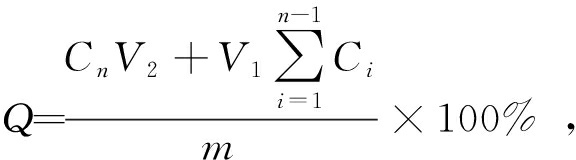
(2)
式中: Ci和Cn分别为第i次和第n次最终取样时OCT的质量浓度, g/L; m为OCT溶出总质量, mg; V1为每个时间节点取出的溶出介质体积, mL; V2为溶出介质总体积, mL。
2 结果与讨论
2.1 交联剂的选择
HSA分子含有大量的极性基团,从水相脱溶析出的HSA-NPs不稳定,易复溶转为水相或团聚成大颗粒[20-21]。交联剂能连接HSA分子,稳定HSA-NPs。目前,HSA的交联主要针对HSA游离的59个氨基[22]。
作为交联剂的京尼平、 葡萄糖、 1, 6-己二异氰酸酯和戊二醛均能与HSA表面游离的氨基反应,交联剂的加入质量为交联HSA分子表面59个氨基理论所需质量的100%。在交联过程中,EDC主要发挥活化HSA表面羧基、促使羧基与氨基偶联的催化作用。结合文献[23-24]和预实验结果,EDC加入量为交联HSA分子表面59个氨基理论所需量的10%,进一步提高EDC加入量会导致HSA分子过度交联产生沉淀。
取1 mL质量浓度为10 g/L的HSA溶液, 搅拌状态下加入2 mL无水乙醇, 交联时间设为3 h, 不同交联剂对HSA-NPs性能的影响如图1所示。 由图1(a)可见, 刚制备的HSA-NPs粒径差距不大, 均小于200 nm; 储存时间为10、 20 d以后, 未添加交联剂或使用葡萄糖、 京尼平的HSA-NPs粒径明显增大, 平均粒径大于750 nm, 添加交联剂EDC、 1, 6-己二异氰酸酯、 戊二醛的HSA-NPs粒径未有明显变化。 由图1(b)可见, 未添加交联剂或使用葡萄糖、 京尼平作为交联剂制备的颗粒的PDI值超过了0.25, 说明粒径均一性较差, 添加交联剂EDC、 1, 6-己二异氰酸酯、 戊二醛的HSA-NPs粒径均一性较好。
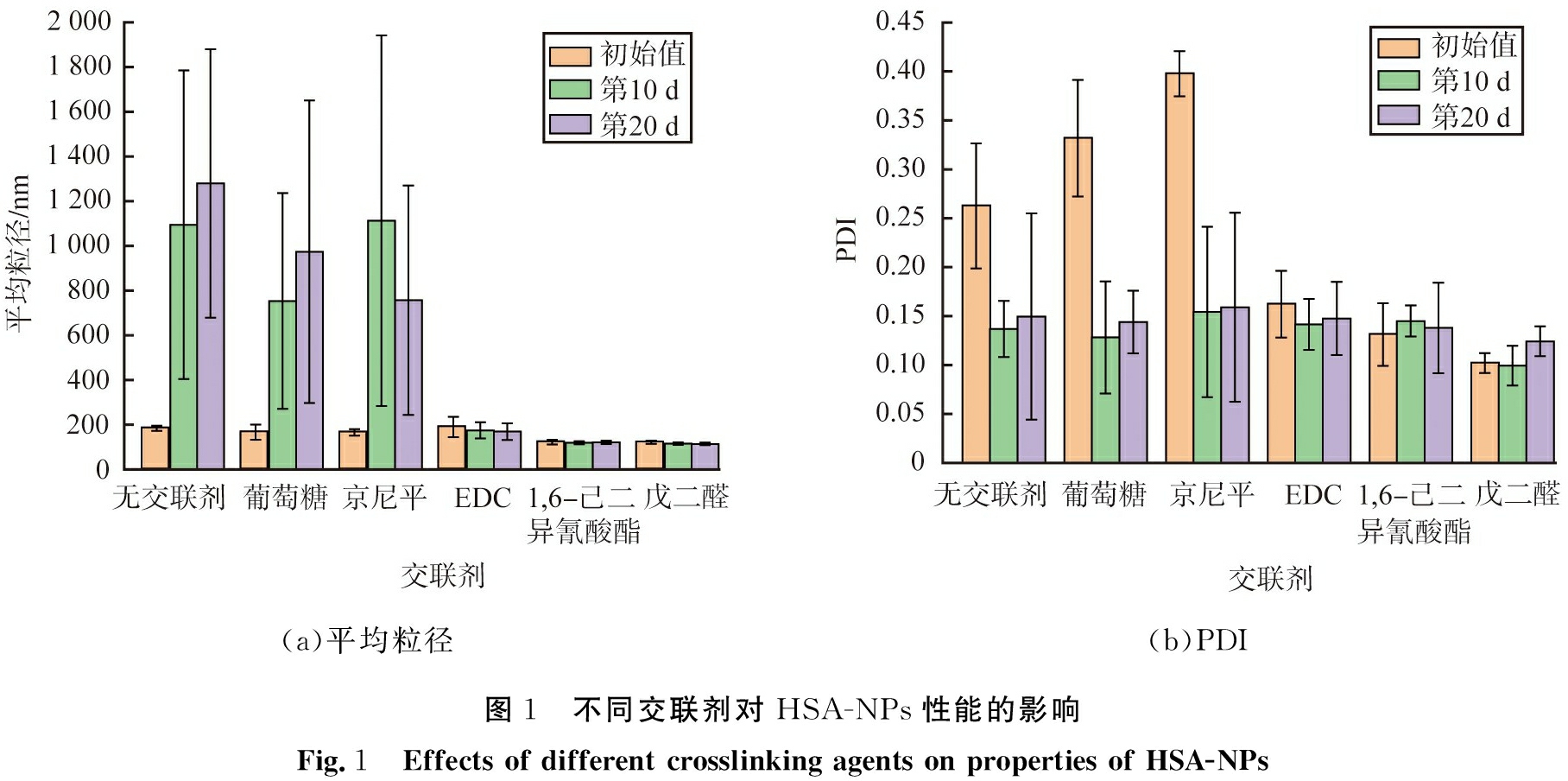
(a)平均粒径(b)PDI图1 不同交联剂对HSA-NPs性能的影响Fig.1 Effects of different crosslinking agents on properties of HSA-NPs
储存10 d后不同交联剂制得的HSA-NPs的SEM图像见图2。由图(a)—(c)可知,未添加交联剂或使用葡萄糖、京尼平作为交联剂制备的HSA-NPs颗粒之间有明显得团聚现象;图(e)、 (f)分别为使用1, 6-己二异氰酸酯和戊二醛制备的HSA-NPs颗粒,由图可知纳米颗粒呈圆球状且具有较好的分散性; 图(d)为EDC制备的HSA-NPs颗粒,对比发现颗粒之间存在一定程度的团聚,但团聚程度弱于未添加交联剂或使用葡萄糖、 京尼平作所制备的颗粒。

(a)无交联剂(b)葡萄糖(c)京尼平(d)EDC(e)1, 6-己二异氰酸酯(f)戊二醛图2 储存10 d后不同交联剂制得的HSA-NPs的SEM图像Fig.2 SEM images of HSA-NPs prepared with different crosslinking agents after storage for 10 days
反溶剂法制备HSA-NPs的实质是HSA分子从水相均相成核、 长大的过程。由于纳米颗粒表面能的增大,因此该过程还伴随着颗粒的团聚现象。交联剂不改变HSA溶液的过饱和度,因此,颗粒的粒径及稳定性由团聚倾向决定。HSA的等电点为4.8[25],当HSA处于非等点状态时,其表面会附带同种电荷。同种电荷数量越多,颗粒之间排斥力越强,就越能抵消颗粒团聚倾向,使颗粒保持稳定。交联剂能通过改变纳米颗粒表面的电荷量影响颗粒的粒径、 分散性和稳定性。纳米颗粒均带负电荷,不同交联剂制得的HSA-NPs的Zeta电势绝对值如图3所示。由图可见,未交联或使用葡萄糖、 京尼平交联后HSA-NPs的Zeta电势较小,颗粒附带的电荷量较少,颗粒间排斥力弱,因此不稳定,易团聚;因为不稳定的颗粒易在交联剂的作用下形成更大的颗粒,使颗粒粒径分布更宽,所以葡萄糖、 京尼平交联后的颗粒PDI值更大,粒径均一性更差;1, 6-己二异氰酸酯和戊二醛交联的纳米颗粒Zeta电势较大,颗粒具有较多的同种电荷,排斥力较强,没有团聚现象,制备的HSA-NPs性能较好;EDC交联的纳米颗粒Zeta电势处于中间状态,颗粒的电荷量介于二者之间,制备的HSA-NPs存在一定程度的团聚现象。
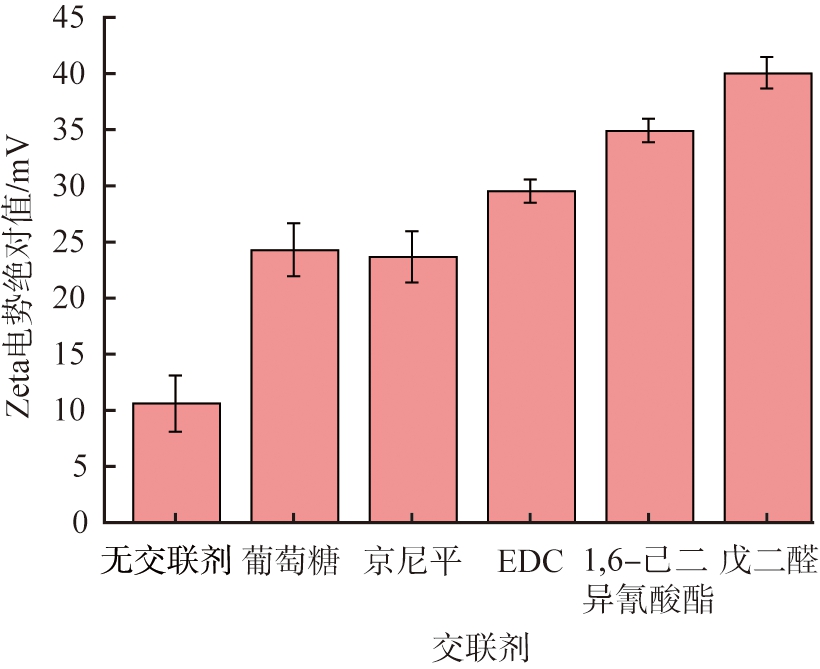
图3 不同交联剂制得的HSA-NPs的Zeta电势
Fig.3 Zeta potential of HSA-NPs prepared with different crosslinking agents
表1为不同交联剂制得的HSA-NPs的Z分评价结果。由表可以看出,EDC、 戊二醛、 1, 6-己二异氰酸酯作为交联剂制备的HSA-NPs的平均粒径分别为(190.0±19.45)、 (121.7±4.70)、 (122.9±7.1) nm, PDI值分别为0.13±17.18、 0.13±8.14、 0.13±19.85;Z分分别为-4.34、 -4.34、 0.40;戊二醛交联的HSA-NPs纳米颗粒的平均粒径、 PDI值和工艺稳定性均较好,说明Z分最大的戊二醛为优选交联剂。葡萄糖、 京尼平的交联能力较差,不纳入评价。
表1 不同交联剂制得的HSA-NPs的Z分评价结果
Tab.1 Z-score evaluation of HSA-NPs prepared with different crosslinking agents
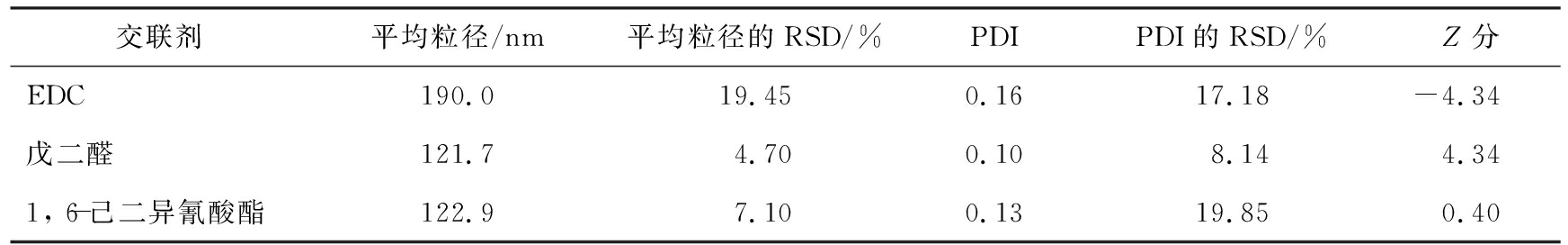
交联剂平均粒径/nm平均粒径的RSD/%PDIPDI的RSD/%Z分EDC190.019.450.1617.18-4.34 戊二醛121.74.700.108.144.341, 6-己二异氰酸酯122.97.100.1319.850.40
2.2 白蛋白纳米颗粒的优选工艺参数
2.2.1 白蛋白质量浓度
以戊二醛作为交联剂, 设定醇水体积比为2∶1, 交联时间为3 h, pH为7, 脱溶温度为20 ℃, HSA质量浓度对HSA-NPs性能的影响如图4所示。 由图可知, 随着HSA质量浓度的增加, HSA-NPs纳米颗粒的粒径逐渐减小, PDI值先减小后增大, 各项工艺参数的Z分则先增大后减小; 当HSA的质量浓度为10 g/L时, Z分最大为0.88,因此,根据Z分评价结果, HSA的优选质量浓度为10 g/L。
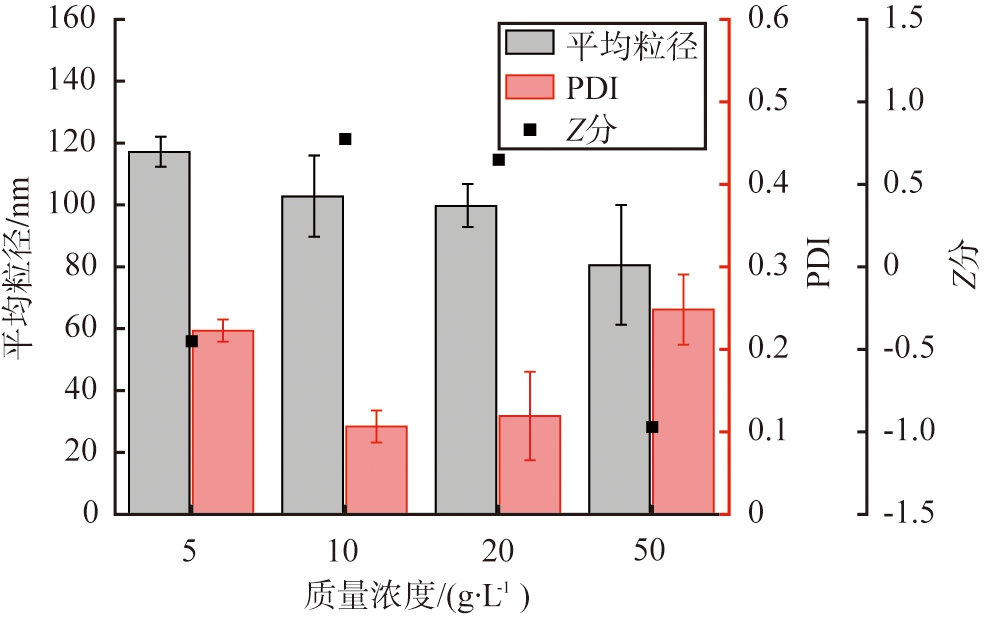
图4 HSA的质量浓度对HSA-NPs性能的影响
Fig.4 Effect of HSA mass concentration on HSA-NPs performance
根据液相均匀成核理论,颗粒的成核、 生长速率是影响粒径及其分布的主要因素。质量浓度大的HSA溶液具有较大的过饱和度,颗粒成核、 生长速率快,所得纳米颗粒小,因此HSA-NPs的平均粒径随HSA质量浓度的增大而逐渐减小;另一方面,质量浓度大的HSA溶液生成的颗粒较多,颗粒之间更易碰撞、 团聚,同时由于溶液的黏度较大,降低了HSA分子在水和乙醇之间的扩散速率,因此HSA-NPs的粒径分布较宽,PDI值较大。对于质量浓度较小的HSA溶液,颗粒成核、 生长速率较慢,所需脱溶反应时间较长,使得纳米颗粒的粒径分布同样不均匀,适中的成核速率能保证颗粒的粒径及其分布均较优。
2.2.2 醇水体积比
以戊二醛作为交联剂, 设定交联时间为3 h, pH为7, 脱溶温度为20 ℃, HSA质量浓度为10 g/L, 醇水体积比对HSA-NPs性能的影响如图5所示。 由图可以看出, 当醇水体积比为1∶1时纳米颗粒平均粒径为(267.56±11.3) nm, PDI值为0.19±21.8; 醇水体积比为2∶1、 2.5∶1、 8∶1时,能获得较小的平均粒径,分别为(102.9±7.9)、 (86.9±24.6)、 (107.7±15.25) nm, 醇水体积比为2.5∶1、 8∶1时制备的纳米颗粒的PDI值大于0.25。 醇水体积比为3∶1、 4∶1、 6∶1时平均粒径超过了1 200 nm, 颗粒的性能较差, 不纳入Z分计算范围。 当醇水体积比为2∶1时, Z分最大为1.54, 因此, 根据Z分评价结果, HSA-NPs的优选醇水体积比为2∶1。
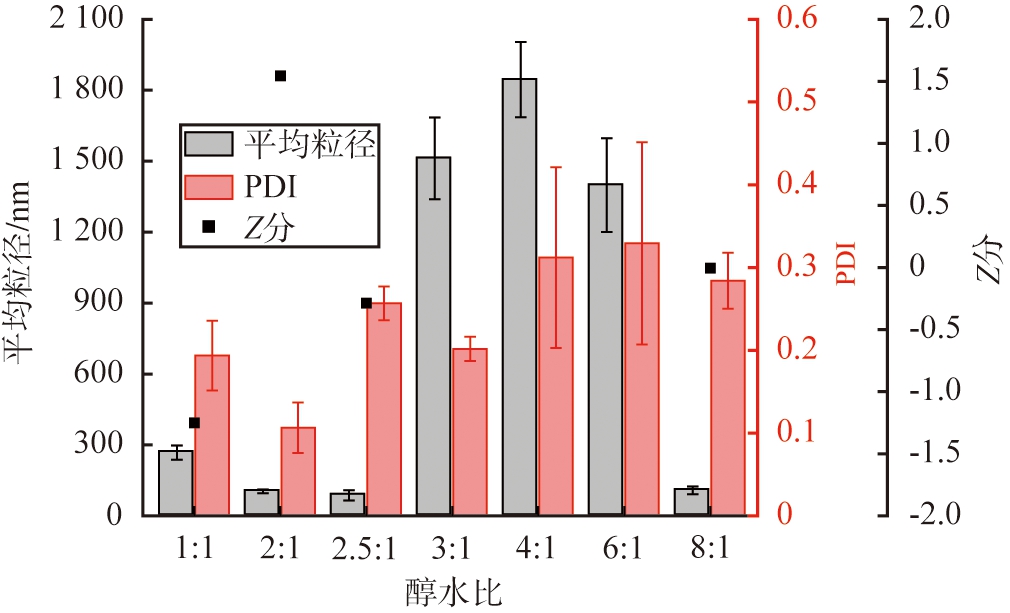
图5 醇水体积比对HSA-NPs性能的影响
Fig.5 Effects of volumn ratio of alcohol to water on HSA-NPs performance
醇水体积比会改变溶液的过饱和度, 从而影响体系内颗粒的粒径、 分布情况, 不同醇水体积比制备的HSA-NPs粒径分布如图6所示。 由图可见, 醇水体积比为1∶1时, 溶液产生的过饱和度较低, 颗粒成核、 生长速率慢, 制备的颗粒粒径为100~500 nm,由于溶剂体积小,颗粒间易碰撞发生团聚,因此体系中还存在大于1 000 nm的大颗粒;醇水体积比为2∶1时,过饱和度有明显提高,此时生成的纳米颗粒粒径为50~250 nm,粒径分布较为集中;随着醇水体积比进一步的增大,溶液产生的过饱和度逐渐增大,能生成更细小的粒径小于50 nm颗粒,但小颗粒团聚倾向大,使得颗粒呈多种分散状态;醇水体积比为2.5∶1时,开始存在明显的团聚现象,制备的颗粒粒径为15~700 nm,因为体系内小颗粒数量较多,所以HSA-NPs的平均粒径小,但粒径分布宽,PDI值大;醇水体积比达到4∶1时,颗粒的团聚倾向最大,体系存在大量的大颗粒;继续增加醇水体积比,溶液中产生的过饱和度趋于恒定,但溶剂体积逐渐增大,降低了颗粒碰撞、 团聚的概率,因此颗粒的粒径有所减小;当醇水体积比为8∶1时,团聚倾向明显减弱,体系中只存在少量大颗粒。综上,从粒径分布情况来看,当醇水体积比为2∶1时,制备的HSA-NPs颗粒的性能最优。
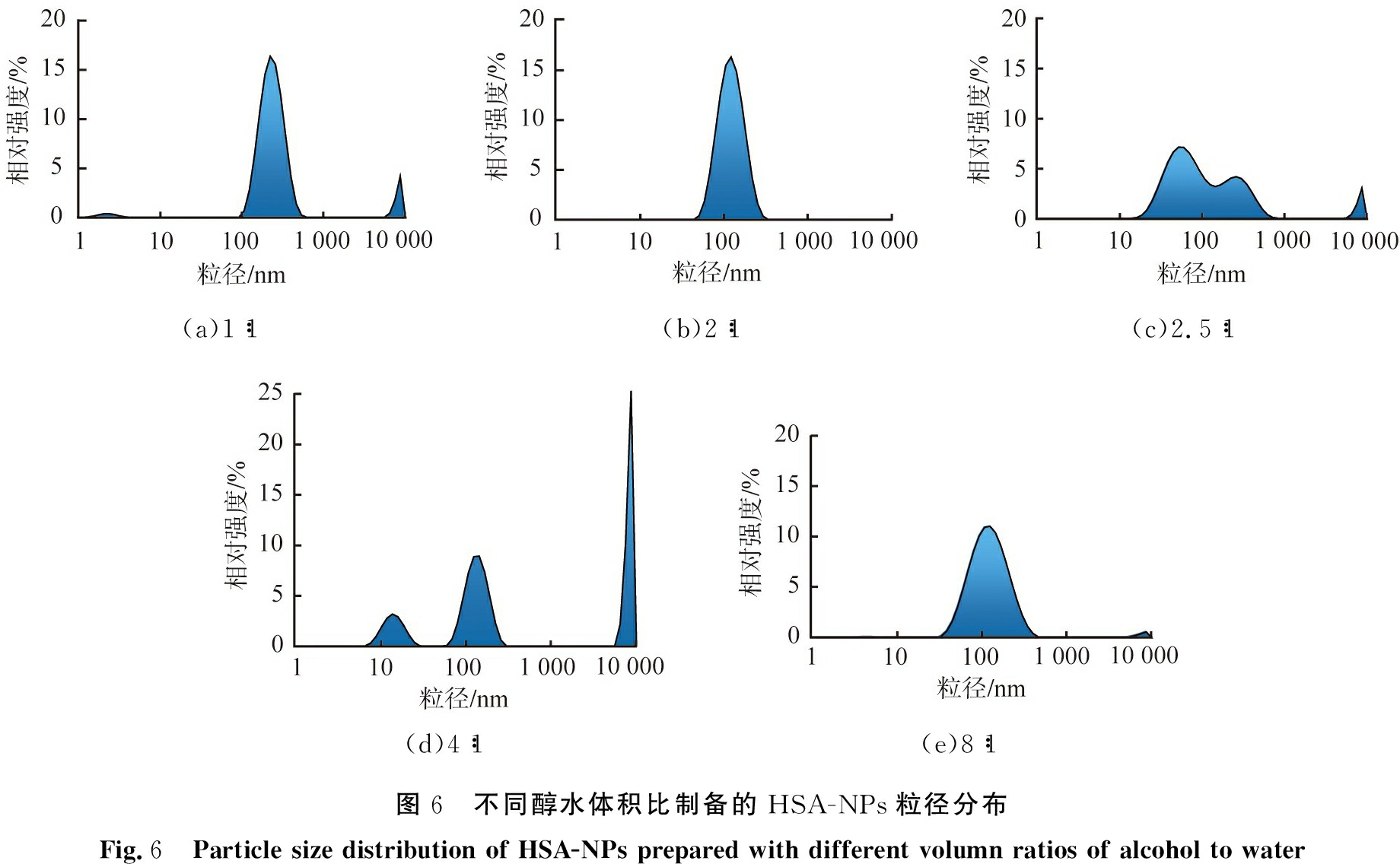
(a)1∶1(b)2∶1(c)2.5∶1(d)4∶1(e)8∶1图6 不同醇水体积比制备的HSA-NPs粒径分布Fig.6 Particle size distribution of HSA-NPs prepared with different volumn ratios of alcohol to water
2.2.3 脱溶温度
以戊二醛作为交联剂,设定交联时间为3 h,pH为7,HSA质量浓度为10 g/L,醇水体积比为2∶1,将HSA溶液进行水浴,脱溶温度对纳米颗粒性能的影响如图7所示。由图可见,当脱溶温度为5 ℃时,纳米颗粒的平均粒径与PDI值均较大;当脱溶温度为10~30 ℃时,随温度的升高,HSA-NPs的平均粒径逐渐增大,PDI值逐渐减小;Z分随着脱溶温度的升高呈现先增大后减小的变化规律;当脱溶温度为20 ℃时,Z分最大为2.68,因此,根据Z分评价结果,HSA-NPs的优选脱溶温度为20 ℃。
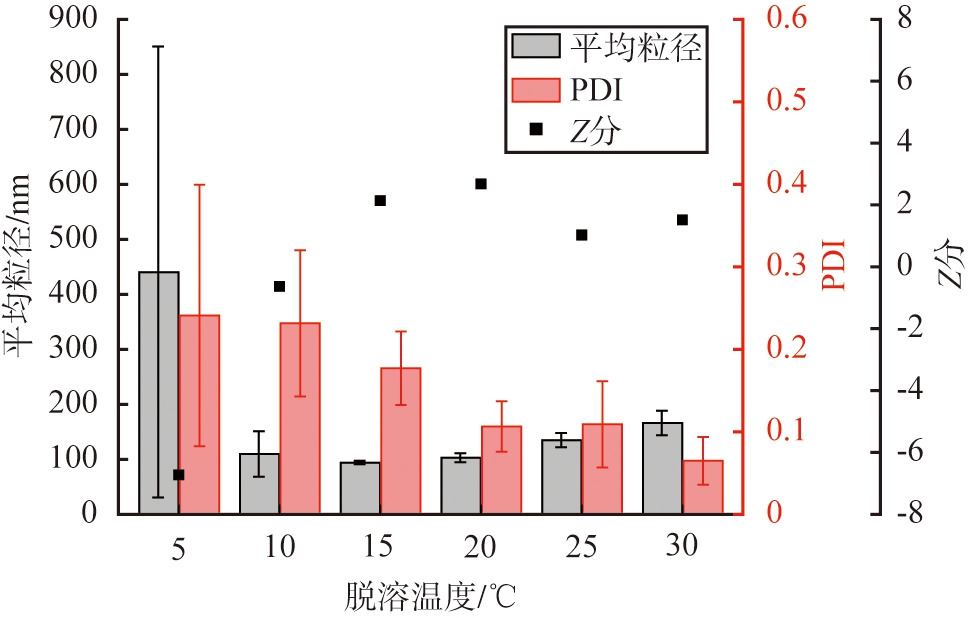
图7 温度对HSA-NPs性能的影响
Fig.7 Effects of temperature on HSA-NPs performance
实验发现,脱溶温度为5 ℃时,溶液未观察到明显的蓝色乳光,表明体系内生成的纳米颗粒数量较少,低温抑制了HSA分子脱溶析出过程。当脱溶温度为10~30 ℃时,HSA分子能正常脱溶析出生成纳米颗粒,一方面,随着脱溶温度的升高,溶液产生的饱和度逐渐降低,体系内颗粒成核与生长速率减缓,使得制备的颗粒平均粒径逐渐增大,温度通过改变HSA的溶解度而直接影响过饱和度;另一方面,温度会影响分子的扩散速率,温度越高分子扩散速率越快,微观混合越充分,制备的颗粒粒径分布就均匀。综上,从温度对HSA的过饱和度和扩散速率的影响来看,优选脱溶温度为20 ℃。
2.2.4 溶剂pH
以戊二醛作为交联剂,设定交联时间为3 h, HSA质量浓度为10 g/L,醇水体积比为2∶1, 脱溶温度为20 ℃时,溶剂pH对HSA-NPs性能的影响如图8所示。由图可见,PDI溶剂pH对PDI的影响不大,说明对纳米颗粒的性能影响较小,颗粒的平均粒径为100~150 nm;溶剂pH为9时,Z分最大为2.25,HSA-NPs的性能和工艺稳定性最佳,因此,根据Z分评价结果,HSA-NPs的优选溶剂pH为9。
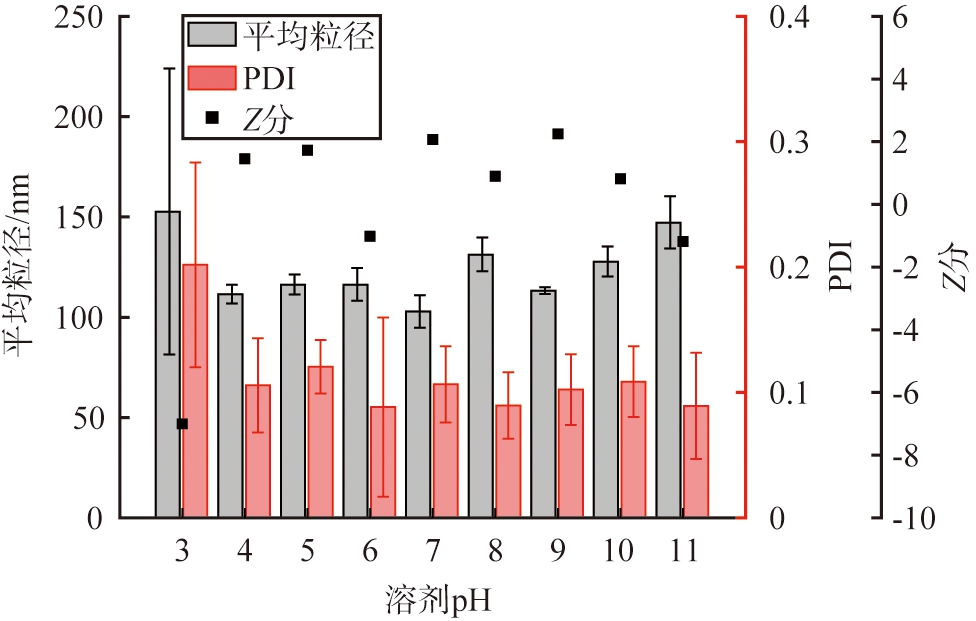
图8 溶剂pH对HSA-NPs性能的影响
Fig.8 Effects of solvent pH on HSA-NPs performance
因为HSA分子在不同pH溶液中带电量不同,所以可以通过调节溶剂pH来改变HSA分子的静电作用, 制备不同粒径的纳米颗粒。然而, HSA分子中的咪唑环(位于16个组氨酸上)以及末端的氨基和羧基能够被质子化, 使其具有一定的酸碱缓冲能力[26], 同时, 调节溶剂pH时引入的离子, 会削弱纳米颗粒之间的静电排斥力[27], 使粒径略大于中性溶液中的颗粒。
2.2.5 交联时间
以戊二醛作为交联剂,设定HSA质量浓度为10 g/L,醇水体积比为2∶1,脱溶温度为20 ℃时, 溶剂pH为9时, 交联时间对HSA-NPs性能的影响如图9所示。 由图可见, 交联时间对颗粒的平均粒径和PDI值影响不大; 不同交联时间下, 颗粒的平均粒径均小于120 nm, 分散性良好。 当交联时间为24 h时, Z分最大为1.52, 因此, 根据Z分评价结果, HSA的优选交联时间为24 h。
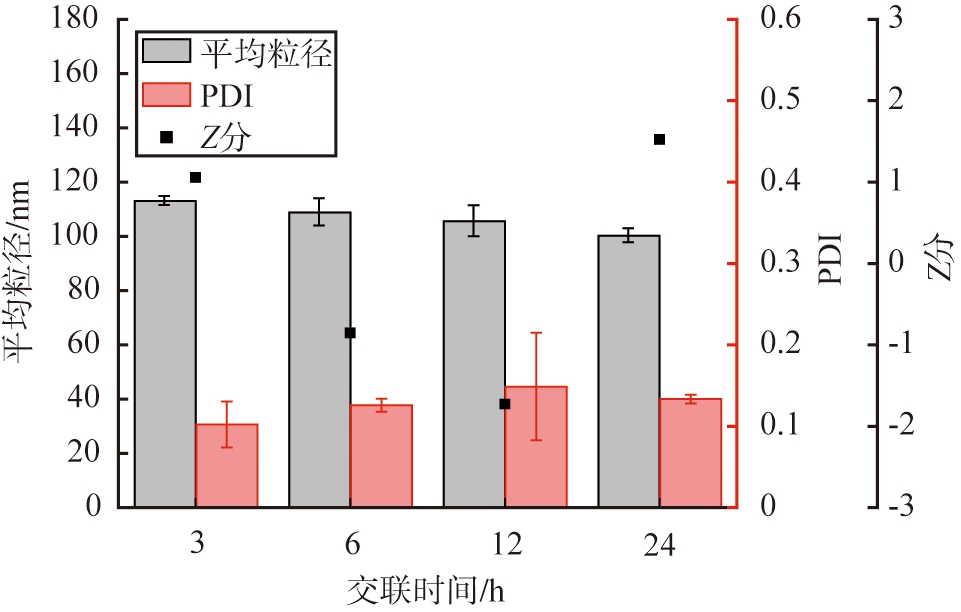
图9 交联时间对HSA-NPs性能的影响
Fig.9 Effects of crosslinking time on HSA-NPs performance
2.2.6 优选工艺条件
综合上述评价结果, 制备HSA-NPs的优选工艺参数为: HSA的质量浓度为10 g/L; 醇水体积比为2∶1; 脱溶温度为20 ℃;溶剂pH为9;交联时间为24 h。在此条件下制备的HSA-NPs工艺稳定性良好,平均粒径为(100.6±2.5) nm, PDI为0.13±0.01。
2.3 纳米颗粒的载药量与体外释放性能
HSA-NPs冻干粉与HSA-OCT制剂的SEM图像如图10所示。由图可以看出,载药前、 后纳米颗粒的形态未发生明显变化,保持为规则的球状形貌,经计算,HSA-OCT微粉制剂的载药量为1.83%。对载药机理进行分析后发现,OCT的等电点为8.2[28],在纯水中OCT分子表面带正电荷,因此能与带负电荷的HSA-NPs发生静电作用,吸附于纳米颗粒表面;同时HSA分子中的α-螺旋形成了较多的网状空隙,为OCT的吸附提供了有利空间。

(a)HSA-NPs冻干粉(b)HSA-OCT制剂图10 HSA-NPs冻干粉与HSA-OCT制剂的SEM图像Fig.10 SEM images of HSA-NPs freeze-dried powder and HSA-OCT preparation
HSA-OCT制剂和OCT原药的累计溶出度随时间的变化曲线如图11。由图可见,OCT原药在累计释放时间为120 min内时累计溶出度达到了90.6%,累计释放时间为480 min后完全溶出;HSA-OCT制剂较OCT原药释放缓慢,有较明显的缓释作用, 药物累计释放时间达到2 160 min, 但时间为0~30 min时却无药物溶出, 可能是因为HSA-NPs的吸附能力较强, 需要经过一定时间后OCT才能释放。
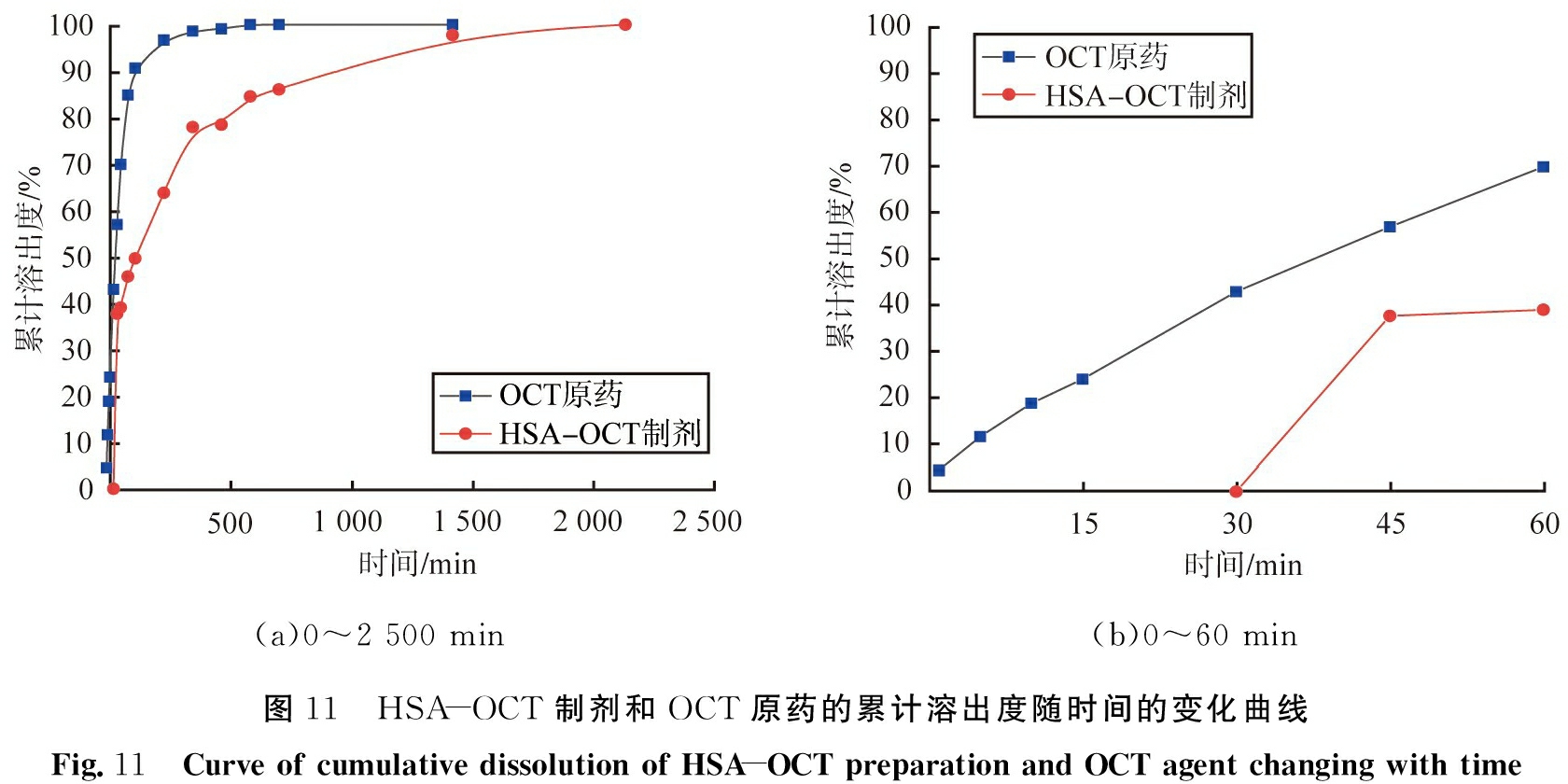
(a)0~2 500 min(b)0~60 min图11 HSA-OCT制剂和OCT原药的累计溶出度随时间的变化曲线Fig.11 Curve of cumulative dissolution of HSA-OCT preparation and OCT agent changing with time
3 结论
本文中采用反溶剂法制备HSA-NPs,对比了不同交联剂的交联性能;研究了白蛋白质量浓度、 醇水体积比、 脱溶温度、 溶剂pH、 交联时间等工艺参数对HSA-NPs性能的影响;运用浸渍吸附-冷冻干燥法构建了HSA-OCT微粉制剂,分析了OCT原药和HSA-OCT微粉制剂的体外缓释性能。
1)交联剂能改变HSA分子表面的静电作用,降低HSA-NPs的团聚倾向,从而稳定固化HSA-NPs。在所选交联剂中,戊二醛交联的HSA-NPs纳米颗粒的性能、工艺稳定性最优,制备的颗粒微观形貌为规则球状,储存稳定性良好。经Z分综合评价戊二醛为优选交联剂。
2)HSA质量浓度、 醇水体积比和脱溶温度对HSA-NPs的性能影响较大。 根据Z分评价结果, 制备HSA-NPs颗粒的优选工艺参数为: HSA质量浓度为10 g/L, 醇水体积比为2∶1, 脱溶温度为20 ℃, 溶剂pH为9, 交联时间为24 h。 在优选工艺参数参数条件下制备的纳米颗粒的平均粒径为(100.6±2.5) nm, PDI为0.13±0.01。
3)载药前后HSA-NPs微观形貌未发生明显变化。相较于OCT原药,HSA-OCT微粉制剂具有明显的缓释效应,持续释药时间为2 160 min,具有较好的体外释放性能。
[1]唐川, 刘俊成, 周兴智, 等. 蛋白多肽类药物载体应用研究进展[J]. 沈阳药科大学学报, 2020, 37(1): 51-56.
[2]CAO S J, LV Z Q, GUO S, et al. An update-prolonging the action of protein and peptide drugs[J]. Journal of Drug Delivery Science and Technology, 2021, 61: 102124.
[3]TONG T, WANG L Y, YOU X R, et al. Nano and microscale delivery platforms for enhanced oral peptide/protein bio-availability[J]. Biomaterials Science, 2020, 21(8): 5804-5823.
[4]丁海波, 金莉莉, 王秋雨. 多肽类药物药代动力学特点及其代谢机制研究进展[J]. 中国药理学与毒理学杂志, 2018, 32(3): 233-240.
[5]丁源, 陈新, 涂家生, 等. 蛋白及多肽类药物长效化制剂学技术研究进展[J]. 中国药科大学学报, 2020, 51(4): 433-440.
[6]LEWIS A L, RICHARD J. Challenges in the delivery of peptide drugs: an industry perspective[J]. Therapeutic Delivery, 2015, 6(2): 149-163.
[7]周建平. 纳米技术在药物递送中的应用与展望[J]. 中国药科大学学报, 2020, 51(4): 379-382.
[8]CHOUDHARY S, WAGHMARE S, KAMBLE H. A review:sustained release dosage form[J]. World Journal of Pharmaceutical Research, 2021, 10(11): 2146-2157.
[9]商宏华, 申有青. 血清白蛋白纳米药物载体的制备及应用[J]. 功能高分子学报, 2013, 26(3): 317-324.
[10]徐欢, 周美玲, 葛琳, 等. 人血清白蛋白在蛋白多肽类药物长效化中的应用[J]. 中国生物工程杂志, 2019, 39(1): 82-89.
[11]KARAMI E, BEHDANI M, KAZEMI-LOMEDASHT F. Albumin nanoparticles as nanocarriers for drug delivery: focusing on antibody and nanobody delivery and albumin-based drugs[J]. Journal of Drug Delivery Science and Technology, 2020, 55: 101471.
[12]常书华. 白蛋白作为药物载体的研究[D]. 济南: 齐鲁工业大学, 2020.
[13]KIANFAR E. Protein nanoparticles in drug delivery: animal protein, plant proteins and protein cages, albumin nanoparticles[J]. Journal of Nanobiotechnology, 2021, 19(1): 159.
[14]SPADA A, EMAMI J, TUSZYNSKI J A, et al. The uniqueness of albumin as a carrier in nanodrug delivery[J]. Molecular Pharmaceutics, 2021, 18(5): 1862-1894.
[15]汤晓雷. 多西他赛白蛋白纳米递药系统的研究[D]. 南京: 南京大学, 2016.
[16]何佳彧, 梁菊, 宣茂松, 等. 提高多肽体内稳定性的有效策略[J]. 药学学报, 2020, 55(1): 25-32.
[17]黄健彬, 魏川, 王安荣. 奥曲肽联合白蛋白治疗重症急性胰腺炎临床疗效观察[J]. 智慧健康, 2020, 5(15): 158-159.
[18]向童欣, 黄永鹏, 唐慧, 等. 高效液相色谱法定量分析奥曲肽[J]. 化学分析计量, 2020, 29(2): 79-82.
[19]国家药典委员会. 中华人民共和国药典(2020版, 第四部)[M]. 北京: 中国医药科技出版社, 2020: 132-141.
[20]李艳, 蓝锦晓, 罗成. 白蛋白纳米颗粒的制备研究进展[J]. 中国生物医学工程学报, 2019, 38(1): 112-119.
[21]龙湘宇. 光催化交联构建用于药物递送的全蛋白质纳米微球[D]. 大连: 大连理工大学, 2019.
[22]WEBER C, KREUTER J, LANGER K. Desolvation process and surface characteristics of HSA-nanoparticles[J]. International Journal of Pharmaceutics, 2000, 196(2): 197-200.
[23]JAHANBAN-ESFAHLAN A, DASTMALCHI S, DAVARAN S. A simple improved desolvation method for the rapid preparation of albumin nanoparticles[J]. International Journal of Biological Macromolecules, 2016, 91: 703-709.
[24]SALEHIABAR M, NOSRATI H, JAVANI E, et al. Production of biological nanoparticles from bovine serum albumin as controlled release carrier for curcumin delivery[J]. International Journal of Biological Macromolecules, 2018, 115: 83-89.
[25]SHI H D, LIN S M, WANG Y, et al. Ruthenium photosensitizer anchored gold nanorod for synergistic photodynamic and photothermal therapy[J]. Dalton Transactions, 2022, 51: 6846-6854.
[26]陈瑶, 孙鹏, 刘买利, 等. 离子对人血清白蛋白影响的1H NMR研究[J]. 波谱学杂志, 2017, 34(3): 266-274.
[27]GALISTEO-GONZ LEZ F, MOLINA-BOL
LEZ F, MOLINA-BOL VAR J A. Systematic study on the preparation of BSA nanoparticles[J]. Colloids and Surfaces B: Biointerfaces, 2014, 123: 286-292.
VAR J A. Systematic study on the preparation of BSA nanoparticles[J]. Colloids and Surfaces B: Biointerfaces, 2014, 123: 286-292.
[28]MAHJUB R, DORKOOSH F A, RAFIEE-TEHRANI M, et al. Oral self-nanoemulsifying peptide drug delivery systems: impact of lipase on drug release[J]. Journal of Microencapsulation, 2015, 32(4): 401-407.