无水碳酸镁(MgCO3)是MgCO3正盐的单晶体,在自然界中主要以菱镁矿形式存在,属于方解石结构,三方晶系。因无水MgCO3具有热分解温度高、吸热量大、分解产生大量二氧化碳(CO2)、 分解产物氧化镁(MgO)活性高、 阻燃等优点,在绝热、 耐高温、 防火保温材料等领域具有极大应用前景[1-4]。同时,无水MgCO3晶体形貌多样、 性价比高,是一种多功能精细无机材料[5-6],常被用作功能陶瓷和碳阳极等材料的添加剂[7-8]、 合成多孔碳等分级结构材料的模板[9-10]、 药物和吸附材料的优良载体[11-13]、 镁合金的细化剂[14-16],以及用作催化剂、 烧结剂、 模板剂、 无机致孔剂等,具有重要的工业应用价值,在新材料领域倍受关注。
王晶等[4]、 Wang等[17]以氯化镁为镁源, 尿素为沉淀剂,柠檬酸钠为添加剂,于温度为180 ℃条件下水热反应24 h,合成了平均粒径为15~20 μm的无规则花状和球状无水MgCO3晶体,但只初步解释了柠檬酸钠作用下晶体形貌演变规律。刘润静等[18]以粒径为200~300 nm氢氧化镁配制成的浆液为镁源,以柠檬酸钾为添加剂,在温度为120~150 ℃、压力为0.3~0.7 MPa的条件下,持续通入CO2气体,水热反应6 h,获得了平均直径为2~4 μm的菱面体块状无水MgCO3晶体,并证实了钾离子对晶体生长具有促进作用,但对原料粒径要求较高。党力等[1]将硫酸镁、尿素、助剂氢氧化钠通过微波加热的方法制得无水MgCO3,该方法可以一步制得形貌规则、尺寸均一的无水MgCO3。
田朋[19]以六水氯化镁和碳酸氢铵为原料合成棒状三水碳酸镁(MgCO3·3H2O)前驱体, 并以MgCO3·3H2O为原料, 通过MgCO3·3H2O和氯化铵(NH4Cl)水热反应制备出无水MgCO3。Kristian等[20]将MgCO3·3H2O与水和乙二醇的混合溶液混合,在温度为150 ℃时通入CO2,制得无水MgCO3,该方法工艺简单,容易操作。王英伟等[21]通过定转子反应器制得超细MgCO3·3H2O,并以此为原料进行水热反应,获得无水MgCO3晶体。沈兴等[22]以轻烧菱镁矿粉和硫酸铵溶液为原料制备硫酸镁,再将硫酸镁与碳酸铵溶液混合,获得中间产物四水碳酸铵镁;低温热解中间产物制得无水MgCO3晶须,该方法采用全循环工艺,产物纯度较高,但制备工艺复杂。Xing等[23]将尿素分别与金属镁粉、氢氧化镁、氯化镁、硫酸镁等不同镁源化合物在温度为160 ℃的条件下进行了持续30 h的水热反应,制得无水MgCO3粉体,但反应时间较长。
目前,国内外关于无水MgCO3晶体的制备主要是以可溶性镁盐和碳酸盐等分析纯化学试剂为原料,存在合成成本高、经济性不强、副产物易引发环境污染等问题。以菱镁矿天然矿物制备无水MgCO3晶体,具有原料来源广泛且成本低的优势,具备工业放大生产的潜力且能极大地提高菱镁矿矿产附加值。MgCO3·3H2O热力学上属亚稳相,常被用于生产碱式碳酸镁(4MgCO3·Mg(OH)2·4H2O)的中间产品[24]。 本文中以菱镁矿为原料制备MgCO3·3H2O晶体,并以此为前驱物合成微纳米级无水MgCO3晶体,探究水热温度、水热时间、固液质量比(m(MgCO3·3H2O)∶m(去离子水))等条件对产物微观形貌和物相组成的影响,并分析NH4Cl辅助下无水MgCO3的形成机理。
1 实验
1.1 主要试剂材料和仪器设备
材料: NH4Cl(天津市大茂化学试剂厂); 轻烧氧化镁粉(辽宁菱镁矿煅烧获得, 化学组成见表1所示。 轻烧氧化镁粉中含有少量TFe、 CaO、 SiO2等杂质, 经后续水化, 碳化和热解等处理, 可除去上述杂质)。
表1 轻烧氧化镁粉的化学组成质量分数
Tab.1 Chemical composition of light burned magnesia powder %

MgOCaOSiO2TFe82.701.507.860.34
仪器设备: UltimaIV型X射线衍射仪(XRD, 日本Rigaku公司); S-3400N型扫描电子显微镜(SEM, 日本日立公司);Better Size2000型激光粒度仪(辽宁丹东百特仪器有限公司)。
1.2 方法
1.2.1 样品表征
使用X射线衍射仪检测样品物相, 辐射源为铜靶Kα, λ=0.154 1 nm, 固体探测器, 管电压为40 kV, 管电流为40 mA,扫描速率为10(°)/min,扫描范围2θ=5°~90°。采用扫描电镜观察喷金处理后产物的微观形貌。采用激光粒度仪检测产物粒度。
1.2.2 中间产物制备
取一定质量的轻烧氧化镁粉(粒径小于74 μm)与水按一定质量比均匀混合,于温度为60 ℃的水浴中水化反应2 h,获得氢氧化镁悬浊液,冷却至5~10 ℃。按一定速率向上述悬浊液中通入CO2,待溶液pH处于7.0~7.5时,停止通气,抽滤,得到澄清重镁水溶液。将所得重镁水溶液于温度为50~55 ℃条件下热解2 h,抽滤,并将滤饼于温度为50 ℃条件下烘干6 h,得到白色粉末MgCO3·3H2O。
1.2.3 中间产物表征

(a)实物照片

(b)SEM图像
图1 自制三水碳酸镁
Fig.1 Self-made nesquehonite
分别采用扫描电镜和激光粒度仪观察自制MgCO3·3H2O微观形貌和粒度分布状况,自制MgCO3·3H2O的实物图和SEM图像如图1所示,粒度分布结果如图2所示。
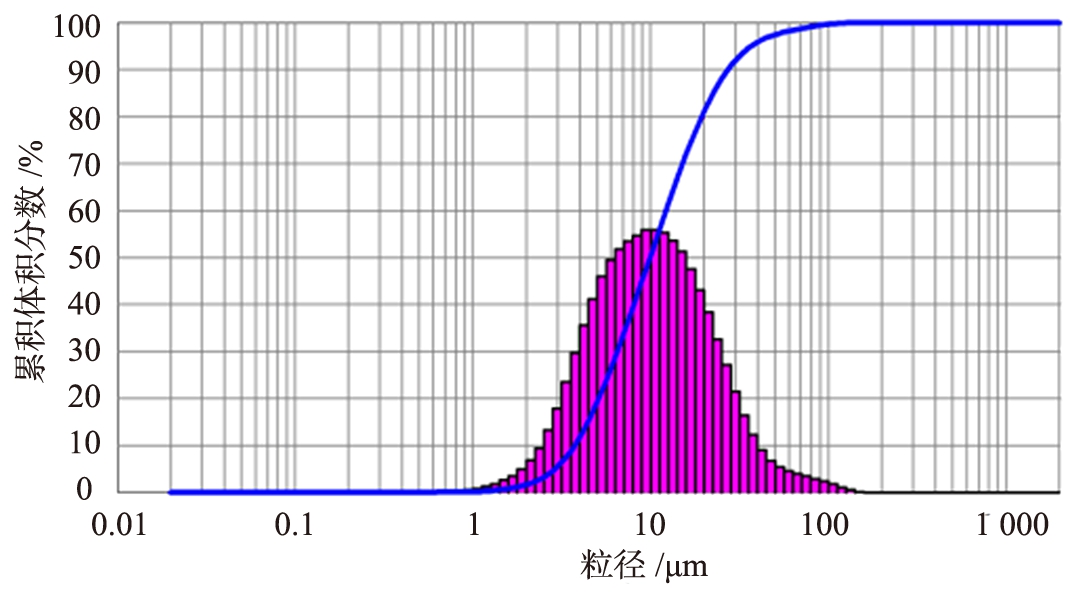
图2 三水碳酸镁粒度分析曲线
Fig.2 Grain size analysis curve of nesquehonite
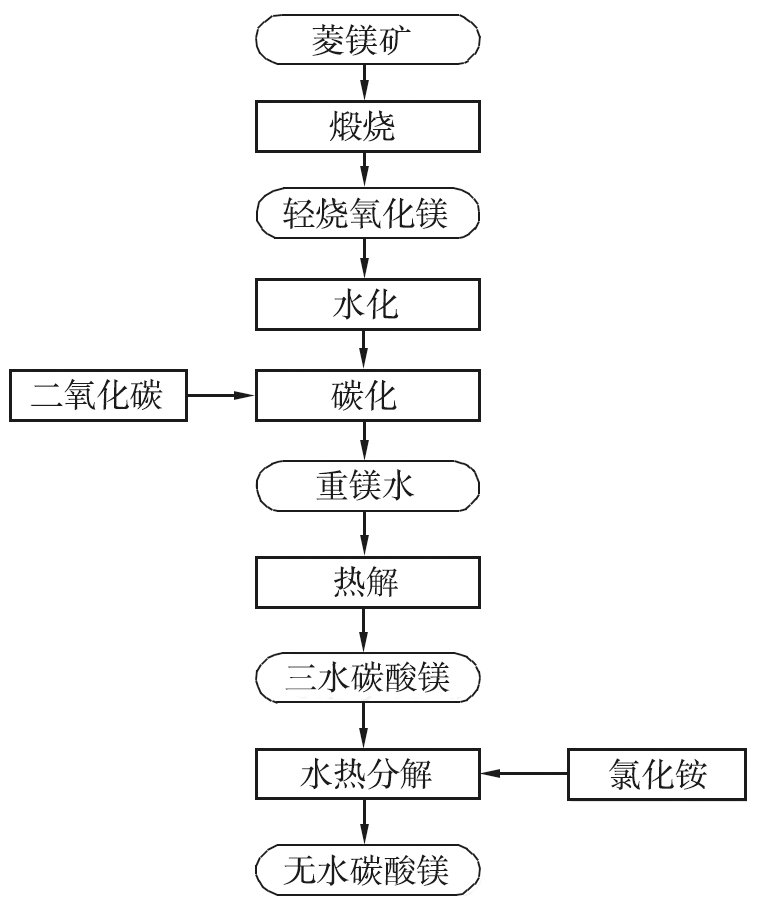
图3 无水碳酸镁的制备工艺流程
Fig.3 Preparation process flow chart of anhydrous magnesium carbonate
如图1、 2所示, 所得中间产物为棒状MgCO3·3H2O晶体, 中位粒径D50为9.941 μm。
1.2.4 无水碳酸镁的制备
取一定量自制MgCO3·3H2O和NH4Cl置于水热釜中,加入去离子水,搅拌溶解,将水热釜于温度为130~210 ℃条件下加热3~11 h,待反应结束冷却至室温,抽滤,洗涤,然后将所得滤饼于温度为80 ℃条件下烘干10 h,获得白色粉末。无水MgCO3的制备工艺流程图如图3所示。
2 结果与讨论
2.1 水热温度的影响
固定MgCO3·3H2O与水的质量比为1∶30,NH4Cl浓度为0.5 mol/L,水热时间为7 h,探究水热温度分别为130、 150、 170、 190、 210 ℃时对产物物相组成和微观形貌的影响,产物的XRD与SEM图像如图4、 5所示。
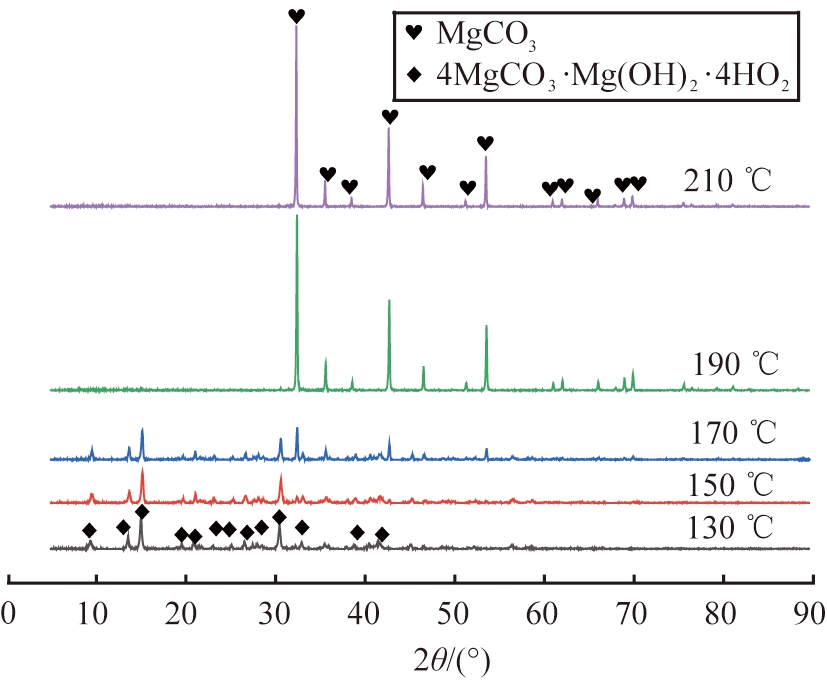
图4 不同水热温度下所得产物的XRD图谱
Fig.4 XRD patterns of products obtained at different hydrothermal temperatures

(a) 130 ℃
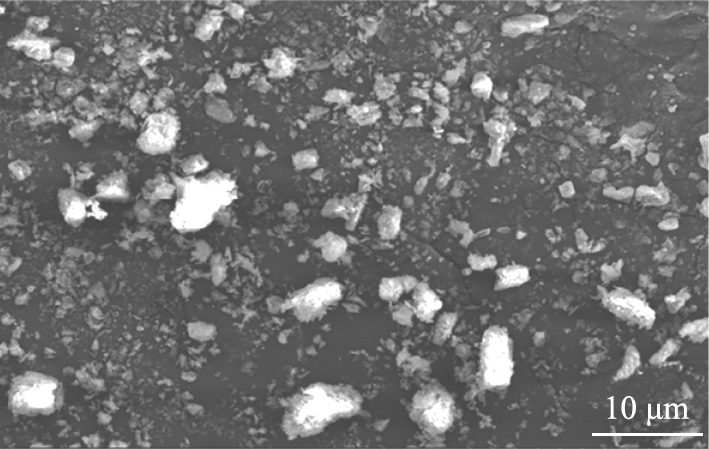
(b) 150 ℃

(c) 170 ℃

(d) 190 ℃

(e) 210 ℃
图像
Fig.5 SEM images of products obtained at different hydrothermal temperatures
由图4可知,水热温度为130 ℃时,产物衍射峰与414型4MgCO3
图谱中出现微弱的无水MgCO3衍射峰。温度继续升高至170 ℃,无水MgCO3衍射峰增强,其中2θ分别为32.63°、 42.99°、 53.88°处的衍射峰与无水MgCO3标准峰(JCPDS 03-0788)对应,表明此时产物为无水MgCO3和4MgCO3·Mg(OH)2·4H2O的混合物。水热温度进一步升高至190~210 ℃时,产物的全部衍射峰与无水MgCO3标准峰(JCPDS 03-0788)一一对应,衍射峰形尖锐,基底平滑,无其他杂质峰存在[25],表明此条件下可获得结晶良好、纯度较高的无水MgCO3晶体。
由图5可知, 水热温度为130 ℃时, 所得产物主要为絮状、 棒状和片状等多形貌4MgCO3·Mg(OH)2·4H2O, 如图5(a)所示。 反应温度升高至150 ℃, 产物中出现了少量菱状无水MgCO3晶体, 如图5(b)所示。 温度继续升高至170 ℃, 产物主要是平均直径约为3~4 μm的立方块状无水MgCO3晶体以及少量碎片状4MgCO3·Mg(OH)2·4H2O晶体, 如图5(c)所示。 温度进一步提高至190 ℃, 产物主要为表面光滑、 分散性良好、 平均直径约4~5 μm的立方体状无水MgCO3晶体, 如图5(d)所示。 水热温度为210 ℃时, 产物全部为表面光滑、 平均直径约为6~7 μm的菱块状无水MgCO3晶体, 如图5(e)所示。
综上可知, 水热温度对产物物相组成、 微观形貌及平均直径具有较大影响。 考虑温度升高带来的能量消耗等, 选择温度为170 ℃探究水热时间和固液比对产物物相组成、 微观形貌和晶体平均直径的影响。
2.2 水热时间的影响
固定MgCO3·3H2O与水的质量比为1∶30, 水热温度为170 ℃,NH4Cl浓度为0.5 mol/L,探究水热时间分别为3、 5、 7、 9、 11 h时对产物物相组成和微观形貌的影响,产物的XRD与SEM图像如图6、 7所示。
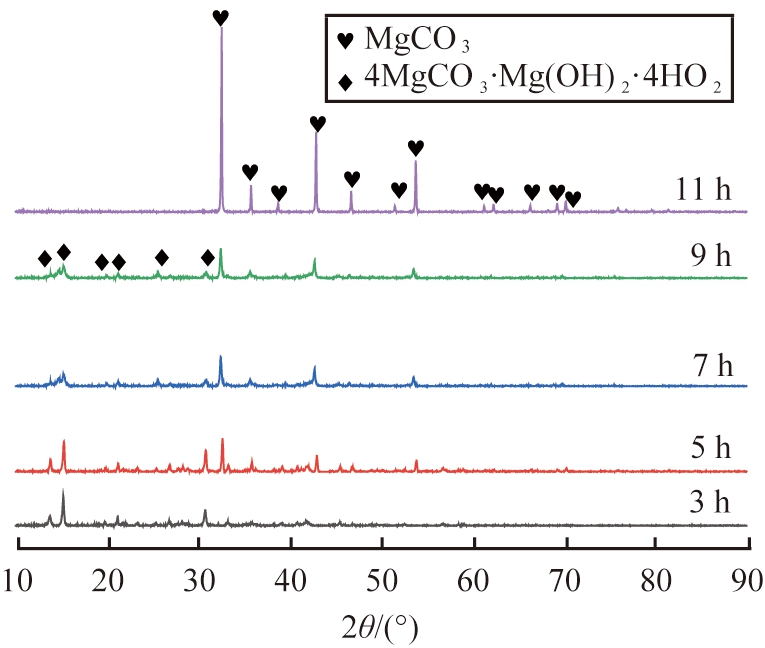
图6 不同水热时间所得产物的XRD图谱
Fig.6 XRD patterns of products obtained at different hydrothermal times
观察图6可知,水热时间为3 h时,产物衍射峰与4MgCO3·Mg(OH)2·4H2O特征峰对应。水热时间为5~9 h时,产物中同时存在4MgCO3·Mg(OH)2·4H2O和无水MgCO3的衍射峰,且随着时间延长,4MgCO3·Mg(OH)2·4H2O衍射峰峰强减弱,无水MgCO3衍射峰增强,表明水热时间延长,4MgCO3·Mg(OH)2·4H2O逐渐转变为无水MgCO3。 继续延长水热时间至11 h,产物衍射峰均与无水MgCO3的标准特征峰一致,峰基底平滑,无其他杂峰,表明所得产物为结晶良好的无水MgCO3晶体。
由图7(a)可知,水热时间为3 h时,产物主要是絮状和颗粒状4MgCO3·Mg(OH)2·4H2O。由图7(b)可知, 水热时间为5 h时,产物中絮状与颗粒状4MgCO3·Mg(OH)2·4H2O减少,出现少量的菱块状无水MgCO3晶体,但晶体分布不均匀,这可能是由于前驱体反应不完全所致。由图7(c)可知,水热时间延长至7 h,产物中菱块状无水MgCO3晶体数量明显增加,平均直径约为4 μm。由图7(d)可知,水热时间进一步延长至9 h时,产物主要为菱块状无水MgCO3晶体。由图7(e)可知,水热时间增加至11 h时,所得无水MgCO3晶体形状均匀,表面光滑,平均直径约为2~5 μm,晶体之间存在少量团聚。

(a) 3 h

(b) 5 h

(c) 7 h

(d) 9 h

(e) 11 h
图像
Fig.7 SEM images of products obtained at different hydrothermal time
综上所述,水热时间对产物物相组成和微观形貌具有重要影响,随着水热时间的延长,产物发生了MgCO3·3H2O—4MgCO3·Mg(OH)2·4H2O—无水MgCO3的相转变。
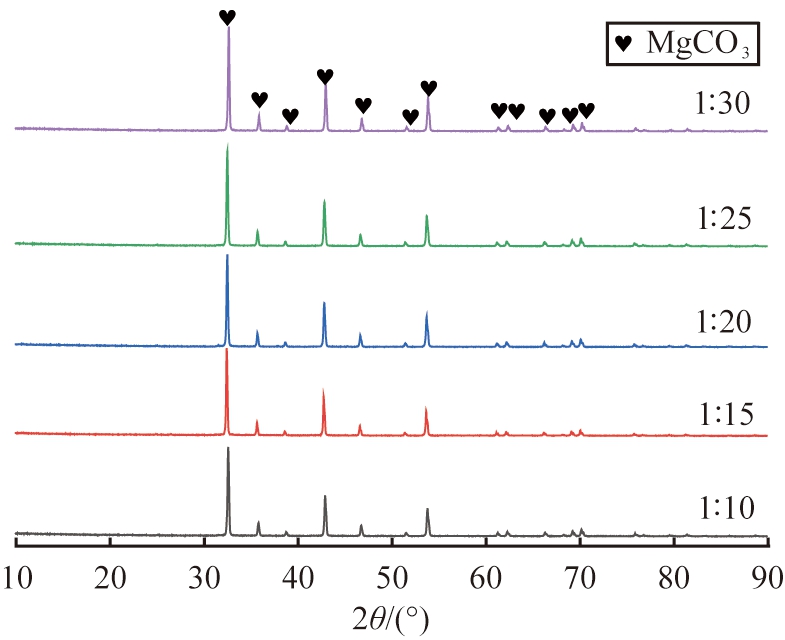
图8 不同固液质量比下所得产物的XRD图谱
Fig.8 XRD patterns of products obtained under different solid-to-liquid mass ratios
2.3 固液质量比的影响
由对水热温度和水热时间讨论结果可知,水热温度为170 ℃、水热时间为9 h时,难以获得单一物相的无水MgCO3。为获得纯度较高的无水MgCO3晶体,水热温度和水热时间保持不变,将添加剂NH4Cl浓度增大至0.75 mol/L,探究固液质量比分别为1∶10、 1∶15、 1∶20、 1∶25、 1∶30时对产物物相组成和微观形貌的影响,产物的XRD与SEM图像如图8、 9所示。
由图8可知,不同固液质量比下所得产物的衍射峰均与无水MgCO3的标准特征峰对应,且基底平滑,峰形尖锐,无其他杂峰,表明所得产物均为结晶良好的无水MgCO3,由此说明固液比对产物物相组成无明显影响。

(a) 1∶10

(b) 1∶15

(c) 1∶20

(d) 1∶25

(e) 1∶30
图像
Fig.9 SEM images of products obtained under different solid-to-liquid ratios
如图9所示,不同固液质量比时所得产物均为表面光滑,形状均匀且平均直径约2~5 μm的菱块状无水MgCO3晶体。以上结果表明,固液质量比的改变对产物物相组成及微观形貌没有明显影响。
2.4 热重分析
将固液质量比为1∶30、 水热温度为170 ℃、 水热时间为9 h、 NH4Cl浓度为0.75 mol/L时所得无水MgCO3进行热重分析,产物热重图如图10所示。
由图10可知,热分解温度低于460 ℃时,样品质量并未明显减少。热分解温度为463~657 ℃时,图中出现了明显的失质量台阶,该阶段失质量分数达62.06%,与理论失质量分数52%有一定偏差。推测产生上述现象的原因为,水热反应中,密闭水热釜因缺乏搅拌作用,导致水热体系传质不均,一定水热时间内,存在少量的未完全参与反应转化为无水MgCO3的MgCO3·3H2O原料。
2.5 形成机理分析
由前述讨论与分析结果可知,三水碳酸镁-氯化铵体系下水热反应主要包括MgCO3·3H2O—4MgCO3·Mg(OH)2·4H2O—无水MgCO3的相转变过程,则反应离子方程式为
5MgCO3·3H2O![]() 4MgCO3·Mg(OH)2·4H2O+CO2↑+10H2O,
4MgCO3·Mg(OH)2·4H2O+CO2↑+10H2O,
(1)
(2)
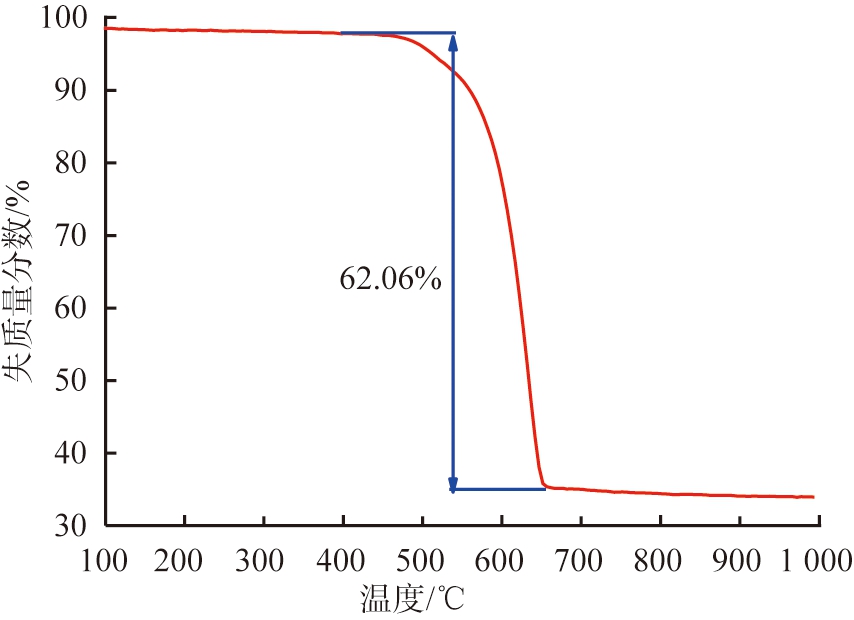
图10 无水碳酸镁的TG曲线
Fig.10 TG curve of anhydrous magnesium carbonate
![]()
(3)
(4)
(5)
由于MgCO3·3H2O属于热力学上的亚稳相,随着水热温度升高,棒状MgCO3·3H2O晶体逐渐溶解,形成多孔棒状、絮状、球状等多形貌4MgCO3·Mg(OH)2·4H2O,并释放出CO2,见式(1)。当水热体系中加入NH4Cl时,![]() 水解产生H+,见式(3)、 (4)。由于
水解产生H+,见式(3)、 (4)。由于![]() 水解属吸热反应,提高水热温度,延长水热时间,升高水热釜内压力,均有利于
水解属吸热反应,提高水热温度,延长水热时间,升高水热釜内压力,均有利于![]() 水解并不断地向水热溶液中释放更多的H+,加速4MgCO3·Mg(OH)2·4H2O向无水MgCO3转变,见式(5),从而促进无水MgCO3晶体的形成。图11所示为NH4Cl辅助下,MgCO3·3H2O水热法制备无水MgCO3的形成机理图。
水解并不断地向水热溶液中释放更多的H+,加速4MgCO3·Mg(OH)2·4H2O向无水MgCO3转变,见式(5),从而促进无水MgCO3晶体的形成。图11所示为NH4Cl辅助下,MgCO3·3H2O水热法制备无水MgCO3的形成机理图。
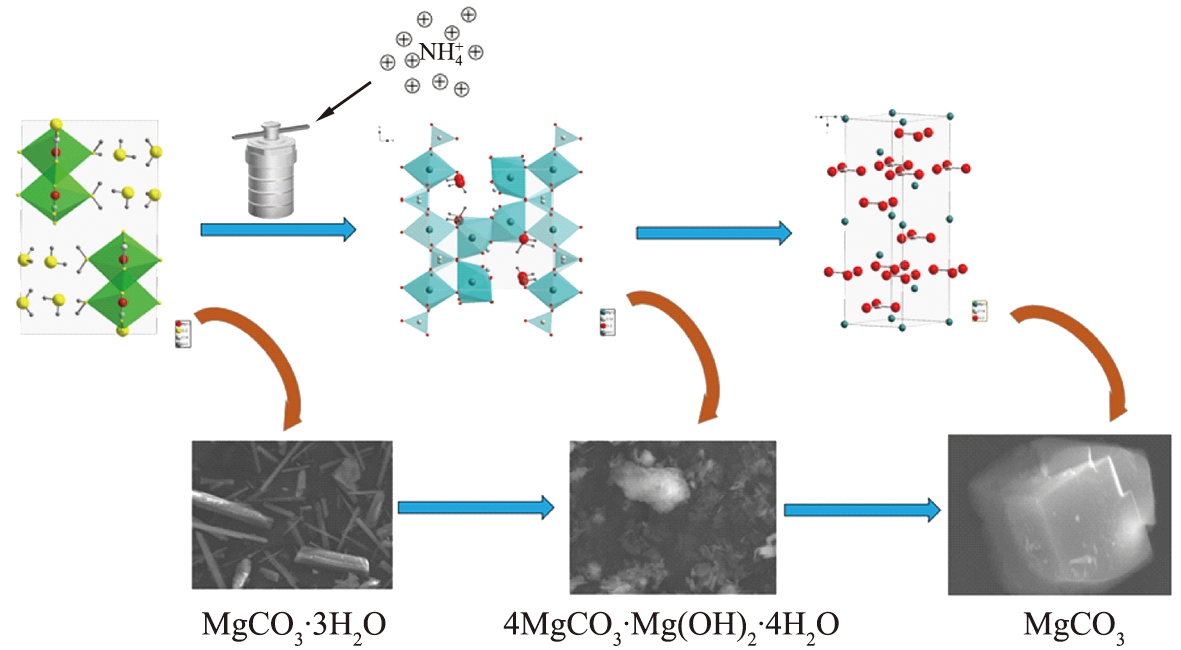
图11 三水碳酸镁水热法制备无水碳酸镁的机理图
Fig.11 Mechanism diagram of anhydrous magnesium carbonate prepared by nesquehonite
3 结论
1)以菱镁矿为初始原料,MgCO3·3H2O为中间产物,NH4Cl为添加剂,当水热温度为170 ℃,水热时间为11 h,固液质量比为1∶30时,可获得平均直径为2~5 μm的菱块状无水MgCO3晶体。
2)NH4Cl辅助下,MgCO3·3H2O水热法制备无水MgCO3时,固液质量比对产物的物相组成与微观形貌无明显影响;水热温度和水热时间则具有显著影响,水热产物经历了棒状MgCO3·3H2O—多形貌4MgCO3·Mg(OH)2·4H2O—菱块状无水MgCO3的相转变过程。
3)NH4Cl辅助下,升高水热温度与延长水热时间均有利于![]() 离子水解生成H+,促进无水MgCO3晶体生成。
离子水解生成H+,促进无水MgCO3晶体生成。
[1]党力, 乃学瑛, 董亚萍, 等. 微波法快速制备无水碳酸镁粉体[C]//中国化学会. 中国化学会第30届学术年会摘要集: 第三十六分会: 纳米材料合成与组装. 大连, 2016: 154.
[2]SUCHANEK W L, RIMAN R E. Hydrothermal synthesis of advanced ceramic powders[J]. Advances in Science and Technolgy, 2006, 6(45): 184-195.
[3]王峻, 王晶, 柯庆, 等. 水热处理对无水碳酸镁微观结构的影响[J]. 硅酸盐学报, 2015, 43(3): 327-333.
[4]王晶, 惠香, 田丁, 等. 花型无水碳酸镁制备及其热分解动力学[J]. 人工晶体学报, 2014, 43(7): 1700-1704, 1717.
[5]SWANSON E J, FRICKER K J, SUN M, et al. Directed precipitation of hydrated and anhydrous magnesium carbonates for carbon storage[J]. Physical Chemistry Chemical Physics, 2014, 16(42): 23440-23450.
[6]LIANG W, LI Z M, YIN Y, et al. Single crystal growth, characterization and high-pressure Roman spectroscopy of impurity-free magnesite (MgCO3)[J]. Physics and Chemical of Minerals, 2018, 45: 423-434.
[7]HU S H, YE G T, CHEN L G, et al. Effect of micro-sized MgCO3 addition on properties of MgAl2O4 spinel containing castables [J]. Ceramics International, 2017, 43(13):9891-9885.
[8]郑环, 刘卫, 张念炳. 碳酸镁添加剂对铝用炭阳极质量的影响[J]. 有色金属(冶炼部分), 2014(6): 40-42.
[9]范景彪, 李志伟, 骆建敏, 等. 基于碳酸镁模板的氮掺杂多孔炭的制备及其电化学性能[J]. 材料研究学报, 2018, 32(8): 599-606.
[10]YAN J, HAN X X, ZHENG X Z, et al. One-step template/chemical blowing route to synthesize flake-like porous carbon nitride photocatalyst[J]. Materials Research Bulletin, 2017, 94: 423-427.
[11]ZHANG P, TORRE T Z G D L, WELCH K, et al. Supersaturation of poorly soluble drugs induced by mesoporous magnesium carbonate[J]. European Journal of Pharmaceutical Sciences, 2016, 93: 468-474.
[12]YANG J J, ALVEBRATT C, LU X, et al. Amorphous magnesium carbonate nanoparticles with strong stabilizing capability for amorphous ibuprofen[J]. International Journal of Pharmaceutics, 2018, 548(1): 515-521.
[13]邢家领, 苏俊琪, 高恩军. 碳酸镁和氢氧化镁负载顺铂药物及其活性研究[J]. 沈阳化工大学学报, 2018, 32(2): 118-122.
[14]WANG L, KIM Y M, LEE J H, et al. Effect of magnesium carbonate on microstructure and rolling behaviors of AZ31 alloy[J]. Materials Science and Engineering A, 2011, 528(3): 1485-1490.
[15]CHEN T J, JIANG X D, YUAN H, et al. Grain refinement of AZ91D magnesium alloy by MgCO3[J]. Materials Research, 2011, 14(1): 43-53.
[16]陈体军, 王瑞权, 黄海军, 等. AM60B镁合金的MgCO3晶粒细化技术[J]. 中国有色金属学报(英文版), 2012, 22(7): 1533-1539.
[17]WANG J, HE Q N, GAO Z. The effect of different solvent on the microstructure of gibbsite during hydrothermal treatment[J]. Advanced Materials Research, 2011, 160/161/162: 76-80.
[18]刘润静. 碳酸镁行业现状及趋势分析[C]//中国无机盐工业协会镁化合物分会. 2019年全国镁化合物行业年会暨调结构、 促融合、 增效益、 可持续发展论坛. 石家庄, 2019: 115-118.
[19]田朋. 碳酸镁模板化制备复杂微纳结构及性能表征[D]. 大连: 大连理工大学, 2013.
[20]KRISTIAN S, LEIF O J, BAARD K, et al. Simple method for synthesis of magnesite(MgCO3)[J]. Industrial & Engineering Chemistry Research, 2008, 47(4): 1002-1004.
[21]王英伟. 超细无水碳酸镁粉体的制备[D]. 北京: 北京化工大学, 2017.
[22]沈兴. 一种在循环介质中制取高纯度氧化镁或碳酸镁的方法: CN1362371A[P]. 2002-08-07.
[23]XING Z, HAO Q, JU Z, et al. Synthesis of MgCO3 microcrystals at 160 ℃ starting from various magnesium sources[J]. Materials Letters, 2010, 64(12): 1401-1403.
[24]时天骄, 王余莲, 刘珈伊, 等. 共沉淀法制备三水碳酸镁晶体及生长机理[J]. 中国粉体技术, 2021, 27(5): 120-127.
[25]刘珈伊, 王余莲, 时天骄, 等. 无水乙醇辅助低温直接法制备碱式碳酸镁晶体[J]. 中国粉体技术, 2021, 27(1): 41-49.