大力发展核电对于实现我国的碳达峰和碳中和承诺具有重要意义,但核电机组在运行过程中会存在不同程度的放射性核素的释放或排放,特别是一旦发生事故会对人和环境产生很大的危害。在这些放射性核素的释放或泄露中,核燃料衰变后产生的放射性碘极易进入水体中形成有机碘、碘离子(I-)和碘酸根离子![]() 研究表明,我国水域由于含氧量较高,I元素多以I-和
研究表明,我国水域由于含氧量较高,I元素多以I-和![]() 的形式存在[1]。
的形式存在[1]。
传统处理I-的方法有膜分离法[2-3]、 生物处理法[4]和化学沉淀法[5-6]等。其中,膜分离法处理量低,成本高,生物处理法对环境要求较高且处理效果不稳定,化学沉淀法依赖场地且沉淀过程容易产生二次污染。吸附法作为一种简单高效、 成本低的水处理方法被广泛应用于I-的处理过程当中。吸附法中除了选用大比表面积的多孔材料外,还通过添加或掺杂纳米金属以利用化学吸附作用来实现更高效和快速吸附。吸附法主要基于材料的大比表面积的特性,Cu-BTC(HKUST-1)是一类拥有大比表面积、内部孔径有序排列、结构高度对称的Cu基金属有机骨架(metal-organic framework, MOF)[7]。通过不同合成方法控制Cu-BTC的微观形貌,并在不同温度和气氛下进行热解处理,使其内部孔道被打开一直延伸到材料表面,改变其亲水性能,在内部形成不同价态的Cu,产生能作用于污染物离子的合适孔径和活性位点,使其在吸附领域拥有良好的应用前景[8]。
对目标物的吸附,除了基于大比表面积的物理吸附外,化学吸附可在很大程度上增强材料的富集效能。对放射性I-而言,实现高效化学吸附的金属主要有Cu[9]、 Bi[10]和Ag[11]3种。其中,Bi和I-的作用主要在于Bi3+能与I-产生稳定的Bi-I-O混合物[12],但反应速度极其缓慢,在实际应用过程中不多见;Cu和I-的作用在于Cu+能够与I-结合生成CuI[13],但由于Cu+极易被氧化成Cu2+或还原成Cu0,从而降低吸附效果;Ag和I-的作用在于Ag+和I-的强相互作用生成AgI,并且高价态的Ag能将I-氧化为I单质和AgI反应生成AgI3[14],而且Ag能够和I快速结合,在很短时间之内就能达到反应平衡[15]。
为了进一步提高热处理Cu-BTC后得到的衍生材料的吸附性能,本文中通过在制备Cu-BTC前驱体的过程中引入纳米Ag,利用自然氧化的特性制备出Ag2O@Cu-BTC双金属前驱体;随后进行热解处理,制备出Ag@CuO复合材料。在评价材料吸附I-的实验研究中,通过引入Ag利用效率这一概念,定量地确定了Ag@CuO复合材料中Ag的有效掺量。
1 实验
1.1 主要试剂、材料和仪器设备
材料:三水硝酸铜(Cu(NO3)2·3H2O,分析纯,成都市科隆化学品有限公司); 1, 3, 5-苯三甲酸(C9O6H6)、 二甲基甲酰胺(C3H7NO)、 无水乙醇(C2H6O)(均为分析纯,阿拉丁试剂(上海)有限公司);硝酸银(AgNO3)、 氢氧化钠(NaOH)(均为分析纯,国药集团化学试剂有限公司)。
仪器设备: TGA/SDTA851E型热失重分析仪(梅特勒-托利多公司); AXS D8 Advance X射线粉末衍射仪(XRD, 德国Bruker公司); FEI Quanta 250F扫描电子显微镜分析仪(SEM)、 FEI Quanta 250F能谱扫描仪(EDS)(美国FEI公司)。
1.2 方法
1.2.1 材料制备
八面体Cu-BTC的合成及利用Cu-BTC制备Cu-Cu2O和Ag@CuO的流程如图1所示。
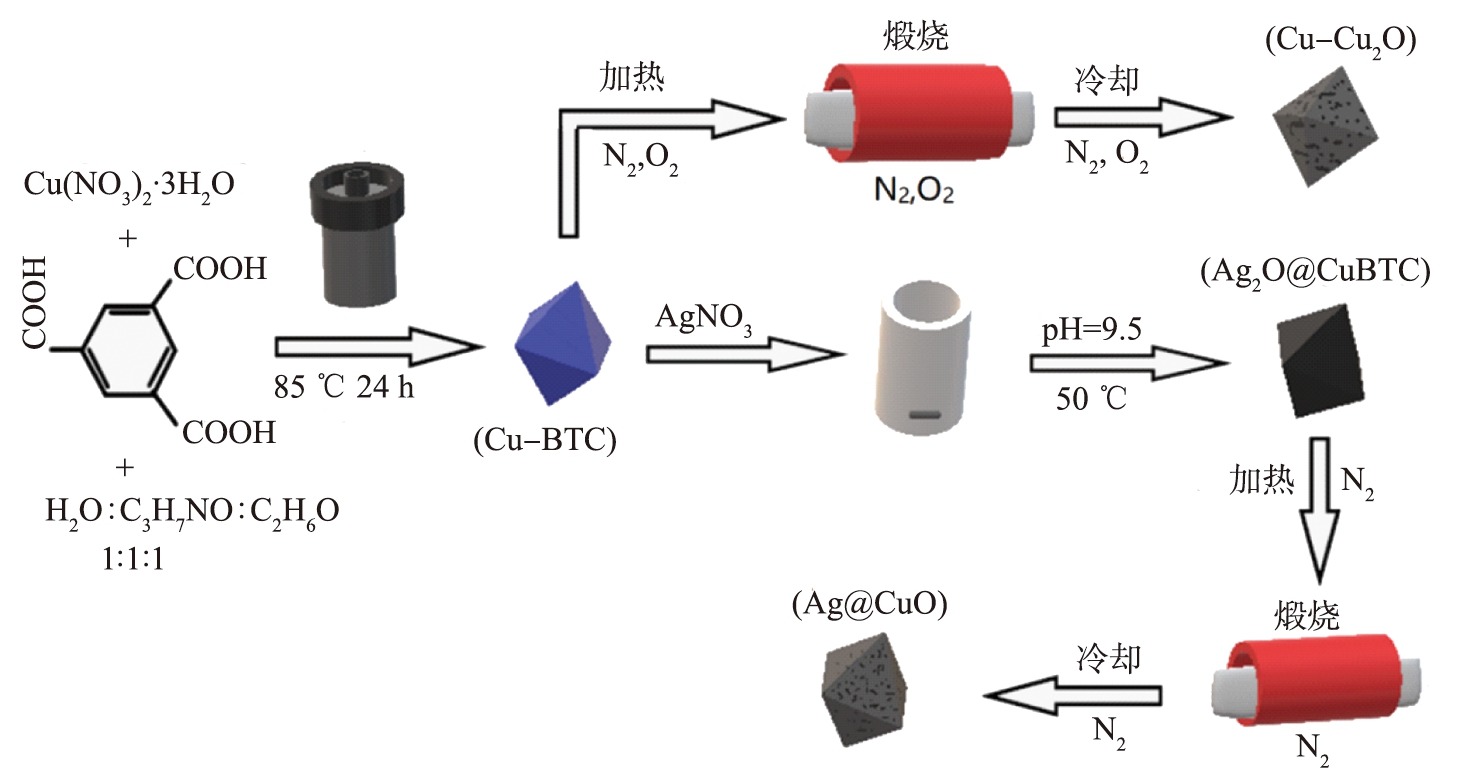
图1 Cu-BTC合成Cu-Cu2O和Ag@CuO示意图
Fig.1 Schematic of synthesis of Cu-Cu2O and Ag@CuO from Cu-BTC
1)Cu-BTC前体制备
制备Cu-BTC前体。将质量为2.08 g的Cu(NO3)2·3H2O和质量为1 g的1, 3, 5苯三甲酸溶于体积为45 mL的溶剂中,溶剂含有等体积的N、 N-二甲基甲酰胺、乙醇和去离子水。搅拌15 min后,将混合物放入体积为100 mL的聚四氟乙烯内衬不锈钢高压釜中,在温度为85 ℃条件下保持20 h,后冷却,过滤分离沉淀物,用去离子水和乙醇的混合溶剂洗涤3次,即得到八面体Cu-BTC前体。
2)Ag2O@CuBTC前体制备
取质量为100 mg的AgNO3溶解于体积为42 mL的去离子水中,随后加入质量为900 mg的八面体Cu-BTC样品,利用NaOH调节pH至9.5,在温度为50 ℃的条件下缓慢搅拌并反应10 h。处理后收集样品记为Ag2O@CuBTC。
3)八面体Cu-Cu2O制备
取质量为500 mg的八面体Cu-BTC样品,均匀铺开于坩埚底部,置于管式炉中,在一定温度和氮气气氛下恒温煅烧30 min并冷却至室温,获得黑色粉末状样品,所得产物记为Cu-Cu2O。
4)八面体Ag@CuO制备
取质量为500 mg的八面体Ag2O@CuBTC样品,均匀铺开于坩埚底部,置于管式炉中,将温度设置为343 ℃,在氮气中以5 ℃/min的速率升温,随后在氮气氛围下恒温煅烧30 min,然后在氮气中冷却至室温,获得黑色粉末状样品,所得产物记为Ag@CuO。
1.2.2 结构表征
采用热失重分析仪对Cu-BTC前体物质质量随温度变化进行测试, 测试条件为氮气氛围, 流速为20 mL/min。 采用X射线粉末衍射仪对Cu-BTC及其衍生材料组成相进行测试。采用扫描电子显微镜分析仪和能谱扫描仪对Cu-BTC及其衍生材料形貌和元素组成及含量进行测试。
2 结果与讨论
2.1 热重分析和预实验
对Cu-BTC进行热重(TG-DTG)分析,结果如图2所示。根据DTG大小将失质量分为3个阶段:第1阶段温度为50~130 ℃,失质量分数从100%降至89.78%,此过程主要在于材料表面游离水和吸附水的蒸发。第2阶段温度为130~240 ℃,失质量分数为89.78%~83.57%,主要在于材料内部的金属配位结晶水和阴离子结晶水的蒸发,同时残余的部分DMF也会随之挥发。第3阶段温度为240~410 ℃,失质量分数为83.57%~33.95%,此过程主要为MOF发生碳化,内部和表面生成了不同尺寸和数量的微孔、介孔、大孔,同时伴随着Cu和Cu的氧化物生成,MOF失去亲水性能,疏水性能提高。对第3阶段失质量速率较高的部分进行分析,在前半段(温度为300~340 ℃)主要是MOF内部游离Cu和配位Cu与含氧官能团反应生成CuO和Cu2O,伴随CuO被分解为Cu2O,微孔体积变大;在后半段(温度为340~380 ℃)主要是随着碳化程度增强,CuO被碳还原为Cu和少量Cu2O,介孔和大孔数目增加,材料逐渐转变为无定型碳结构。
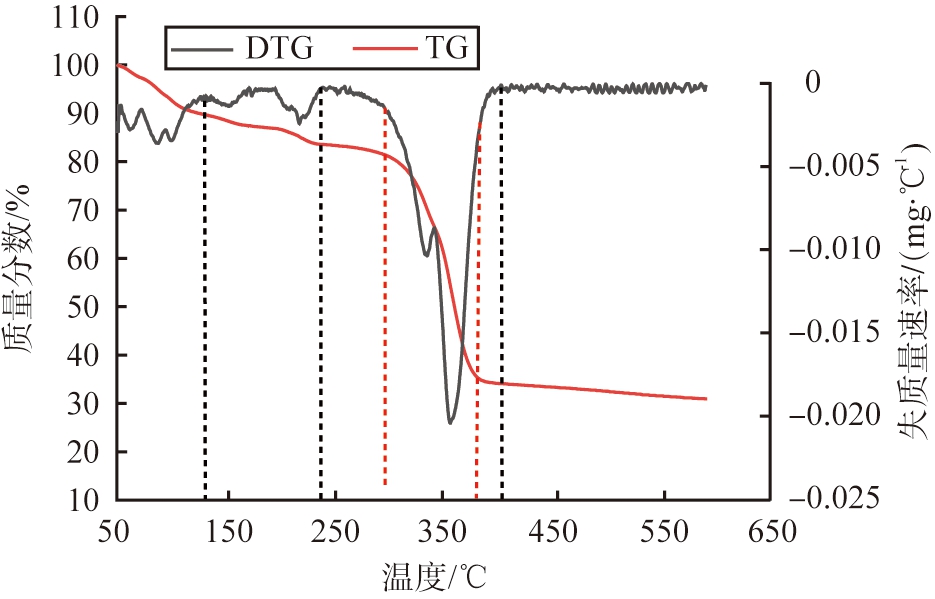
图2 Cu-BTC的TG-DTG分析图
Fig.2 Image of TG-DTG analysis of Cu-BTC
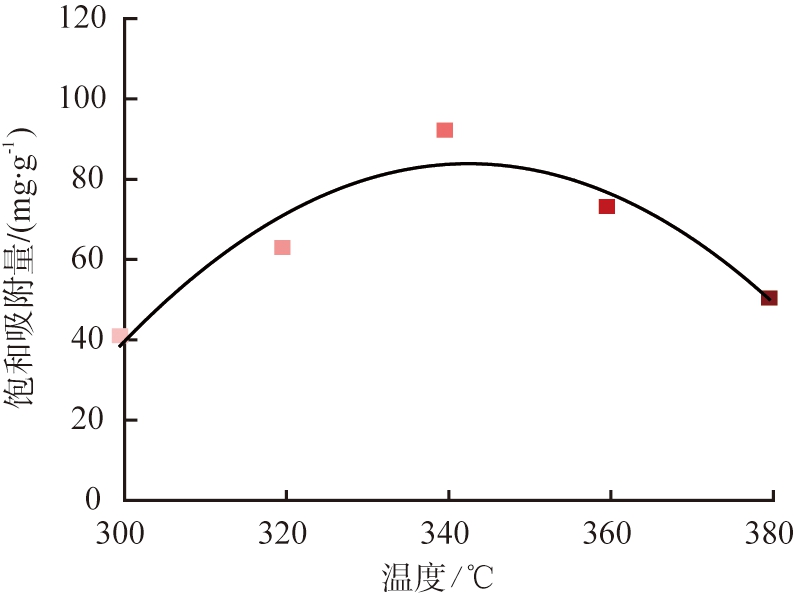
(a) 样品的热解温度-吸附曲线
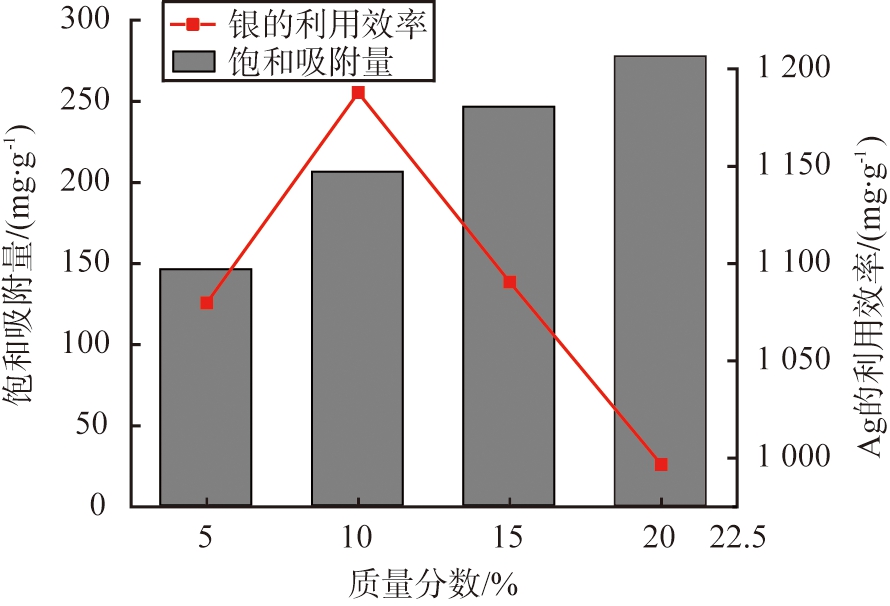
(b)银的利用效率
图3 样品的热解温度-吸附曲线及其银的利用效率
Fig.3 Temperature-adsorption capacity curve of sampleand and its equivalent utilization of silver
图3所示为样品的温度-吸附量曲线及其对Ag的利用效率。 由于影响Cu-BTC吸附性能的因素主要为孔径数量和材料的疏水性能, 当材料开始碳化时, 内部逐渐出现不同尺寸的孔隙。 温度过低, 孔径尺寸和数量过小, 材料亲水性较高, Cu原子仍然以配位的形式存在, 难以产生吸附效果; 温度过高, 孔径偏大, 疏水性强难以分散, 并且Cu-BTC内部的Cu—Cu, Cu—OCO(Cu羧基配体键)和C原子之间的键会断裂造成碳骨架结构的坍塌, 影响离子传输能力; 当在合适的温度时, 能够产生拥有合适大小和数量以及疏水性能的孔径, 对I-有最好捕获能力[16-17]。 由此根据第3个失质量阶段碳化反应速率较快的温度为300~380 ℃划分为5个梯度进行热解和吸附实验, 以温度为横坐标, 吸附量为纵坐标, 用二次多项式拟合出其最适温度, 结果如图3(a)所示。 当T=343 ℃, 热解后的Cu-BTC饱和吸附量能达到最大, 在此温度下对其进行后续实验。
当Ag的质量分数偏小,不足以充分利用中空孔道的表面,形成的活性位点较少,吸附效果提升不明显;若Ag的掺量过大时,会在热解过程中造成部分Ag单质被CuO形成的氧化层所覆盖,导致Ag的利用效率降低[18-19]。为此,本文中提出Ag利用效率这一概念,可以理解为吸附剂中Ag对应的等效吸附量,以确定保证吸附效果情况下经济效益最大的Ag掺量,如图3(b)所示。具体计算方法为:
E=100[q-0.958(100-w)]/w,
(1)
式中: E为Ag利用效率, mg/g; q为不同Ag质量分数吸附剂的饱和吸附量, mg/g; w为Ag的质量分数,%。
通过预吸附实验确定了当w=10%时,Ag@CuO复合材料中E最高,达到1 190 mg/g,采用10%-Ag@CuO进行I-去除经济性最佳。
2.2 XRD分析
图4所示为Cu-BTC及其复合材料的XRD图谱。对Cu-BTC前体进行分析,如图4(a)所示,观察到在2θ为8.1°、 9.4°、 11.5°、 12.9°分别出现了属于Cu-BTC的4个衍射峰,对应Cu-BTC 4个晶面。特定条件下对其进行煅烧后,在2θ为36.3°和61.6°处观测到Cu2O的特征峰(JCPDS 65-3288),对应Cu2O的(111)、 (220)晶面;在2θ为43.5°和50.6°处有Cu的特征峰的出现(JCPDS 65-9743),对应Cu的(111)和(200)晶面,表明该温度下游离Cu+和O结合生成Cu2O,并随着Cu-BTC的逐渐碳化,内部Cu原子通过C还原成Cu+和Cu单质继而和O原子反应形成Cu-Cu2O位点。此外,在对I-饱和吸附后,如图4(b)所示,Cu-Cu2O材料所对应的Cu2O的峰强减小,同时在2θ为25.5°和49.7°处出现了属于CuI(111)和(311)晶面的衍射峰(ICDD-PDF 06-0246),表明Cu2O中的Cu+和I-反应生成CuI。
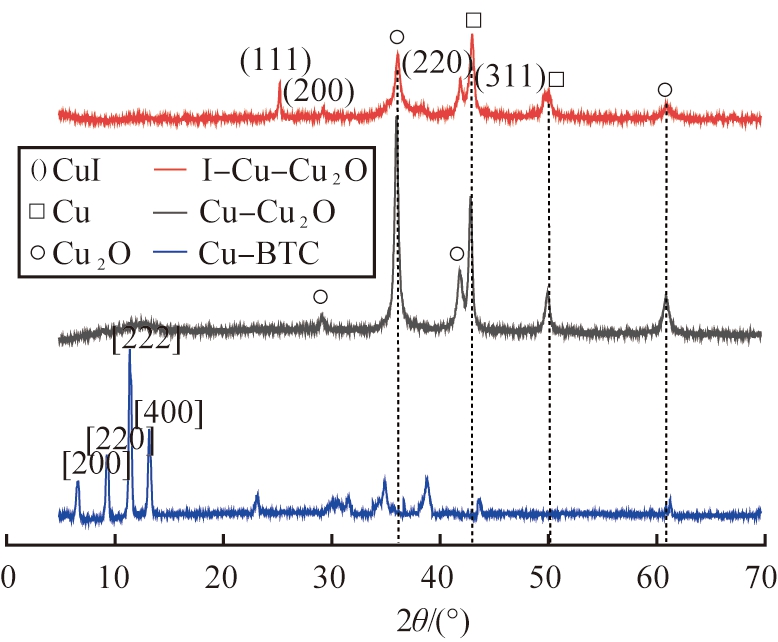
(a)Cu-Cu2O
(b)Ag@CuO
图谱
Fig.4 XRD patterns of Cu-BTC and its composites
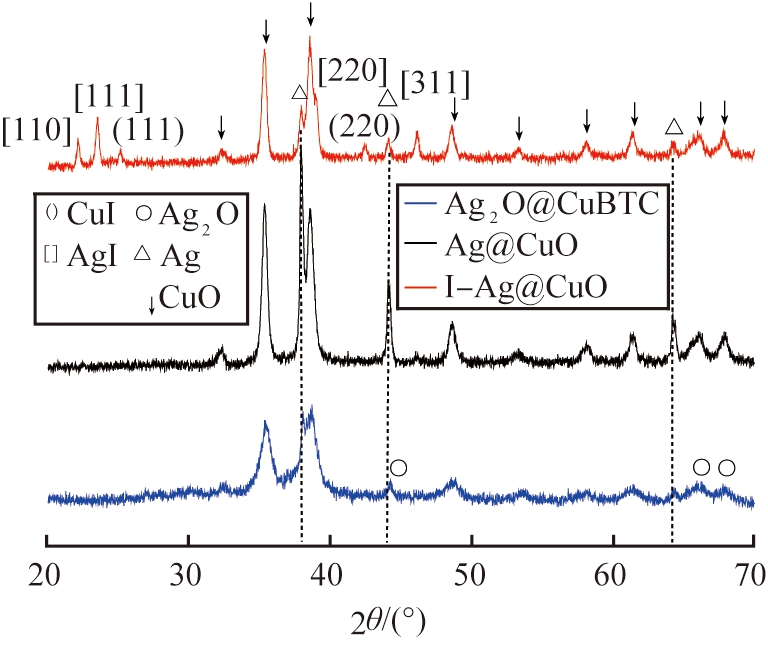
通过浸渍法掺杂Ag后,如图4(b),观察到在2θ为44.3°、 65.9°、 67.7°处出现了Ag2O(ICDD-PDF 42-0874)的特征峰, 同时在对应位置仍然保留了属于Cu-BTC的特征峰, 表明成功合成了Ag2O@Cu-BTC前体材料。 煅烧后在2θ为35.3°和39.1°处出现了2个较强的主峰, 对应于CuO的(002)和(111)晶面, 在2θ为32.5°、 48.5°、 53.4°、 58.1°、 61.5°、 65.6°、 68.2°处出现属于CuO的次特征峰(JCPDS 45-0937)。分析认为,由于在弱碱性条件下Cu+会容易被氧化成Cu(OH)2,而在加热条件下Cu(OH)2会形成CuO覆盖在表面阻止Cu2O的形成和Cu的还原。
由图4(b)可以看到, 在2θ为37.7°、 44.0°、 64.3°处还出现了属于Ag的特征峰(ICDD-PDF, 04-0783), 对应于Ag的(111)、 (200)、 (220)晶面, 表明成功合成了Ag@CuO复合材料。 利用Ag@CuO对I-进行饱和吸附后, Ag的衍射峰强度明显减弱, 同时位于35.3°和39.1°的2个CuO的主衍射峰有微弱减小。 因为在I-溶液中, CuO水解形成Cu2+, 能和Ag发生可逆反应生成Ag+和Cu+。 由于AgI和CuI的溶度积常数Ksp分别为8.52×10-17和1.27×10-12, 均明显低于溶液中其他物质, 所以I-的存在使可逆反应继续进行, 因此, 吸附I后样品在2θ为22.0°、 23.7°、 39.4°、 46.3°出现了属于AgI的特征峰, 分别对应AgI的(110)、 (111)、 (220)和(311)晶面(ICDD-PDF 09-0374); 在2θ为25.5°和42.2°处也出现了属于CuI (111)和(220)晶面的特征峰。 该现象再次证明了Ag和CuO发生可逆反应生成Ag+和Cu+, 与I-之间发生化学反应生成AgI和CuI沉淀并固定在Ag@CuO材料上, 达到对I-的物理或化学吸附。
2.3 SEM-EDS分析
图5所示为材料的微观形貌。对前体Ag2O@CuBTC和Cu-BTC进行SEM分析可以看到,相对于Cu-BTC,Ag2O@CuBTC表面出现了很多颗粒,如图5(a)所示。结合样品的XRD和元素分布,主要是Ag2O颗粒团聚沉积在Cu-BTC表面形成的。对Ag2O@CuBTC煅烧后,八面体表面变得粗糙,如图5(b)所示,伴随有坑洼的孔道和纳米级颗粒形成。这是由于热处理使Ag2O分解为纳米Ag并均匀负载在八面体表面,使得材料转变为负载纳米Ag颗粒的中空多孔结构。
在对Cu-BTC煅烧后,相对于图5(c)而言,样品表面出现了微米级颗粒和少量孔隙,如图5(d)所示。结合前述XRD分析, CuO高温下被还原为Cu和Cu2O,团聚而成Cu-Cu2O并负载在八面体表面形成颗粒,分布不均匀。

(a)Ag2O@CuBTC

(b)Ag@CuO

(c)Cu-BTC

(d)Cu-Cu2O
图5 材料的微观形貌图
Fig.5 Scanning electron microscope images of samples
图6所示为吸附前、后Ag@CuO的能谱分析图及吸附碘后的元素分布图。 对吸附前样品进行能谱分析, 如图6(a)所示, 在入射能量为0.3 keV处只能观察到对应的C微弱反射峰, 而在入射能量为0.9 keV处能够观察到强烈的Cu的反射峰, 并且在入射能量为8.0、 8.8 keV处对应Cu的反射峰。 在入射能量为0.5 keV处对应O的反射峰强度均大于C的峰, 结合前述XRD和SEM, 其原因为Cu在碱性和加热条件下被氧化为CuO形成一层氧化膜覆盖在材料表面, 使得材料表面C元素含量偏低, Cu和O元素含量偏高。 根据能谱扫描结果Ag的质量分数8.5%与Ag的掺量一致, 再次证明煅烧之后Ag单质能够均匀负载在CuO表面。
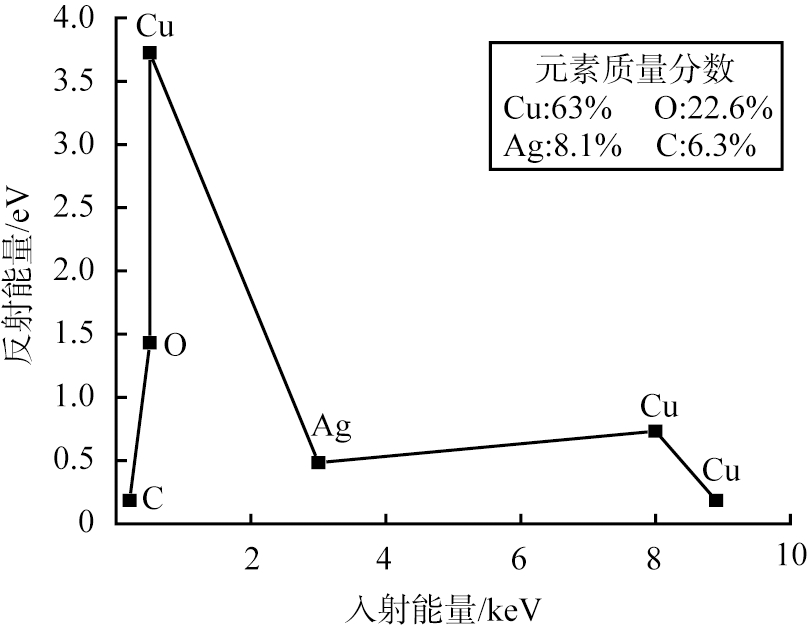
(a)Ag@CuO
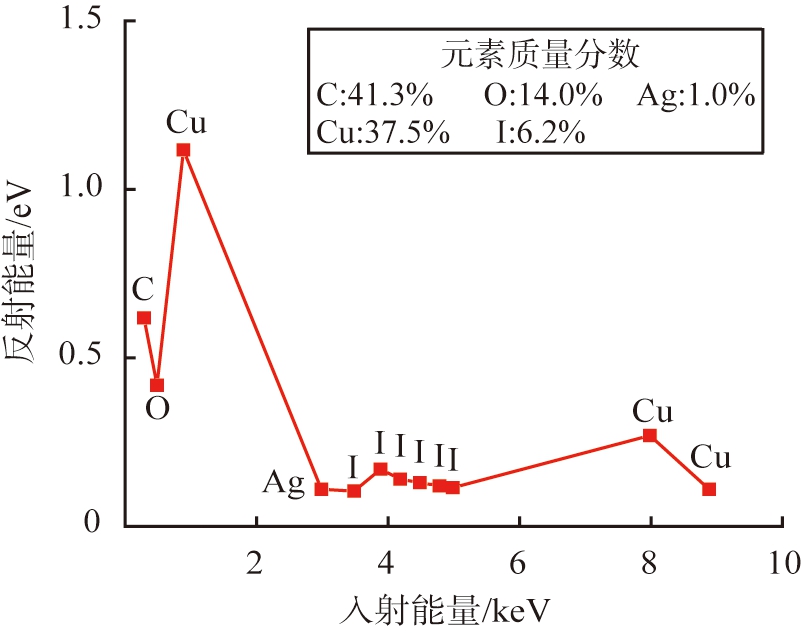
(b)I-Ag@CuO

(e)I-Ag@CuO的元素分布图
图6 吸附前、 后Ag@CuO的能谱分析图及吸附碘后的元素分布图
Fig.6 Energy Dispersive Spectrometer diagram and elements mapping images
对吸附后的样品进行能谱分析,如图6(b)所示。此时材料表面C元素含量大大增加,Ag元素含量减少,其原因为CuO和Ag发生可逆反应,随后产物和I-产生化学反应生成AgI和CuI沉淀固定在材料表面和内部,使得CuO的膜层被破坏,八面体的C、 O骨架暴露出来。对吸附后的Ag@CuO样品进行元素分布扫描,如图6(c)所示,仍能观察到八面体结构,并且Ag和I均匀分布在八面体表面,表明Ag的引入将I固定为AgI成功负载在复合材料上。
2.4 等温吸附测试
为了对复合材料去除I-的效率进行分析, 采用10%-Ag@CuO进行等温吸附实验: 将NaI溶于去离子水配成I-初始质量浓度不同的溶液, 利用紫外-可见光分光光度计在227 nm处测试I-浓度, 控制 pH=7, T=298 K, 吸附剂投加量为1 g/L, 吸附时间为12 h。 材料对I-的平衡吸附量为
qe=(ρ0-ρe)V/m,
(2)
式中: ρ0为I-初始质量浓度, mg/L; ρe为I-平衡质量浓度, mg/L; V为溶液体积, L; m为吸附剂质量,g。由此等温吸附测试结果如图7所示。
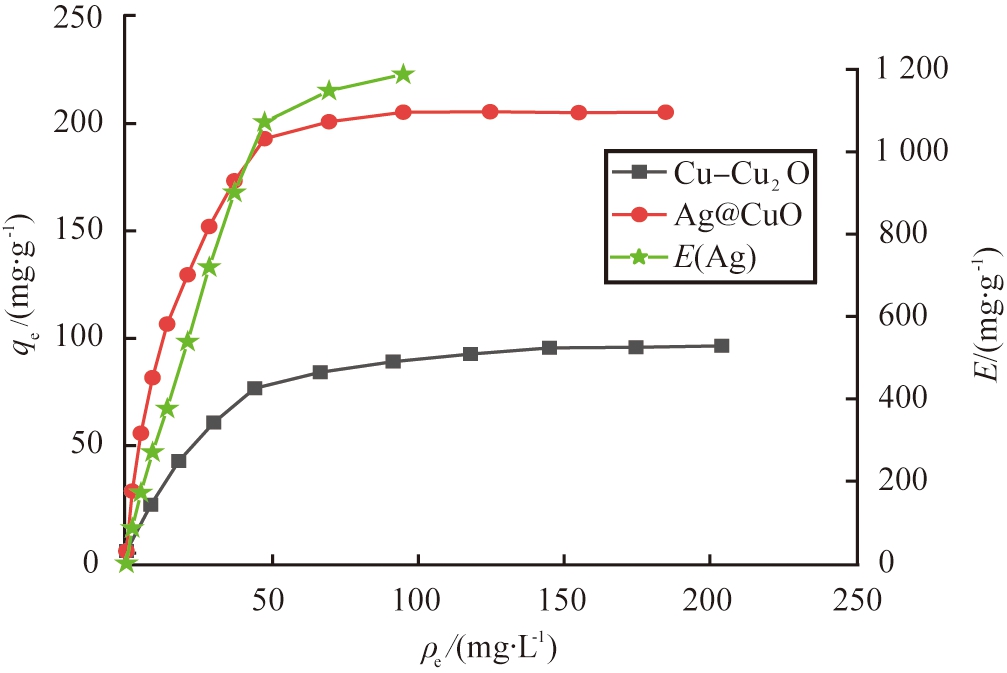
图7 改性前、 后材料等温吸附曲线
Fig.7 Isothermal adsorption line of materials before and after modification
由图7可以看到,纳米Ag的引入使得Ag@CuO复合材料的I-饱和吸附量由95.8 mg/g增大到205.0 mg/g。在前半段I-质量浓度较低时,由于Ag和I的强相互作用,对I-有较大的去除效果,Ag利用效率随着I-初始质量浓度增大而增大;后半段由于I-和Ag位点反应趋于饱和,对I-的吸附以Cu+的化学作用为主,吸附量提升不如初始I-质量浓度较低时明显。对于Cu-Cu2O,由于Cu和I相互作用较弱,以及材料表面含有Cu(I)的位点分布不均匀,导致Cu-Cu2O对I-的去除效率相对较低。
以1/ρe为横坐标,1/qe为纵坐标建立Langmuir等温吸附模型:
(3)
式中: bL与自由能有关,理解为Langmuir常数; qm为Langmuir模型理论最大吸附量。
以ln ρe为横坐标, lnqe为纵坐标建立Freundlich等温吸附模型:
(4)
式中:n=B/N,为吸附每个分子需要活性中心的数量, B为用于吸附的活性中心数量,N为被吸附的分子数量;bF=KA,为Freundlich常数, A为多层吸附的极限吸附量, K为吸附平衡常数。
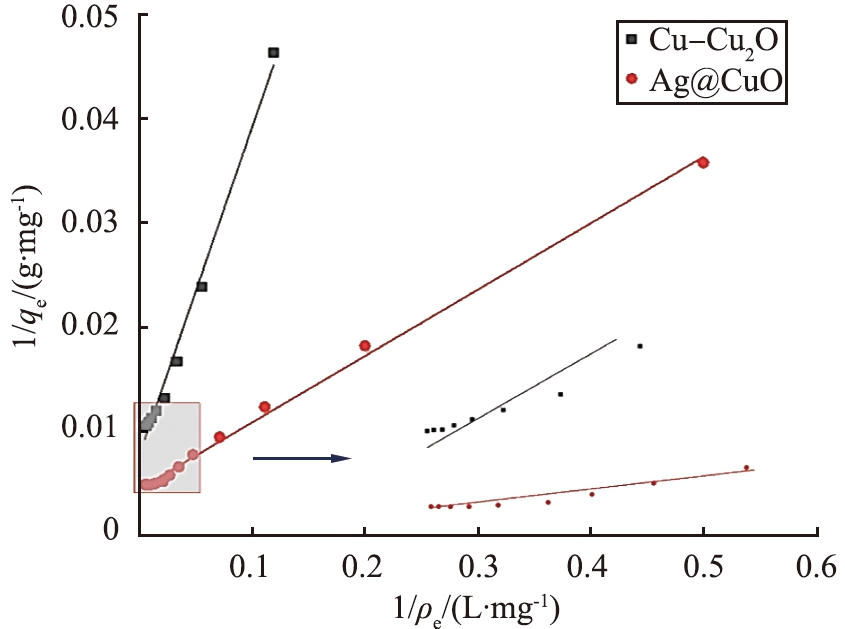
(a)Langmuir
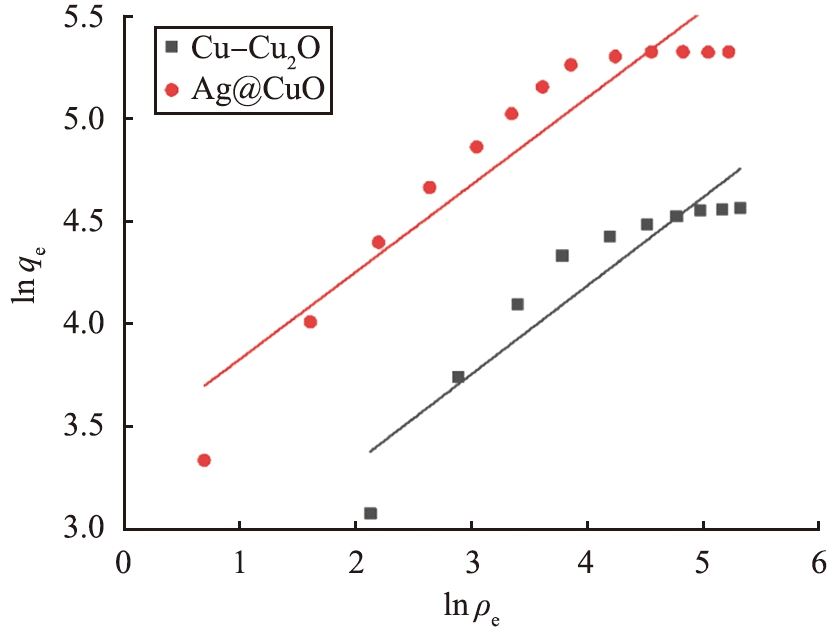
(b)Freundlich
图8 等温吸附模型的拟合
Fig.8 Fitting line of isothermal adsorption model
对Cu-Cu2O和Ag@CuO进行Langmuir拟合,其相关系数分别为0.990和0.997;进行Freundlich拟合,其相关系数分别为0.875和0.895,如图8所示。表明Langmuir模型更贴合吸附过程,吸附质在吸附剂表面和内部进行单层吸附,并且理论最大吸附量qm分别为138.69、 223.21 mg/g,与实际测得的饱和吸附量误差在可接受的范围之内,主要是由于Cu(I)和Ag(I)的存在使得I-能够和活性金属产生相互作用被固定在吸附剂上。
2.5 动力学测试
为了对复合材料去除I-的速率进行分析, 采用质量分数为10%的Ag@CuO进行动力学吸附实验: 向体积为100 mL、 I-初始质量浓度为240 mg/L的溶液中投加质量浓度为1 g/L的吸附剂, 在反应中按一定的时间间隔每次取样0.5 ml,过滤稀释后测量I-质量浓度, 并与标准曲线对比, 将t时刻溶液中I-记为ρt。材料t时刻的吸附量为:
qt=(240-ρt)V/m,
(5)
式中: qt为复合材料t时刻对I-的吸附量, mg/g; ρt为t时刻溶液中的I-质量浓度, mg/L。
图9所示为改性前、 后材料吸附动力学曲线。 由图可以看出, Ag@CuO对I-的平衡吸附量为192.6 mg/g。 观察动力学曲线, 在 15 min内材料快速达到饱和吸附量的50%, 主要是由于Ag和CuO发生了可逆反应生成Ag+并和I-快速反应产生AgI沉淀的结果。 15 min之后的吸附效果主要是由于内部未被氧化的Cu+和被Ag还原的Cu+与I-反应生成CuI的结果, 并且在90 min后Ag@CuO和I-反应接近于平衡, Ag利用效率达到了1 010 mg/g。 对于Cu-Cu2O, 吸附过程一直趋于平缓, 在120 min之后开始达到吸附平衡, 吸附量仅为94.8 mg/g。
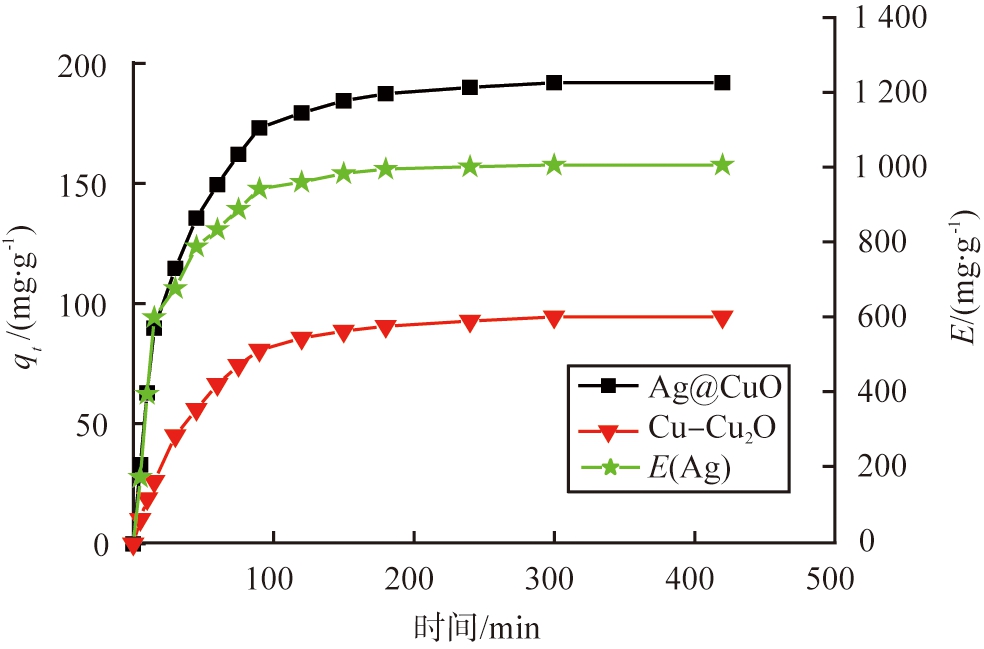
图9 改性前、 后材料吸附动力学曲线
Fig.9 Adsorption kinetics curves of materials before and after modification
以t为横坐标,ln(qe-qt)为纵坐标建立对应拟一阶动力学模型:
ln(qe-qt)=-k1t+ln qe,
(6)
以t为横坐标,t/qt为纵坐标建立对应拟二阶动力学模型:
(7)
式中: k1为拟一阶动力学速率常数; k2为拟二阶动力学速率常数; qm为拟二阶动力学模型理论最大吸附量。
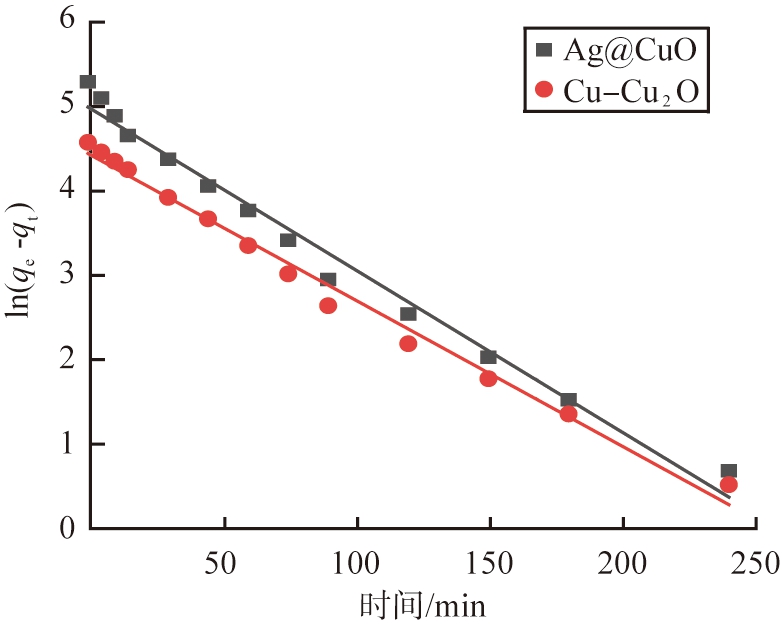
(a)拟一阶动力学

(b)拟二阶动力学
图10 吸附动力学模型的拟合
Fig.10 Fitting Lines of adsorption kinetics models
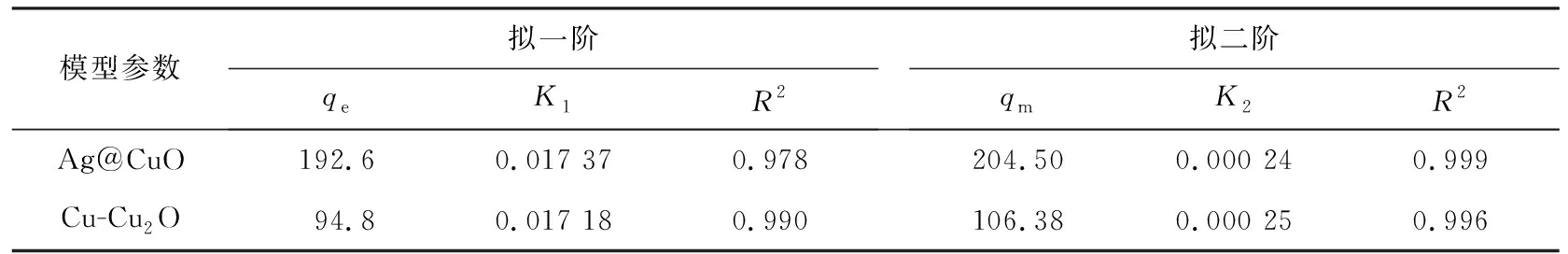
线性拟合结果如图10所示,相关参数见表1所示。
表1 动力学吸附模型相关参数
Tab.1 Parameters related to kinetics adsorption model
模型参数拟一阶qeK1R2拟二阶qmK2R2Ag@CuO192.60.017 370.978204.500.000 240.999Cu-Cu2O94.80.017 180.990106.380.000 250.996
通过计算表明拟二阶动力学模型能更好地贴合吸附过程(R2>0.995)。 结合等温吸附模型进行分析表明,吸附剂主要通过表面负载的Ag和CuO发生可逆反应, 生成Ag+和Cu+与I-产生化学作用, 以化学吸附的方式去除I-; 同时, 未被完全反应的CuO和在被碳化后保留了Cu-BTC原有结构的C、 O骨架多孔材料, 能够以物理吸附的方式去除一定量的I-, 理论平衡吸附量qm与实际平衡吸附量qe较为接近。
3 结论
1)通过在一定条件下热解Cu-BTC得到的衍生材料, 对I-具有一定吸附效果。 根据TG-DTG曲线将Cu-BTC在氮气下进行梯度煅烧, 用二次拟合确定最佳煅烧温度为343 ℃; 在此温度下, 合成Cu-Cu2O和掺杂Ag的Ag@CuO复合材料, 并对其进行预吸附实验确定Ag利用效率最高的掺量为10%。
2)通过表征和建立模型分析,Cu-Cu2O通过其表面Cu2O位点产生Cu+与I-反应生成CuI,并负载在八面体多孔材料的表面和内部,以化学单层吸附的方式去除I-。Ag@CuO对I-的吸附过程通过在溶液中CuO和Ag发生可逆反应生成Cu+和Ag+,随后与I-生成CuI和AgI沉淀负载在材料上实现,并且未被完全反应的CuO本身会对I-产生一定的吸附作用,以物理多层吸附和化学单层吸附的方式共同去除I-。
3)等温吸附实验表明,Cu-Cu2O的饱和吸附量为95.8 mg/g; Ag@CuO的饱和吸附量为205.0 mg/g, 并且在各浓度下对I-都拥有较高的去除效率。动力学吸附实验表明,Cu-Cu2O在120 min后接近于吸附平衡;Ag@CuO在15 min时能达到平衡吸附量的50%,在90 min后能接近于吸附平衡,改性后的材料在吸附效率和吸附速率上都有显著提高。
[1]SARA S, ROY S, PANDIYATHURAY M, et al. Adsorption of iodine species ![]() I-,
I-, ![]() ) at the nuclear paint monolayer-water interface and its relevance to a nuclear accident scenario[J]. The Journal of Physical Chemistry A, 2020, 124: 6726-6734.
) at the nuclear paint monolayer-water interface and its relevance to a nuclear accident scenario[J]. The Journal of Physical Chemistry A, 2020, 124: 6726-6734.
[2]DURMAZ F, ANDIRICI Y. Ultrafiltration membrane separation technique for drinking water[J]. Emerging Materials Research, 2020, 9(3): 1028-1030.
[3]WAQAS S, BILAD M R, MAN Z B, et al. An integrated rotating biological contactor and membrane separation process for domestic wastewater treatment[J]. Alexandria Engineering Journal, 2020, 59(6): 4257-4265.
[4]DAUD N M, ABDULLAH S, HASAN H A, et al. Integrated physical-biological treatment system for batik industry wastewater: a review on process selection[J]. Science of the Total Environment, 2022, 819: 152931.
[5]SHI L, DUAN B, ZHU Z, et al. Preparing copper catalyst by ultrasound-assisted chemical precipitation method[J]. Ultrasonics Sonochemistry, 2020, 64: 105013.
[6]RAHIMI H, GHAFELEBASH A, SHAMS K, et al. Monoethylene glycol reclamation based on chemical precipitation process[J]. Journal of Natural Gas Science and Engineering, 2021, 92(13): 103992.
[7]CHUI S Y, LO M F, CHARMANT J, et al. A chemically functionalizable nanoporous material[Cu3(TMA)2(H2O)3]n[J]. Science, 1999, 283(5405): 1148-1150.
[8]张爽, 丁欣欣, 闫良国. 改性水滑石类材料的制备及其吸附性能研究进展[J]. 中国粉体技术, 2021, 27(1): 1-10.
[9]吴帅, 侯太磊, 闫良国. 膨润土和磁性膨润土微球的制备及其对水中碱性染料的吸附性能[J]. 中国粉体技术, 2020, 26(3): 7-14.
[10]WEI S, GAO L, XU S, et al. A novel route with a Cu(II)-MOF-derived structure to synthesize Cu/Cu2O NPs@graphene: the electron transfer leads to the synergistic effect of the Cu(0)-Cu(I) phase for an effective catalysis of the Sonogashira cross-coupling reactions[J]. Dalton Transactions, 2018, 47: 5538-5541.
[11]ZHANG T, YUE X, GAO L, et al. Hierarchically porous bismuth oxide/layered double hydroxide composites: preparation, characterization and iodine adsorption[J]. Journal of Cleaner Production, 2017, 144(15): 220-227.
[12]LIU S, WANG N, ZHANG Y, et al. Efficient removal of radioactive iodide ions from water by three-dimensional Ag2O-Ag/TiO2 composites under visible light irradiation[J]. Journal of Hazardous Materials, 2015, 284: 171-181.
[13]KRUMHANSL J L, NENOFF T M. Hydrotalcite-like layered bismuth-iodine-oxides as waste forms[J]. Applied Geochemistry, 2011, 26(1): 57-64.
[14]ZHANG X, GU P, LI X, et al. Efficient adsorption of radioactive iodide ion from simulated wastewater by nano Cu2O/Cu modified activated carbon[J]. Chemical Engineering Journal, 2017, 322: 129-139.
[15]CHEN J Y, GAO Q H, ZHANG X M, et al. Nanometer mixed-valence silver oxide enhancing adsorption of ZIF-8 for removal of iodide in solution[J]. Science of the Total Environment, 2018, 646: 634-644.
[16]赵瑨云, 胡家朋, 林皓,等. Ag+改性羟基磷灰石制备及其除氟抑菌特性研究[J]. 硅酸盐通报, 2020, 12: 3977-3984.
[17]ZHANG S Y, LIU H, SUN C C, et al. CuO/Cu2O porous composites: shape and composition controllable fabrication inherited from metal organic frameworks and further application in CO oxidation[J]. Journal of Materials Chemistry A, 2015, 3(10): 5294-5298.
[18]YAN S, PAN Y M, WANG L, et al. Effects of calcination temperature on the microstructure and adsorption properties of attapulgite microspheres[C]. Materials Science Forum, 2018, 913: 907-916.
[19]SUN Q, HU X, ZHENG S, et al. Influence of calcination temperature on the structural, adsorption and photocatalytic properties of TiO2 nanoparticles supported on natural zeolite[J]. Powder Technology, 2015, 274: 88-97.
[20]MAO P, LIU Y, JIAO Y, et al. Enhanced uptake of iodide on Ag@Cu2O nanoparticle[J]. Chemosphere, 2016, 164: 396-403.
[21]MAO P, LIU Y, LIU X D, et al. Bimetallic AgCu/Cu2O hybrid for the synergetic adsorption of iodide from solution[J]. Chemosphere, 2017, 180: 317-325.