较其他肺部给药方式,如定量吸入气雾剂(metered-dose inhalaer, MDI)、软雾剂(soft mist inhaler, SMI)和雾化剂(nebulizer, NEB)等,干粉吸入剂(dry powder inhaler, DPI)是肺部给药技术发展历程中的重要突破。DPI操作简单、易于携带,患者依从性高。为实现良好的肺部递送效果,通常认为颗粒的空气动力学直径应在0.5~5 μm内[1]。小颗粒具有较高的表面能,会倾向于通过彼此粘结或是粘到与之接触的表面上来降低表面能,形成的聚集体体积较大,十分不利于患者吸入[2]。解决上述问题是提高干粉吸入剂肺部沉积的主要挑战。常规的实心粒子显然无法满足对粒子性能的需求,而复杂结构的粒子却很难通过常规的方法来设计,因而,可以借助粒子工程技术来为微粒结构的合理设计提供理论框架。目前有许多可用于生产吸入性干粉颗粒的粒子工程技术,常用的包括微粉化、结晶法、冷冻干燥系统和缓控释递药系统。E-mail: maoshirui@vip.sina.com。
法、喷雾干燥法、喷雾冷冻干燥法和超临界流体技术等[3]。使用不同技术生产的粉末具有不同的物理特性,会对颗粒的行为和性能有很大的影响。例如,球磨法可以将药物晶体粉碎成细小的颗粒,但这一过程会限制粒子的形状和形态;利用气流粉碎机粉碎药物可以很好的控制粒子的粒径分布,但是不规则的粒子形状以及高黏结性的粉末会使后续的加工过程变得更复杂;喷雾冷冻干燥产生的多孔颗粒具有良好的雾化性能,然而与该过程相关的压力可能对产品造成不可逆的损坏,且工艺复杂、耗时、费用高;与喷雾冷冻干燥类似,冷冻干燥也是一种适用于生产高度热敏化合物的干粉颗粒的技术,但该技术对粒度分布的控制有限。
喷雾干燥技术是目前食品、制药行业广泛应用的干粉制备方法,仅需要简单的操作步骤就能得到具有理想粒度分布、粗糙度、孔隙率等性质的药物粉末,通过调节和控制相关参数甚至可以对粉末的堆积密度、流动性和分散性等宏观粉末特性进行优化,十分利于制备肺部干粉吸入制剂[4]。本文中介绍了喷雾干燥法制备干粉吸入剂的基本原理,以及提高干粉吸入剂肺部沉积的粒子工程策略,包括控制粒子空气动力学直径、密度和进行表面疏水处理,并结合最新的研究实例对这些策略进行说明。
1 喷雾干燥
1.1 喷雾干燥原理
喷雾干燥操作简便,仅需要一步就可以将液体原料(溶液、悬浮液或乳液)转化为干燥颗粒。可以通过调节进料液性质[5](如溶剂组成、溶质浓度、溶液黏度以及表面张力等)以及工艺参数[6](如喷嘴性质、进气-液速度、干燥温度以及干燥速度等)来灵活调控颗粒特性,包括粒径、形状、密度、表面性质等。
通过将原料溶解(或分散)在液体介质中来制备原料液,然后将原料液泵入雾化器。雾化器将原料液雾化成一定大小的液滴,接着液滴在与高温干燥气体的接触过程中发生传热和传质,随着溶剂的蒸发形成固体颗粒,最后利用气流分离并收集固体颗粒[7]。由于喷雾干燥是在一个密闭的环境中进行,随着干燥过程中水分的不断蒸发,雾化液滴的玻璃化转变温度(Tg)便会随之升高,直到高于自身温度,完全发生玻璃化转变。玻璃化转变是指玻璃态与高弹态之间的转变。当物料处于玻璃态时,分子链和链段均处于被冻结状态,表现出的力学性质与玻璃类似;当温度升高至使物料处于高弹态时,分子的热运动能量会带动链段自由运动,而整链的运动会被缠绕的分子链所限制,在宏观上表现为形变的可恢复性[8]。尽管物料自身可能具有较高的Tg,但是由于溶剂具有较低的Tg(例如水的为135 K),使得原料液的Tg也会较低。水含量对处方Tg的影响可用下式表示[9]:
(1)
式中:Tg,mix为混合后的的玻璃化转变温度;w1、w2分别为水和溶质的质量分数;Tg1、Tg2分别表示水和无水溶质的Tg;K为常数,可以认为是这2个组分的自由体积之比。
尽管喷雾干燥时间很短,但可以根据干燥速度将整个喷雾干燥过程分为3个阶段[10]:料液预热阶段、恒速干燥阶段、减速干燥阶段。喷雾干燥开始时,干燥速度会在极短的时间内升至最高,常温的雾化液滴会被周围的热空气加热至干燥空气的湿球温度(Tw),此时雾化液滴的温度高于原料液的Tg,为料液的预热阶段。在恒速干燥阶段,液滴的固体含量对干燥过程的影响可以忽略不计。此时,液滴表面的水分子会蒸发到周围的空气中,并且会通过扩散、对流或毛细作用从液滴中心迁移到表面。含水量减少导致雾滴的Tg不断升高。随着热量不断的从干燥气体传给雾滴,溶剂不断蒸发直至达到临界含水量,液滴表面开始固化,标志着进入减速阶段。进入降速阶段后,由于干燥空气提供的热量大于水分迁移和蒸发所需的热量,雾化液滴在固化的同时温度会不断升高,同时,水分减少也会导致颗粒的Tg升高。直至颗粒的Tg高于颗粒本身的温度,颗粒完成由外到内的玻璃化转变。
1.2 粒子的形成
干燥从原料液雾化后瞬间开始。深入了解干燥动力学,将有利于对粒子性质进行设计。
1.2.1 组分重分布
在蒸发过程中,液滴内各组分的重新分布是粒子工程的一个关键特征。在液滴蒸发过程中,溶质的径向浓度分布受2种相互作用机制的控制:液滴表面的后退和溶质从液滴表面向低浓度核心的扩散。液滴表面溶剂的持续减少导致溶质局部浓度增加,从而在液滴表面和中心之间产生了浓度梯度,促使表面的溶质向液滴中心扩散(由于雾化液滴的尺寸很小,这里忽略了对流)。通过分析蒸发液滴内部的扩散运动,可以预测某一组分的最终径向分布。Vehring-Foss-Lechuga(VFL)[7, 11]模型是一种广泛应用于理解干燥过程中颗粒形成的方法,在一维对称球的材料性质、扩散速率和蒸发速率不变的情况下,使用无量纲的Péclet数(Pe)来简化描述受蒸发速率(κ)和溶质i扩散系数(Di)控制的液滴表面后退情况[12]:
(2)
Pei可以进一步表示为一种竞争关系的时间尺度,即颗粒的表面组成是由某一组分分子扩散的时间和液滴干燥时间共同决定的[13-14]:
(3)
式中:τc为溶解或分散的组分从雾化液滴边缘扩散到中心所需时间;τd是对流喷干液滴所需要的时间,也可称为液滴寿命;Rdrop是雾化液滴的半径。
Di是液体原料中的溶质或分散颗粒的扩散系数,可以用斯托克斯-爱因斯坦方程来进行估算[13]:
(4)
式中:kB为波兹曼常数(1.38×1023 J/K);T为干燥温度;η为溶剂黏度;RH为溶质流体学半径。由式(4)可知,当RH较小时,溶质的扩散系数较大,溶解的溶质会迅速在液滴内扩散,干燥后粒子内溶质呈均匀分布的状态。
当溶质Pe较大时,液滴表面后退速度比溶质向中心扩散的速度更快,这导致表面溶质浓度远高于核心[15]。这种影响可以使用表面富集值(E)来量化,即利用溶质在液滴表面浓度(Cs)与其在液滴内的平均浓度(Cm)的比值来表示[7]。对于溶质i来说,它的表面富集值(Ei)可通过以下公式进行计算:
(5)
(6)
式中Cm,i可以通过在t时刻的质量平衡得到[7]:
(7)
式中:C0,i为溶液中溶质i的初始浓度。
利用上述公式,在蒸发过程中的任何时候,各组分的液滴表面浓度都可以使用Pe函数来预测。即Pe大的组分将富集在颗粒表面形成壳层,Pe小的组分被截留在核内;当仅含有一种Pe大的组分时,得到的将是空心粒子,反之,得到的将是实心粒子(如图1所示)[16]。由以上内容不难看出,溶质在原料液中的溶解度对粒子的形成以及干燥粒子中溶质的分布有着至关重要的作用。除了溶解度外,溶质Pe的大小也可以通过调节工艺参数来控制。
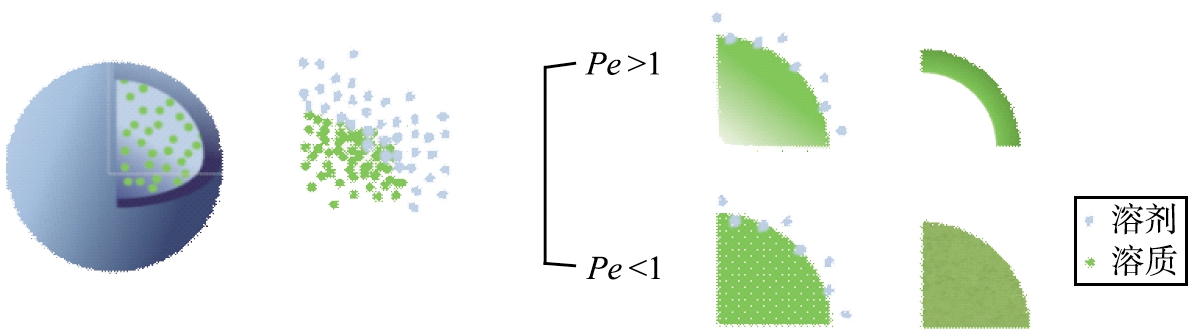
图1 喷雾干燥过程中液滴的变化示意图[16]
Fig.1 Schematic diagram of droplet formation process during spray drying
1.2.2 固化
当液滴表面溶质浓度达到临界值时,即达到临界过饱和度(结晶壳)或是接近溶质真实密度的浓度(非结晶壳)时,壳层便开始形成[17]。如果干燥速率较快,则在干燥过程早期就会达到临界浓度,产生的颗粒将保持球形;如果干燥缓慢,在干燥早期形成的薄壳将倾向于跟随液滴表面一起后退,直到厚度稳定到足以维持颗粒结构,干燥颗粒的形状将偏离球形。
1)非结晶组分
各组分在溶剂中的溶解度对颗粒的最终性质有很大影响,一种溶解度很高的组分,在液滴干燥期间不太可能达到过饱和,并开始成核和晶体生长。在这种情况下,这种溶质的干燥颗粒将以无定形固体形式存在[18]。当溶质i在液滴表面的局部密度达到其无定形固体真实密度(ρt,i)时,溶质i会在液滴表面形成壳层,发生相变的时间τt,i可以通过公式(8)来估算[18]:
(8)
2)结晶组分
当仅含有一种溶解度较低的溶质时,将会很容易在液滴表面达到过饱和并开始成核。由于形成的晶体实体迁移率较低,导致晶体会在液滴表面继续生长,直至形成的晶体外壳将液滴完全包围,剩余的溶剂只能通过结晶壳中的孔隙离开[18]。在这种情况下,颗粒的形态不仅取决于溶质i达到过饱和所需的时间(τsat,i),见公式(9),还取决于晶体生长所需时间。如果溶质在达到过饱和浓度(Csol,i)时立即开始结晶,则可用于晶体生长的时间(Δtc)可用公式(10)表示[7]:
(9)
(10)
式中:d0为初始液滴的直径。Δtc也可称为结晶窗口,是一个用来简化描述结晶时间与达到恒定空气动力学直径的时间之间的时间尺度。在这里,空气动力学直径恒定是假设在所有溶剂都挥发的那一刻。Δtc越小,溶质成核和晶体生长的时间越短,意味着微粒粒径小、晶体尺寸小、表面光滑、晶体含量低、孔隙率小[19]。Baldelli等[19]研究了Δtc对硝酸钠干燥颗粒形貌的影响。结果表明,当Δtc>200 ms时,干燥后得到的光滑球形颗粒的粒径大、结晶性好;当Δtc减少到100 ms时,得到的颗粒包含单个晶体;而进一步缩短Δtc至约20 ms得到的是完全无定形的颗粒。由此不难看出,Δtc对干燥微粒性质有很大影响,足够的结晶时间将得到结晶度高、晶体尺寸大、孔隙率高的微粒,即低密度微粒。
在包含2种结晶组分的二元体系中,每种组分都会以与单一组分体系相同的方式开始成核和结晶生长。先达到过饱和的组分将构成壳的外表面,另一组分将构成壳的内表面,因此,可以通过调整组分的初始浓度来优化各组分达到过饱和的时间τsat,i,进而优化壳体的结构。
1.2.3 固化后形态改变
完全包围液滴的壳层形成后,剩余溶剂的蒸发将导致液滴的形态发生改变[7]。一般来说,颗粒的形态由蒸发时间和干燥时间的平衡、扩散速度和壳层柔软度决定[20]。进料浓度可以通过影响壳层厚度来影响壳层的柔韧性。对硬壳来说,撕裂通常会发生在壳层最薄弱处。由于弯月面效应,内部液体会向内拉扯撕裂的边缘,当干燥温度低于溶剂沸点时,溶剂蒸发会留下向内的气孔;当干燥温度高于溶剂沸点时,内部气体压力的积累将会导致壳体破裂,因此形成向外的吹孔[18]。与硬壳不同,软壳倾向于通过折叠来填补内部空隙(皱缩)。Baldelli等[21]比较了在4种不同工艺条件下,以丙酮为溶剂喷雾干燥制备醋酸丁酸纤维素颗粒的性质,得到的Pe分别为46、63、63和77,Ei分别为15、20、21和25,而颗粒密度分别为38.7、422、728、930 kg/m3。显然该实验结果与前面的讨论不符。这是因为溶质Pe较高导致壳层较薄,容易在壳形成后发生弯曲和折叠,进而导致颗粒密度增加,粒子截面和粒子内部的聚焦离子束实验结果也证明了这一点。
1.3 喷雾干燥工艺对粒子性质的影响
虽然喷雾干燥是一种简单的粒子制备方法,但颗粒形成过程依赖于多个处方和工艺参数。一旦雾化后的原料液与干燥气体接触,溶剂会迅速从液滴表面形成的饱和蒸汽膜中蒸发。液滴与干燥气体之间的温度、水分梯度会导致2者之间发生强烈的传热传质耦合。以实验室常用的喷雾干燥设备Buchi-290为例,如图2所示[22]。合理设计的干燥室以及适当的气体流速为液滴在干燥室中的停留提供了足够的时间,能够保证在产品温度上升到出口温度之前完成溶剂的去除。干燥颗粒从干燥气体中的分离可以划分为2个部分:干燥产品的初级分离,用于收集未完全干燥的液滴;干燥产品经旋风分离器分离后的完全回收。
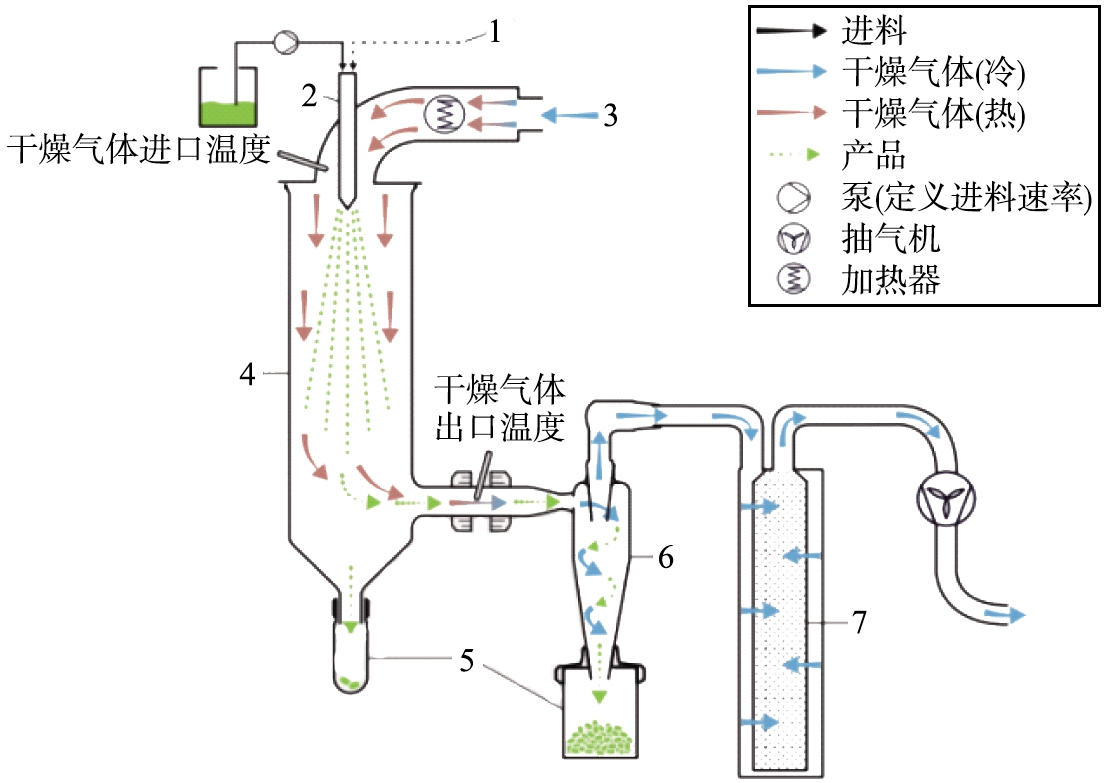
1—自动喷嘴清洁系统;2—喷嘴;3—进气口;4—喷雾干燥圆筒;5—收集容器;6—旋风分离器;7—出口过滤器。
图2 B-290喷雾干燥仪的流程示意图[22]
Fig.2 Schematic picture of mini spray dryer B-290
深入理解喷雾干燥工艺对粒子性质的影响将更有利于粒子的设计,例如,降低气体流速将会延长液滴的蒸发时间,得到的大部分粒子粒径较小,但是这些小粒子会经旋风分离器分离后被排出,大大降低产品的收率;另一方面,虽然高气体流速意味着液滴蒸发更快,能够在提高产品粒径的同时提高收率,但是较短的结晶时间也会导致产品的结晶度更低,带来稳定性问题[23]。对于喷雾干燥来说,最终产品处于玻璃态是一种最为稳定的物理状态,而影响Tg的因素主要是水分含量、产品的相对分子质量大小、分子链结构形态等。根据Hancock等[24]的建议,Tg应至少高于储存温度(Ts)50 ℃,以保持长期的物理化学稳定性,即Tg-Ts≥50 ℃。目前常用的提高原料液Tg的方法有以下4种:1)可以通过减少原料液的含水量,使得雾滴开始时就具有较高的Tg,从而在喷雾干燥时能迅速的形成玻璃态固体;2)在处方允许的情况下,可以向其中加入一些赋形剂来提高原料液的Tg,使得在同样的干燥温度条件下雾滴更容易转变为玻璃态;3)提高原料液进料时的温度,缩短预热时间;4)在原料液物理性质允许的条件下,尽量提高喷雾干燥的进口温度,加快干燥速度,加快玻璃态固体的形成。
喷雾干燥过程中溶质的Pe大小由影响溶质扩散速率和(或)溶剂蒸发速率的因素来决定。其中,溶剂蒸发速率与干燥温度呈正比关系,也就是说,在粒子稳定性范围内,提高干燥温度将会增加Pe,有利于溶质在液滴表面富集,从而影响最终产品的微观结构[25]。Vicente等[20]的实验结果表明,干燥温度对粒子的形状有很大影响。在高黏度和固体浓度的情况下(流动性受限),较高的蒸发速率将会产生近乎完美的球形颗粒,然而,在干燥温度较低的情况下,溶质扩散和壳层运动的时间将会变长,以至于最终观察到的粒子呈皱缩状。另一方面,由于高流动性溶液的固体含量较低,外壳变得更薄,更容易发生膨胀、皱缩或破碎等现象,并且无法得到球形颗粒(即使在更高的蒸发速率条件下),因此,确定一个能稳定颗粒形状的最低固体浓度是十分重要的,低于该浓度时的颗粒大小将取决于壳层的迁移速率,而不是液滴大小。
2 提高干粉吸入剂肺部沉积的粒子工程策略
2.1 优化空气动力学直径
干粉吸入剂的性能取决于多种粒子性质。受肺解剖学和生理学上的复杂性影响,吸入颗粒的到达位置主要由雾化粉末颗粒的空气动力学直径da决定[26],见公式(11)。da是用来描述粒子运动的一种假想粒径,它被定义为与被测颗粒具有相同沉降速度的单位密度球体的直径[7]:
(11)
式中:ρP为颗粒密度,即颗粒的质量除以几何直径为dg的球体的体积(包括内部和外部空隙);X为动态形状因子,是非球形下落粒子所受的实际阻力与相同体积的球体所受阻力之比,它通过影响粒子的空气动力学行为来影响粒子的沉积行为[27]。
理论上,有相同空气动力学直径的粒子在肺部会有相似的沉积行为,而实际上即使da相同,粒子形状也会对沉积行为有所干预[28]。对于喷雾干燥制备的粒子来说,由于大部分粒子是形状规则的球体,为了简化理解,一般假设X=1。当颗粒的da在1~5 μm范围时,绝大部分颗粒会沉积在小气道和肺泡区,而>5 μm的颗粒通常通过惯性撞击沉积在上呼吸道或滞留在吸入器装置中,<0.5 μm的颗粒容易随呼吸呼出[4],因此,根据式(11),可以通过对颗粒几何粒径、密度或形状的调整来优化粒子的空气动力学直径在0.5~5 μm范围,提高药物的肺部沉积。
将喷雾干燥的球形颗粒的几何直径dg表示为配方和工艺变量的函数,可以推导出干燥颗粒几何直径的表达式[29]:
(12)
式中:CF为进料溶液浓度;dD为初始液滴直径。
将式(12)代入式(11),可得到式(13):
(13)
式(12)和式(13)表明,喷雾干燥颗粒的dg和da主要由进料溶液浓度CF和初始液滴直径dD决定。也就是说,在处方确定后,液滴尺寸分布的变化(工艺放大)或进料浓度的增加(提高收率)也会导致颗粒的空气动力学特性发生显著变化。Vicente等[20]的实验表明,在稀溶液中,随着溶液浓度的增加,会导致颗粒的粒径增加;而对于高浓度溶液来说,提高溶液浓度对粒径没有显著影响。除了溶液浓度之外,喷雾干燥参数也对粒径有很大影响,如气体流速和进料速度。当气体流速很快时,意味着进料溶液雾化后得到的雾化液滴很小,相应的,固化后得到的粒子粒径也较小。提高进料速度后,之前的气体流速将无法保证对液体的充分分散,并且由于液滴挥发所需能量提高,这种情况下液滴的干燥速度极慢,得到的大部分为大粒子。
2.2 降低颗粒密度
根据前面的讨论不难看出,Pe对粒子的密度有很大的影响,它通过影响某一组分在表面的富集程度来改变粒子的结构。简单来说,Pe大,溶质扩散速度慢,使表面富集高,富集的溶质会在液滴完全干燥之前在液滴表面固化,从而得到中空颗粒;反之,Pe小得到的则是致密的固体颗粒。当高Pe组分富集在表面时,一旦达到临界浓度,就会触发不同的固化机制。溶质在沉淀窗口期间可能没有足够的时间结晶,但是随着溶液黏度增加,可能会形成壳;具有高初始饱和度和快速结晶动力学的分子可以分离成晶相,混悬的材料可以形成复合壳。无论壳的形成机理是哪种,该过程都是从表面开始的。最终得到的颗粒可以具有一系列不同的形态,这取决于它们的尺寸和壳层在干燥过程最后阶段的性质。相关数据表明,当堆密度<0.4 g/cm3时,粉末的气溶胶性能会大幅度提高[26, 30]。根据式(12),在dg一定的情况下,低密度粒子的da更小。基于这种关系,Edwards等[31]提出了在肺部递送方面取得突破性进展的大多孔颗粒(ρ<<1 g/cm3和dg≥5 μm)。这些多孔颗粒的粒径符合1 μm≤da≤5 μm的要求范围,专门设计用于替代传统的小的无孔药物颗粒。由于其较大的尺寸,多孔颗粒具有更好的流动性,并且能够避开吞噬清除机制,使得吸入药物的治疗效果提高,且大多孔颗粒比小的无孔颗粒聚集更少,并且也更容易解聚[32],它们可以通过乳化溶剂挥发法[31]或喷雾干燥法[33-34]制备。
对于Edwards等开发的大多孔颗粒来说,为了提高其肺部递送效率,需要采用适当的手段降低其密度,然而这种密度非常低的大多孔颗粒并不适于抗生素和其他高剂量治疗药物的输送,因为无法设计出合理的给药剂量。PulmoSphereTM技术创建出的低密度海绵状颗粒为以上问题提供了新的解决方案[14]。PulmoSphere颗粒由小的多孔颗粒组成(1 μm≤dg≤5 μm),与几何直径更大的大多孔颗粒相比,PulmoSphere颗粒的优势在于所占胶囊体积相同时,能够提供更高剂量的粉末,使其能够在提高干粉吸入剂肺部递送效率的同时满足大剂量给药需求。PulmoSphereTM技术制备时,处方中含有以液态氟烷为分散相的水包油乳剂,并使用磷脂作为乳化剂。当液滴因连续相蒸发而收缩时,磷脂在表面富集、阻碍聚合。当分散相的纳米液滴紧密堆积时,液滴停止收缩,相界面形成壳层,随后干燥、固化。随着分散相的蒸发,之前纳米液滴占据的空间以空隙形式存在,即构成低密度中空、海绵状颗粒。该技术最初用于抗哮喘药物(如色甘酸钠、沙丁胺醇硫酸盐和富马酸福莫特罗),目前在上市产品中广泛用于大剂量抗生素(如妥布霉素、环丙沙星)的肺部递送[35-36]。
2.3 表面疏水处理
在理想情况下,干粉吸入剂具有足够的流动性、分散性和储存稳定性等理想特性,能够确保从吸入装置中排出药物粉末剂量的均一性以及可重复性。虽然喷雾干燥广泛应用于干粉吸入剂的制备,但是这种方法最大的缺点在于得到的药物粒子大多以无定形形式存在。无定形的药物和赋形剂会吸收大气中的水分,改变颗粒的表面能,并在毛细管力和重结晶作用下发生聚集,严重影响粉末的分散性能以及药物的肺部沉积[37-38]。使用疏水成分(如氨基酸、金属硬脂酸盐或疏水性API)对微粒进行表面处理,可以避免水分对无定形药物微粒气溶胶性能的影响,延长干粉吸入剂的储存时间,相关的应用实例见表1。
表1 喷雾干燥中用于粒子表面疏水处理的赋形剂
Tab.1 Excipients used for particle surface hydrophobic treatment in spray drying

赋形剂原理模型药物参考文献亮氨酸 一种表面活性剂,能够降低含水原料液的表面张力,减小雾化液滴尺寸[39]。当存在2种或2种以上化合物时,雾化液滴的表面会被亮氨酸分子占据,且亮氨酸的疏水侧链指向空气,亲水部分朝向液滴内部[40]。随着液滴中的水分不断蒸发,液滴表面的亮氨酸浓度增加,直到过饱和比高于理论计算值后(即液滴表面需要积累一定量的晶体),形成亮氨酸壳。在蒸汽压力下,形成的亮氨酸晶体外壳会进一步发生塑性膨胀形成波纹表面[41]贝达喹啉色甘酸二钠环丙沙星异烟肼卡那霉素阿奇霉素[42][43][44][45][46][47]三亮氨酸 由3个L-亮氨酸通过肽键结合而构成,更大的分子结构使其在相同条件下比亮氨酸扩散更慢、在液滴表面的富集程度更高[48]异烟肼[48]硬脂酸钠 当含量较低时,硬脂酸钠将聚集在液滴-空气间的界面上,随着溶剂挥发而沉积在干燥粒子的表面,导致表面钠含量提高,大大提高粉末的细颗粒组分(FPF)。含量过高时,亲脂性的硬脂酸钠会在液滴内部形成分子迁移率较低的胶束,形成的胶束会随着溶剂的挥发而聚集在液滴内部,导致干燥粒子表面钠含量降低,FPF降低[37]妥布霉素[37]疏水性API 利用API的疏水性(如利福平、阿奇霉素等),构建复合颗粒的疏水表面卡那霉素粘菌素[49][50-51]
疏水性氨基酸,如亮氨酸、缬氨酸和蛋氨酸对无定形粉末的保护作用已被广泛研究。由于具有表面活性,这些氨基酸会在蒸发过程中倾向于较早地沉积在液滴表面,从而在干燥粒子上形成疏水壳层。亮氨酸是一种弱表面活性剂,考虑到其水中溶解度较低[52],合理调整配方组成和喷雾干燥参数可以使亮氨酸在蒸发早期沉淀在液滴表面,从而在药物周围形成亮氨酸晶体外壳,减少水分与颗粒表面之间的相互作用[43],并降低颗粒间内聚力、提高粉末分散性[52-53]。当溶液中含有多种组分时,亮氨酸的初始含量将会直接影响到干燥粒子表面的亮氨酸含量。Li等[54]在对含有硫酸沙丁胺醇和亮氨酸的溶液喷雾干燥后发现,随着亮氨酸初始含量的增加,干燥粒子表面的亮氨酸含量将会以“S”型增加,即在亮氨酸初始含量为20%和40%(体积分数)时存在转折点。具体来说,通过X-射线光电子能谱(XPS)实验发现,当亮氨酸的初始含量在20%时,干燥粒子表面仅有20%(摩尔分数)由亮氨酸覆盖;随着亮氨酸初始含量由20%增加至40%(体积分数),亮氨酸在表面的覆盖率可增至72%(摩尔分数);而在初始含量高于40%(体积分数)后,继续提高初始含量对颗粒表面亮氨酸覆盖率影响不大,当含量增加至80%(体积分数)时,亮氨酸在颗粒表面的覆盖率虽然能够提高到88%(摩尔分数),但这样的处方不利于需要大剂量给药的药物。异烟肼是一种一线抗结核药物,Sibum等[48]通过在异烟肼表面进行疏水涂层来避免在储存过程发生由于药物分解、结晶引起的聚集。实验比较了L-亮氨酸和三亮氨酸壳层对粉末稳定性的影响,结果表明,添加5%(体积分数)的L-亮氨酸并不能对粉末起到水分保护作用,而3%(体积分数)的三亮氨酸却可以使粉末在相对湿度为75%时稳定3个月。这样的实验结果与2者不同的分子结构有着密切的关系。三亮氨酸是由3个L-亮氨酸通过肽键结合而构成,更大的分子结构使其在相同条件下比亮氨酸扩散更慢、在液滴表面的富集程度更高,能够为干燥粒子提供更好的抵御水分的能力。虽然表面富集程度对粒子的物理稳定性有一定的影响,但是三亮氨酸形成的无定形壳层却比亮氨酸形成的结晶壳层表现出更优越的阻碍粒子结晶的效果,目前的理论无法进行解释,其中的具体机制仍有待研究。在另一项研究中,Yu等[55]以色甘酸二钠(DSCG)为模型药物,分别考察了异亮氨酸、缬氨酸以及蛋氨酸在防止DSCG吸潮、改善粉末雾化性能方面的效果。虽然在体外气溶胶性能实验中,这3种氨基酸均表现出良好的防潮效果,但是在质量浓度相同的条件下,这些氨基酸在颗粒表面的覆盖率(异亮氨酸>蛋氨酸>缬氨酸)既不遵循溶解度排序(缬氨酸>异亮氨酸>蛋氨酸)[56],也不遵循氨基酸侧链的亲水性排序(异亮氨酸>缬氨酸>蛋氨酸)[57]。事实上,干燥过程是十分复杂的,以上述研究为例:3种氨基酸在干燥粒子表面的覆盖率不仅取决于氨基酸和药物在溶剂中的相互作用,还取决于在雾化液滴干燥时影响壳层性质的因素,如干燥速率、各组分的溶解度和疏水性等。由于氨基酸仍缺乏在市售吸入产品中的毒性数据,使其在干粉吸入剂制备中的应用很受限。
除了氨基酸以外,金属硬脂酸盐也可用于水分保护[58]。硬脂酸镁是一种疏水性润滑剂,已经批准用于为DPI产品提供防潮保护。在与微粉化API混合之前,将硬脂酸镁颗粒添加到乳糖载体颗粒中,通过部分涂覆来降低乳糖载体颗粒与微粉化API颗粒之间的黏附力,以此来改善API颗粒与乳糖载体颗粒之间的分离,提高雾化性能[59]。这种由乳糖和硬脂酸镁构成的双赋形剂递送平台(DEP)已经广泛应用于DPI产品中,例如Relvar® Ellipta®、Seebri® Breezhaler®、Foster® NEXThaler®以及Ultibro® Breezhaler®等[60]。除此之外,也可以使用气流磨(jet-mill)对颗粒表面进行硬脂酸镁干燥涂层,形成的涂层膜表面能低,有利于减少粒子间的相互作用力、改善吸入粉末的雾化性能并减少药物粉末在吸入装置中的滞留[45,61],然而,硬脂酸镁在水和有机溶剂中的溶解度较差,严重影响了其在喷雾干燥中的应用。相比之下,硬脂酸钠更容易溶于水或共溶剂体系(例如在40 ℃条件下,硬脂酸钠在体积分数为50%的乙醇溶液中溶解度>10 mg/mL,而硬脂酸镁溶解度<0.1 mg/mL),能够提高粉末表面结晶度,更广泛地用于减少颗粒之间的聚集[58, 62]。Parlati等[37]研究了喷雾干燥制备含有硬脂酸钠的妥布霉素干粉吸入剂的肺部递送效果。由于硬脂酸钠的水溶性远低于妥布霉素,所以2者共喷雾干燥后,得到的干燥粒子表面将主要由硬脂酸钠构成。实验结果表明,添加1%(体积分数)硬脂酸钠的妥布霉素溶液喷干后,干燥粒子在体积流量为60 L/min时FPF高达(84.3±2.0)%(为最高值),而喷雾干燥得到的妥布霉素纯药物粉末FPF仅为(27.1±1.9)%。虽然粒子表面钠含量较高有利于降低相邻粒子之间的界面张力、提高雾化效率,但是硬脂酸钠浓度、气溶胶和沉积性能之间的关系并不是线性的。当硬脂酸钠浓度较低时,硬脂酸钠将聚集在液滴-空气间的界面上,随着溶剂挥发而沉积在干燥粒子的表面,导致表面钠含量提高;当硬脂酸钠的体积分数高于2 %时,亲脂性的硬脂酸钠将会在液滴内部形成分子迁移率较低的胶束,形成的胶束会随着溶剂的挥发而聚集在液滴内部,导致干燥粒子表面钠含量降低,粉末的FPF降低。
同样地,将2种API共喷雾干燥(co-spray drying)也可以构建出疏水性的表面,如使用疏水性抗生素时(如利福平、阿奇霉素等)。Zhou等[51]基于黏菌素和利福平对鲍曼不动杆菌(A. baumannii)和铜绿假单胞菌(P. aeruginosa)的协同抗菌活性,采用共喷雾干燥法制备了含有黏菌素和利福平的复合颗粒,大大降低了黏菌素的耐药性[63]。通过100 L/min的Aerolizer设备测得的排放量>90%,总FPF约为92%。颗粒形状与单独喷雾干燥利福平颗粒类似,均呈褶皱片状。当储存湿度从60%增加到75%时,纯黏菌素粉末的FPF从80%减少到63.2%,相较而言,复合粉末的FPF变化不大。这可能是因为在喷雾干燥过程中,疏水性利福平会比黏菌素更早地沉积在表面,形成的疏水表面能够为复合粉末提供水分保护,XPS和飞行时间二次离子质谱(ToF-SIMS)的分析结果也证实了这一点。虽然由疏水性API构成的联合处方可以为粒子提供足够的水分保护,但是只有少数几种API具有协同效应,并且可以提供水分保护的API剂量和治疗剂量之间也很难协调。
微粒表面经疏水处理后,可为无定形药物提供足够的水分保护,避免微粒在储存或吸入过程中的聚集,为延长喷雾干燥微粒稳定性提供了一个可行的方案,但是,目前研究中使用的疏水辅料大多不满足肺部安全性的要求,大大限制了DPI产品的进一步发展,开发出更多的肺部吸入安全的辅料是一项亟待解决的问题。
3 结语
喷雾干燥颗粒用于肺部给药的主要优势在于可以通过操纵和控制各种参数实现对颗粒特性的优化。在此基础上,结合粒子工程技术与合适的赋形剂,可以获得具有理想特性的喷雾干燥颗粒,使其最大限度地沉积在肺部靶向部位。优化颗粒空气动力学直径、降低颗粒密度以及对微粒进行表面疏水处理,这3种方法是目前利用喷雾干燥开发DPI产品的常用手段。利用这些方法,可以弥补喷雾干燥微粒在粉末流动性、分散性以及药物稳定性等方面存在的不足,有助于开阔DPI市场。
[1]KADOTA K, SOSNOWSKI T, TOBITA S, et al.A particle technology approach toward designing dry-powder inhaler formulations for personalized medicine in respiratory diseases[J].Advanced Powder Technology, 2020, 31(1): 219-226.
[2]HEALY A, AMARO M, PALUCH K, et al.Dry powders for oral inhalation free of lactose carrier particles[J].Advanced Drug Delivery Reviews, 2014, 75: 32-52.
[3]MOMIN M A M, TUCKER I G, DAS S C.High dose dry powder inhalers to overcome the challenges of tuberculosis treatment[J].International Journal of Pharmaceutics, 2018, 550: 398-417.
[4]PILCER G, AMIGHI K.Formulation strategy and use of excipients in pulmonary drug delivery[J].International Journal of Pharmaceutics, 2010, 392(1/2): 1-19.
[5]OGI T, NANDIYANTO A B D, OKUYAMA K.Nanostructuring strategies in functional fine-particle synthesis towards resource and energy saving applications[J].Advanced Powder Technology, 2014, 25(1): 3-17.
[6]OKUYAMA K, ABDULLAH M, LENGGORO I W, et al.Preparation of functional nanostructured particles by spray drying[J].Advanced Powder Technology, 2006, 17(6): 587-611.
[7]VEHRING R.Pharmaceutical particle engineering via spray drying[J].Pharmaceutical Research, 2008, 25(5): 999-1022.
[8]薛峰.喷雾干燥微胶囊化中的玻璃体形成[J].食品科学, 1999(4): 4-6.
[9]ROOS Y.Melting and glass transitions of low molecular weight carbohydrates[J].Carbohydrate Research, 1993, 238: 39-48.
[10]黄立新, 周瑞君, MUJUMDAR A S.喷雾干燥过程中产品玻璃化温度转变和质量控制[J].林产化学与工业, 2007, 27(1): 43-46.
[11]NANDIYANTO A B D, OKUYAMA K.Progress in developing spray-drying methods for the production of controlled morphology particles: from the nanometer to submicrometer size ranges[J].Advanced Powder Technology, 2011, 22(1): 1-19.
[12]VEHRING R, FOSS W R, LECHUGA-BALLESTEROS D.Particle formation in spray drying[J].Journal of Aerosol Science, 2007, 38(7): 728-746.
[13]TSAPIS N, BENNETT D, JACKSON B, et al.Trojan particles: large porous carriers of nanoparticles for drug delivery[J].Proceedings of the National Academy of Sciences of the United States of America, 2002, 99(19): 12001-12005.
[14]WEERS J, TARARA T.The pulmo Sphere platform for pulmonary drug delivery[J].Therapeutic Delivery, 2014, 5(3): 277-295.
[15]BORAEY M A, VEHRING R.Diffusion controlled formation of microparticles[J].Journal of Aerosol Science, 2014, 67: 131-143.
[16]WEERS J G, MILLER D P.Formulation design of dry powders for inhalation[J].Journal of Pharmaceutical Sciences, 2015, 104(10): 3259-3288.
[17]GAC J, GRADON L.A distributed parameter model for the spray drying of multicomponent droplets with a crust formation[J].Advanced Powder Technology, 2013, 24(1): 324-330.
[18]ALHAJJA N, O’REILLY N J, CATHCART H.Designing enhanced spray dried particles for inhalation: a review of the impact of excipients and processing parameters on particle properties[J].Powder Technology, 2021, 384: 313-331.
[19]BALDELLI A, POWER R M, MILES R E H, et al.Effect of crystallization kinetics on the properties of spray dried microparticles[J].Aerosol Science and Technology, 2016, 50(7): 693-704.
[20]VICENTE J, PINTO J, MENEZES J, et al.Fundamental analysis of particle formation in spray drying[J].Powder Technology, 2013, 247: 1-7.
[21]BALDELLI A, BORAEY M A, NOBES D S, et al.Analysis of the particle formation process of structured microparticles[J].Molecular Pharmaceutics, 2015, 12(8): 2562-2573.
[22]BUCHI.Mini Spray Dryer B-290(小型喷雾干燥仪)世界最领先的喷雾干燥研发解决方案[EB/ON].[2021-08-21]https://assets.buchi.com/image/upload/v1605791199/pdf/Brochures/PB_11592735_B-290_zh.pdf.
[23]CHAN HK, CHEW N Y K.Novel alternative methods for the delivery of drugs for the treatment of asthma[J].Advanced Drug Delivery Reviews, 2003, 55(7): 793-805.
[24]HANCOCK B C, SHAMBLIN S L, ZOGRAFI G.Molecular mobility of amorphous pharmaceutical solids below their glass transition temperatures[J].Pharmaceutical research, 1995, 12(6): 799-806.
[25]ZHANG X, GUAN J, NI R, et al.Preparation and solidification of redispersiblenanosuspensions[J].Journal of Pharmaceutical Sciences, 2014, 103(7): 2166-2176.
[26]GRADON L, SOSNOWSKI T R.Formation of particles for dry powder inhalers[J].Advanced Powder Technology, 2014, 25(1): 43-55.
[27]PILCER G, AMIGHI K.Formulation strategy and use of excipients in pulmonary drug delivery[J].International Journal of Pharmaceutics, 2010, 392(1/2): 1-19.
[28]HASSAN M S, LAU R W M.Effect of particle shape on dry particle inhalation: study of flowability, aerosolization, and deposition properties[J].AAPS Pharm Sci Tech, 2009, 10(4): 1252-1262.
[29]MAA Y F, NGUYEN P A, SIT K, et al.Spray-drying performance of a bench-top spray dryer for protein aerosol powder preparation[J].Biotechnology and Bioengineering, 1998, 60(3): 301-309.
[30]HEALY A M, AMARO M I, PALUCH K J, et al.Dry powders for oral inhalation free of lactose carrier particles[J].Advanced Drug Delivery Reviews, 2014, 75: 32-52.
[31]EDWARDS D A, HANES J, CAPONETTI G, et al.Large porous particles for pulmonary drug delivery[J].Science, 1997, 276(5320): 1868-1872.
[32]FRENCH D L, EDWARDS D A, NIVEN R W.The influence of formulation on emission, deaggregation and deposition of dry powders for inhalation[J].Journal of Aerosol Science, 1996, 27(5): 769-783.
[33]VANBEVER R, MINTZES J D, WANG J, et al.Formulation and physical characterization of large porous particles for inhalation[J].Pharmaceutical Research, 1999, 16(11): 1735-1742.
[34]DELLAMARY L A, TARARA T E, SMITH D J, et al.Hollow porous particles in metered dose inhalers[J].Pharmaceutical Research, 2000, 17(2): 168-174.
[35]GELLER D E, KONSTAN M W, SMITH J, et al.Novel tobramycin inhalation powder in cystic fibrosis subjects: pharmacokinetics and safety[J].Pediatric Pulmonology, 2007, 42(4): 307-313.
[36]STASS H, NAGELSCHMITZ J, WILLMANN S, et al.Inhalation of a dry powder ciprofloxacin formulation in healthy subjects: a phase istudy[J].Clinical Drug Investigation, 2013, 33(6): 419-427.
[37]PARLATI C, COLOMBO P, BUTTINI F, et al.Pulmonary spray dried powders of tobramycin containing sodium stearate to improve aerosolization efficiency[J].Pharmaceutical Research, 2009, 26(5): 1084-1092.
[38]BRUNAUGH A, SMYTH H.Formulation techniques for high dose dry powders[J].International Journal of Pharmaceutics, 2018, 547(1/2): 489-498.
[39]FERDYNAND M, NOKHODCHI A.Co-spraying of carriers(mannitol-lactose)as a method to improve aerosolization performance of salbutamol sulfate dry powder inhaler[J].Drug Delivery and Translational Research, 2020, 10(5): 1418-1427.
[40]ALHAJJ N, O'REILLY N J, CATHCART H.Leucine as an excipient in spray dried powder for inhalation[J].Drug Discovery Today, 2021, 26(10): 2384-2396.
[41]ORDOUBADI M, GREGSON F, WANG H, et al.On the particle formation of leucine in spray drying of inhalable microparticles[J].International Journal of Pharmaceutics, 2021, 592: 120102.
[42]MOMIN M, RANGNEKAR B, SINHA S, et al.Inhalable dry powder of bedaquiline for pulmonary tuberculosis: in vitro physicochemical characterization, antimicrobial activity and safety studies[J].Pharmaceutics, 2019, 11(10): 502.
[43]LI L, SUN S, PARUMASIVAM T, et al.L-leucine as an excipient against moisture on in vitro aerosolization performances of highly hygroscopic spray-dried powders[J].European Journal of Pharmaceutics and Biopharmaceutics, 2016, 102: 132-141.
[44]SHETTY N, PARK H, ZEMLYANOV D, et al.Influence of excipients on physical and aerosolization stability of spray dried high-dose powder formulations for inhalation[J].International Journal of Pharmaceutics, 2018, 544(1): 222-234.
[45]SIBUM I, HAGEDOORN P, FRIJLINK H, et al.Characterization and formulation of isoniazid for high-dose dry powder inhalation[J].Pharmaceutics, 2019, 233(11): 1-15.
[46]MOMIN M, SINHA S, TUCKER I, et al.Dry powder formulation of kanamycin with enhanced aerosolization efficiency for drug-resistant tuberculosis[J].International Journal of Pharmaceutics, 2017, 528(1/2): 107-117.
[47]MANGAL S, NIE H, XU R, et al.Physico-chemical properties, aerosolization and dissolution of co-spray dried azithromycin particles with l-leucine for inhalation[J].Pharm Res, 2018, 35(2): 28.
[48]SIBUM I, HAGEDOORN P, KLUITMAN M P G, et al.Dispersibilityand storage stability optimization of high dose isoniazid dry powder inhalation formulations with l-leucine or trileucine[J].Pharmaceutics, 2020, 12(1).
[49]MOMIN M, TUCKER I, DOYLE C, et al.Co-spray drying of hygroscopic kanamycin with the hydrophobic drug rifampicin to improve the aerosolization of kanamycin powder for treating respiratory infections[J].International Journal of Pharmaceutics, 2018, 541(1/2): 26-36.
[50]ZHOU Q, LOH Z, YU J, et al.How much surface coating of hydrophobic azithromycin is sufficient to prevent moisture-induced decrease in aerosolisation of hygroscopic amorphous colistin powder[J].AAPS JOURNAL, 2016, 18(5): 1213-1224.
[51]ZHOU Q T, GENGENBACH T, DENMAN J A, et al.Synergistic antibiotic combination powders of colistin and rifampicin provide high aerosolization efficiency and moisture protection[J].The AAPS Journal, 2014, 16(1): 37-47.
[52]GLI SKI J, CHAVEPEYER G, PLATTEN J-K.Surface properties of aqueous solutions of L-leucine[J].Biophysical Chemistry, 2000, 84(2): 99-103.
SKI J, CHAVEPEYER G, PLATTEN J-K.Surface properties of aqueous solutions of L-leucine[J].Biophysical Chemistry, 2000, 84(2): 99-103.
[53]FENG A L, BORAEY M A, GWIN M A, et al.Mechanistic models facilitate efficient development of leucine containing microparticles for pulmonary drug delivery[J].International Journal of Pharmaceutics, 2011, 409(1): 156-163.
[54]LI L, LEUNG S S Y, GENGENBACH T, et al.Investigation of L-leucine in reducing the moisture-induced deterioration of spray-dried salbutamol sulfate power for inhalation[J].International Journal of Pharmaceutics, 2017, 530: 30-39.
[55]YU J, CHAN H-K, GENGENBACH T, et al.Protection of hydrophobic amino acids against moisture-induced deterioration in the aerosolization performance of highly hygroscopic spray-dried powders[J].European Journal of Pharmaceutics and Biopharmaceutics, 2017, 119: 224-234.
[56]KEENER C R, FULLERTON G D, CAMERON I L, et al.Solution nonideality related to solute molecular characteristics of amino acids[J].Biophysical Journal, 1995, 68(1): 291-302.
[57]KYTE J, DOOLITTLE R F.A simple method for displaying the hydropathic character of a protein[J].Journal of Molecular Biology, 1982, 157(1): 105-132.
[58]CHANG R Y K, CHEN L, CHEN D, et al.Overcoming challenges for development of amorphous powders for inhalation[J].Expert Opinion on Drug Delivery, 2020, 17(11): 1583-1595.
[59]D Z, M B, WLJ H, et al.Natural and bioinspired excipients for dry powder inhalation formulations[J/ON].Current Opinion in Colloid & Interface Science, 2021, 56: 101497[2021-08-27]http://dx.doi.org/10.1016/j.cocis.2021.101497.
[60]SHUR J, PRICE R, LEWIS D, et al.From single excipients to dual excipient platforms in dry powder inhaler products[J].International Journal of Pharmaceutics, 2016, 514(2): 374-383.
[61]MANGAL S, PARK H, NOUR R, et al.Correlations between surface composition and aerosolization of jet-milled dry powder inhaler formulations with pharmaceutical lubricants[J].International Journal of Pharmaceutics, 2019, 568:118504.
[62]YU J, ROMEO M C, CAVALLARO A A, et al.Protective effect of sodium stearate on the moisture-induced deterioration of hygroscopic spray-dried powders[J].International Journal of Pharmaceutics, 2018, 541(1/2): 11-18.
[63]LEE H J, BERGEN P J, BULITTA J B, et al.Synergistic activity of colistin and rifampin combination against multidrug-resistant Acinetobacter baumannii in an in vitro pharmacokinetic/pharmacodynamic model[J].Antimicrobial Agents and Chemotherapy, 2013, 57(8): 3738-3745.