三水碳酸镁(MgCO3·3H2O)晶体为正碳酸镁单晶体, 结晶时原子构造排列高度有序, 晶体内部缺陷少, 强度值接近于理想晶体, 物理化学性能优越, 常被用作橡胶、 塑料等高聚合物的增韧补强剂和陶瓷等耐火材料的添加剂, 具有极高的工业价值[1-5]。 因为纯度高且热力学上属亚稳相等特性, 三水碳酸镁晶体常被用作生产碱式碳酸镁、 氧化镁、 无水碳酸镁等稳定相精细镁盐的中间产品[6-8]。
目前, 三水碳酸镁晶须常见的制备方法有共沉淀法、 水热法和碳酸化法等。 Botha等[9]通过向Mg(OH)2悬浊液中通入CO2, 升温后制得MgCO3·3H2O,考察反应温度、 pH值和盐酸对MgCO3·3H2O晶须形貌和结构的影响。Wang等[10]以MgCl2·6H2O和(NH4)2CO3为反应物,严格控制反应物初始浓度和反应温度等条件,制备长度为40 μm的MgCO3·3H2O晶须,并将产物于800 ℃温度条件下煅烧,获得高纯MgO。高玉娟等[11]以MgCl2·6H2O和NH4HCO3为反应物,通过改变碳酸氢铵和镁离子浓度,得到棒状、 放射状及颗粒状MgCO3·3H2O晶体。 赵斌等[12]以MgSO4·7H2O和Na2CO3为原料, 当温度为50 ℃、 MgSO4浓度为1.2 mol/L、 MgSO4和Na2CO3物质的量比为1∶1.2、 反应时间为40 min时合成结晶度良好的棒状MgCO3·3H2O晶体。
沈蕊等[13]以预处理后的硼泥为原料, 碳酸钠为沉淀剂, 磷酸氢二钠(Na2HPO4·12H2O)为添加剂, 制备分散性良好的三水碳酸镁晶体。 王余莲等[14]以菱镁矿为原料, 采用煅烧-水化-碳酸化-热解法, 以十二烷基硫酸钠(SDS)为晶型控制剂,制备平均长径比达25的棒状MgCO3·3H2O晶体。欧龙等[15]以轻烧白云石粉为原料,经消化、 碳化制备重镁水前驱溶液,并向Mg(HCO3)2溶液中通入空气,60 ℃条件下热解获得MgCO3·3H2O晶须。以硼泥、 盐湖卤水等工业含镁物质、 天然矿物(菱镁矿[16-17]、 白云石等)为原料,对三水碳酸镁工业化生产具有一定指导意义,但工艺因素仍较繁杂。
纵观国内外研究成果,其制备的三水碳酸镁晶体形貌多以棒状为主。作者所在课题组前期以菱镁矿为原料,轻烧获得高活性MgO,并将高活性MgO经水化制得Mg(OH)2悬浮液,用盐酸酸浸Mg(OH)2悬浮液并加入沉淀剂,合成MgCO3·3H2O晶体。本文中在前期工作基础上,以化学试剂MgCl2·6H2O和Na2CO3为原料,采用共沉淀法制备MgCO3·3H2O晶体,考察了反应物浓度、 反应温度、 反应时间、 陈化时间和添加剂柠檬酸钠对晶体产物物相成分及微观形貌的影响,并探究了MgCl2·6H2O-Na2CO3体系中棒状三水碳酸镁晶体的生长机理。
1 实验
1.1 主要试剂材料
氯化镁(MgCl2·6H2O,分析纯,天津市大茂化学试剂厂);碳酸钠(Na2CO3,分析纯,天津科密欧化学试剂有限公司);柠檬酸钠(Na3C6H5O7·2H2O,分析纯,沈阳市东兴试剂厂)。
1.2 方法
1)样品的制备
量取一定体积、 浓度为0.05~0.30 mol/L的MgCl2·6H2O溶液置于烧杯中,并将烧杯置于20~50 ℃恒温水浴锅中保温。按照物质的量比为1∶1的量取同体积同浓度的Na2CO3溶液于相同温度保温,将其一次性倒入装有MgCl2·6H2O溶液的烧杯中,持续搅拌,反应结束后停止搅拌,室温条件下陈化一定时间,抽滤,将所得白色沉淀于50 ℃恒温干燥箱中烘干4 h,获得白色粉末。
2)样品的表征
采用重庆奥特光学仪器有限公司生产的MIT500型金相显微镜观测产物的微观形貌。 采用日本Rigaku公司生产的UltimaⅣ型X射线衍射仪检测样品物相, 辐射源为Cu铜靶Kα, λ=0.154 1 nm, 固体探测器, 管电压为40 kV, 管电流为40 mA, 扫描速率为12 (°)·min-1, 扫描范围2θ=5 °~90 °。 采用日立公司S-3400N型扫描电子显微镜, 观察喷金处理后产物形貌。
2 结果与讨论
2.1 反应物浓度的影响
固定反应温度为50 ℃, 搅拌速率为300 r/min, 反应时间为15 min, 陈化时间为0.5 h, 反应物浓度分别为0.05、 0.10、 0.20和0.30 mol/L时, 得到的产物形貌见图1。 由图可以看出, 反应物浓度为0.05 mol/L时, 产物主要为不规则团聚物, 隐约可见少量棒状晶体, 如图1 a); 反应物浓度增加到0.10 mol/L时, 针状晶体开始析出, 但晶体长度较短, 产量低,如图1 b); 反应物浓度为0.20 mol/L时, 所得棒状晶体表面粗糙; 反应溶液中部分小颗粒晶核为降低其表面能相互聚拢, 产生了少量团聚物, 见图1 c); 反应物浓度增大至0.30 mol/L时, 产物全部为外表光滑、 形状均匀的棒状晶体, 见图1 d)。
综上可知, 产物的生长和形貌受反应物浓度影响较大。 当反应物浓度为0.10 mol/L时, 溶液中离子浓度较低, 过饱和度小, 晶核生长不完全, 所得晶须数量少, 长度较短, 因此, 适宜的反应物浓度为0.30 mol/L。

a)0.05 mol/Lb)0.10 mol/Lc)0.20 mol/Ld)0.30 mol/L图1 不同反应物浓度下产物的显微镜形貌(×400倍)Fig.1 Microscopic morphology of products at different reactant concentrations
图2为反应物浓度为0.30 mol/L所得产物的XRD图像, 观察分析图像可知, 产物的衍射峰与MgCO3·3H2O(PDF#70-1433)特征峰相匹配。 衍射峰形尖锐, 基底平坦, 无其他杂质峰, 表明所得产物纯度较高, 杂相少, 因此, 反应物适宜浓度为0.30 mol/L。
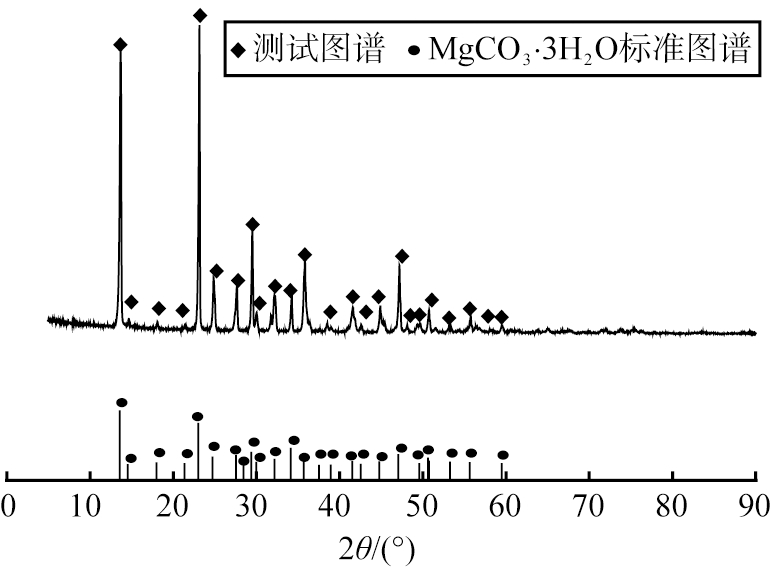
图2 反应物浓度为0.3 mol/L所得产物XRD图
Fig.2 XRD patterns of product at reactant concentration 0.3 mol/L
2.2 反应温度的影响
固定反应物浓度为0.30 mol/L,搅拌速率为300 r/min,反应时间为15 min,陈化时间为0.5 h,反应温度分别为20、 30、 40、 45、 50 ℃时,获得产物形貌见图3。由图可知,反应温度为20 ℃时,400倍物镜下可以看出,产物为粗棒状晶体,见图3 a),但数量较少;反应温度升高至30 ℃时,产物为细棒状晶体,见图3 b);反应温度为40 ℃时,所得晶体长短不均,产量少,见图3 c);继续升高温度至50 ℃时,得到长度较长的棒状晶体,见图3 d)。20 ℃时,反应体系温度低,反应速率慢,成核少,导致最终产物粗大。

a)20 ℃b)30℃c)40 ℃d)50 ℃图3 不同反应温度下产物显微镜形貌(×400)Fig.3 Microscopic morphology of products at different reaction temperatures
对30 ℃和50 ℃所得产物进行XRD检测, 结果如图4所示。 由图发现, 30 ℃时产物衍射峰中同时存在4MgCO3·Mg(OH)2·5H2O和MgCO3·3H2O的特征峰, 表明该温度下所得产物为两者的混合物。 50 ℃时产物衍射峰均与MgCO3·3H2O特征峰相匹配, 峰值高且无其他杂峰, 表明该温度下可得到纯度高、 结晶良好的棒状MgCO3·3H2O晶体, 故选择50 ℃为最佳反应温度。
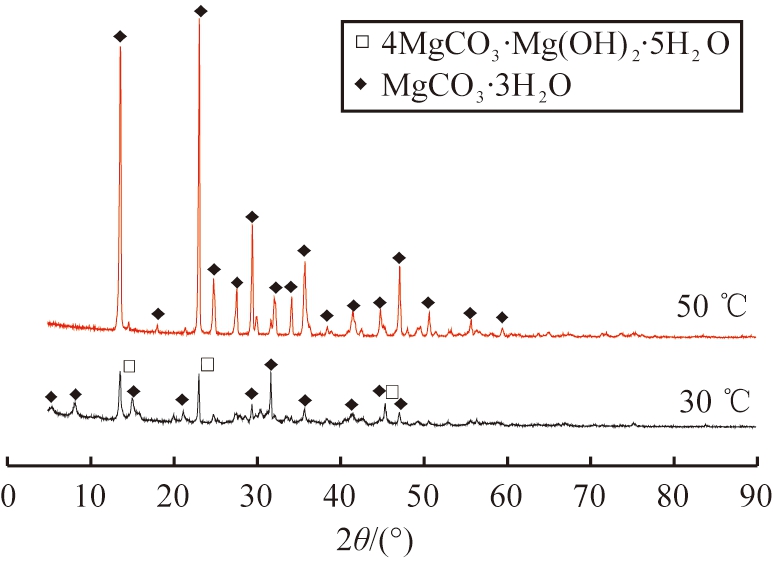
图4 不同温度下所得产物的XRD图谱
Fig.4 XRD patterns of products obtained at different temperatures
2.3 反应时间的影响
固定反应物浓度为0.30 mol/L,搅拌速率为300 r/min,反应温度为50 ℃,陈化时间为0.5 h,反应时间分别为5、 10、 15、 20、 25和40 min时,所得产物XRD图见图5。由图可知,反应时间在5~15 min之间时,所得产物均为MgCO3·3H2O,其中当反应时间为15 min时, 产物XRD图像基底平滑, 峰窄且尖锐, 产物的衍射峰与MgCO3·3H2O特征峰一致, 无其他杂峰, 说明该反应条件下所得产物结晶度高, 杂质少; 反应时间为20 min时, XRD图谱中同时存在2种衍射峰, 所得产物为MgCO3·3H2O和4MgCO3·Mg(OH)2·4H2O的混合物。 在25、 40 min时, 产物的特征峰与4MgCO3·Mg(OH)2·4H2O(PDF#70-0361)标准峰一致, 产物为碱式碳酸镁。
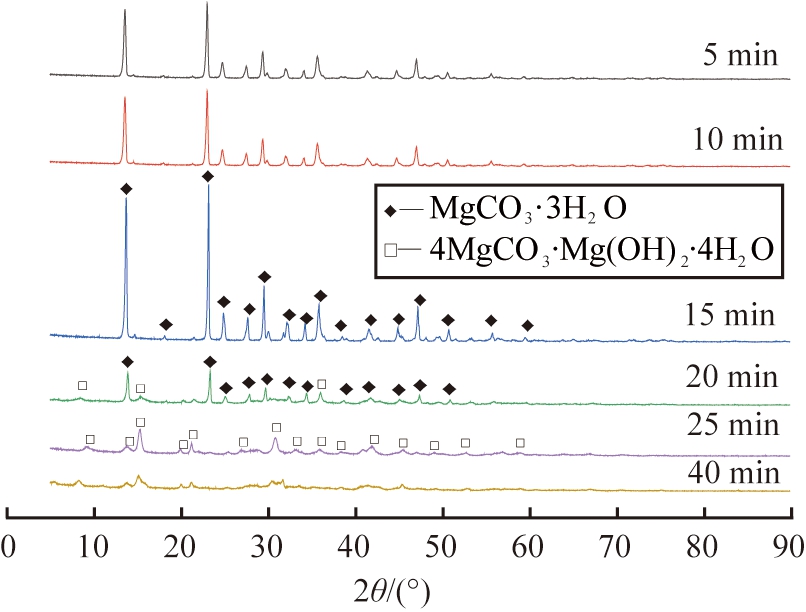
图5 不同反应时间所得产物的XRD图谱
Fig.5 XRD patterns of products obtained at different reaction times
图6为不同反应时间所得产物的SEM图像。由图6 a)可知,反应时间5 min时,产物主要为短粗柱状晶体,晶体分布不均匀;反应时间延长至10 min~15 min时,产物为表面光滑的棒状晶体,见图6 b)、 c),其中15 min所得产物平均长度约为60 μm;反应时间继续增加至20 min时,棒状晶体表面开始产生絮状物,这可能是由于棒状晶体部分溶解导致,见图6 d);反应时间为25~40 min时,棒状晶体继续溶解并完全转化为絮状晶体,见图6 e)和 f)。
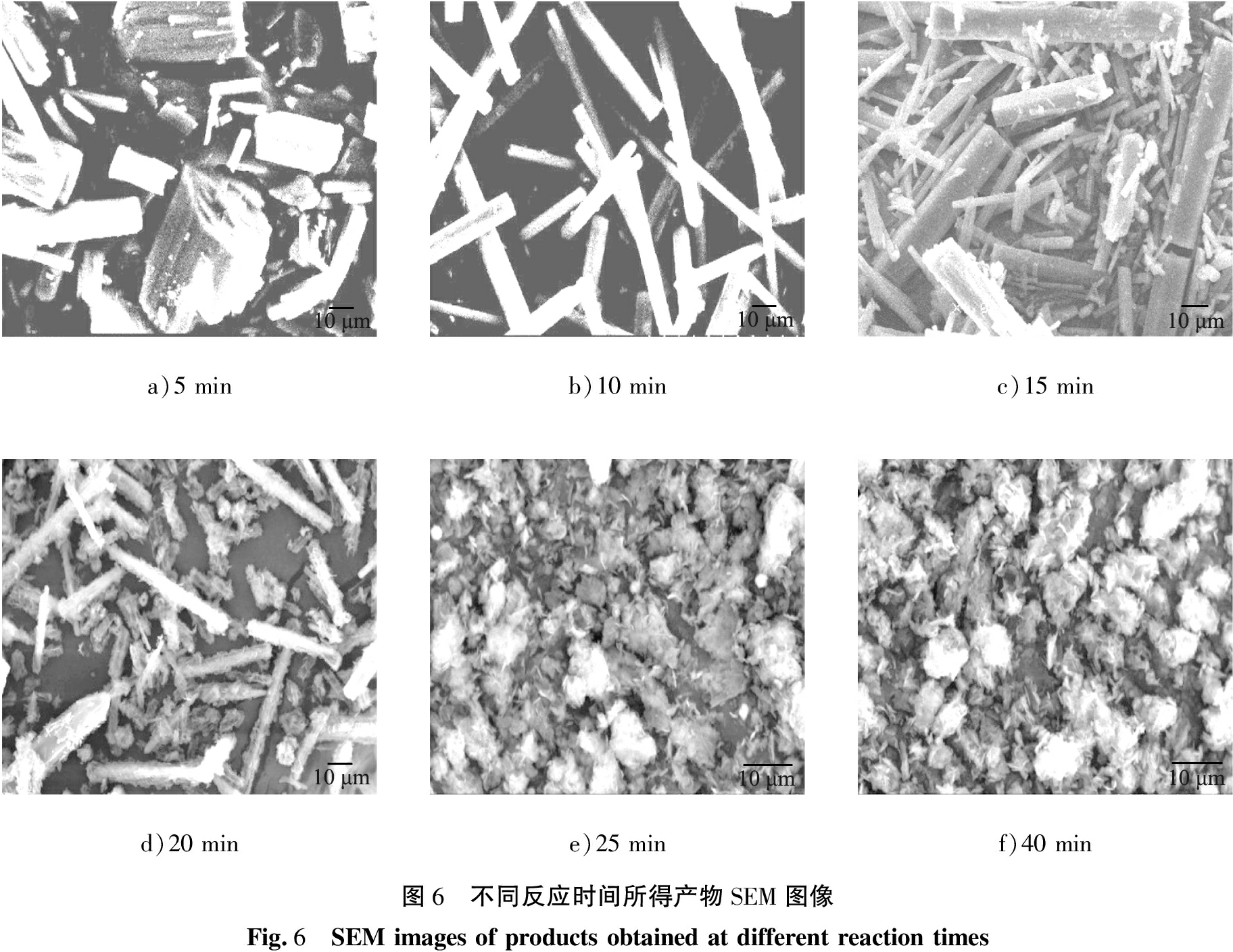
a)5 minb)10 minc)15 mind)20 mine)25 minf)40 min图6 不同反应时间所得产物SEM图像Fig.6 SEM images of products obtained at different reaction times
综上所述,反应时间对产物的形貌和物相构成有重要影响,随着反应时间增加,产物逐渐由三水碳酸镁转化为碱式碳酸镁;结合XRD和SEM分析结果,确定制备MgCO3·3H2O晶须的适宜反应时间为15 min。
2.4 陈化时间的影响
固定反应物浓度为0.30 mol/L,搅拌速率为300 r/min,反应温度为50 ℃,反应时间为15 min,陈化时间分别为0、 0.5、 1、 3和6 h时,所得产物形貌如图7所示。陈化时间为0 h时,溶液中无定形颗粒生长时间不足,无法形成更多晶体,导致产物数量较少。由图可知,当陈化时间为0.5 h时,产物为表面光滑且长度均匀的棒状晶体;随着陈化时间延长至1 h,产物形貌并无明显变化,晶体数量也无明显增加;陈化时间继续延长至3~6 h时,产物中同时存在棒状晶体与絮状物质。据课题组前期研究工作成果[18-20]可知,絮状物质为碱式碳酸镁。这是因为三水碳酸镁是亚稳态水合碳酸镁,一定条件下,其会转化为热力学上更为稳定的碱式碳酸镁。考虑到产物产量等因素,确定0.5 h为适宜陈化时间。

a)0.5 hb)1 hc)3 hd)6 h图7 不同陈化时间所得产物SEM形貌Fig.7 SEM morphology of products obtained with different aging time
2.5 添加柠檬酸钠的影响
固定温度为50 ℃, 搅拌速率为300 r/min, 陈化时间为0.5 h,柠檬酸钠的添加量为2%(按照反应溶液体积分数计),反应时间为45 min,探究柠檬酸钠对产物物相组成和形貌的影响,结果如图8、 9所示。由图可以看出,添加柠檬酸钠后所得产物形貌呈放射状,且产物XRD图谱基底平缓,半宽峰窄且强度高,产物仍为MgCO3·3H2O晶体,表明柠檬酸钠的加入没有改变产物物相组成,但对晶体的形貌影响显著,原因可能是柠檬酸钠的选择性吸附作用,促进了晶体各向异性生长,导致三水碳酸镁晶体向几个特定晶面生长。
2.6 晶须生长机理
将一定浓度的Na2CO3溶液加入至同浓度的MgCl2·6H2O溶液, 反应溶液过饱和度迅速增大, 大量MgCO3·3H2O晶核析出, 相互吸引聚拢, 并沿固液界面能最低的方向一维生长; 同时失去核外电子的Na+与得到电子的Cl-在静电吸引作用下相结合。 在棒状MgCO3·3H2O晶体生长过程中, 反应体系中游离的Mg2+和![]() 不断向固液界面聚集提供生长物质, 由此推断MgCO3·3H2O晶须生长符合液-液-固生长机理[21], 其示意图如图10所示。
不断向固液界面聚集提供生长物质, 由此推断MgCO3·3H2O晶须生长符合液-液-固生长机理[21], 其示意图如图10所示。
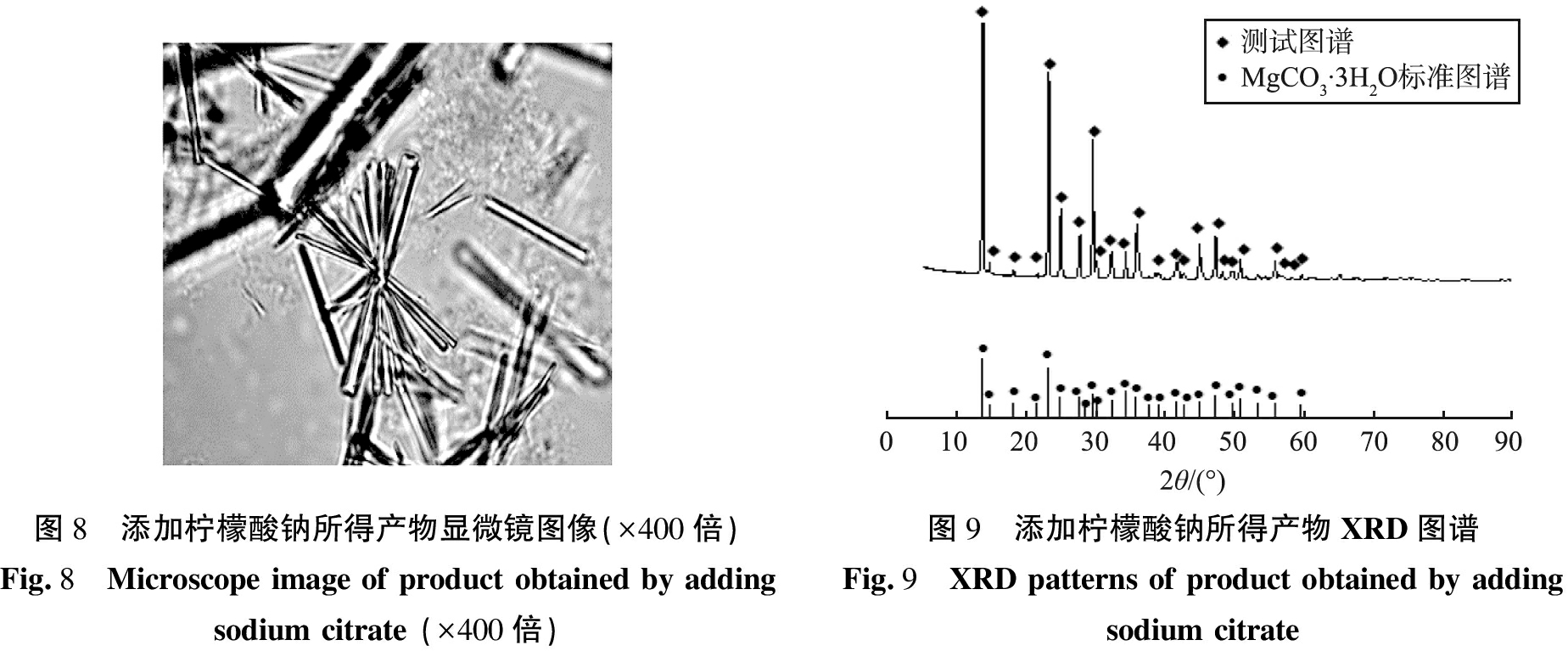
图8 添加柠檬酸钠所得产物显微镜图像(×400倍)Fig.8 Microscope image of product obtained by adding sodium citrate (×400倍)图9 添加柠檬酸钠所得产物XRD图谱Fig.9 XRD patterns of product obtained by adding sodium citrate
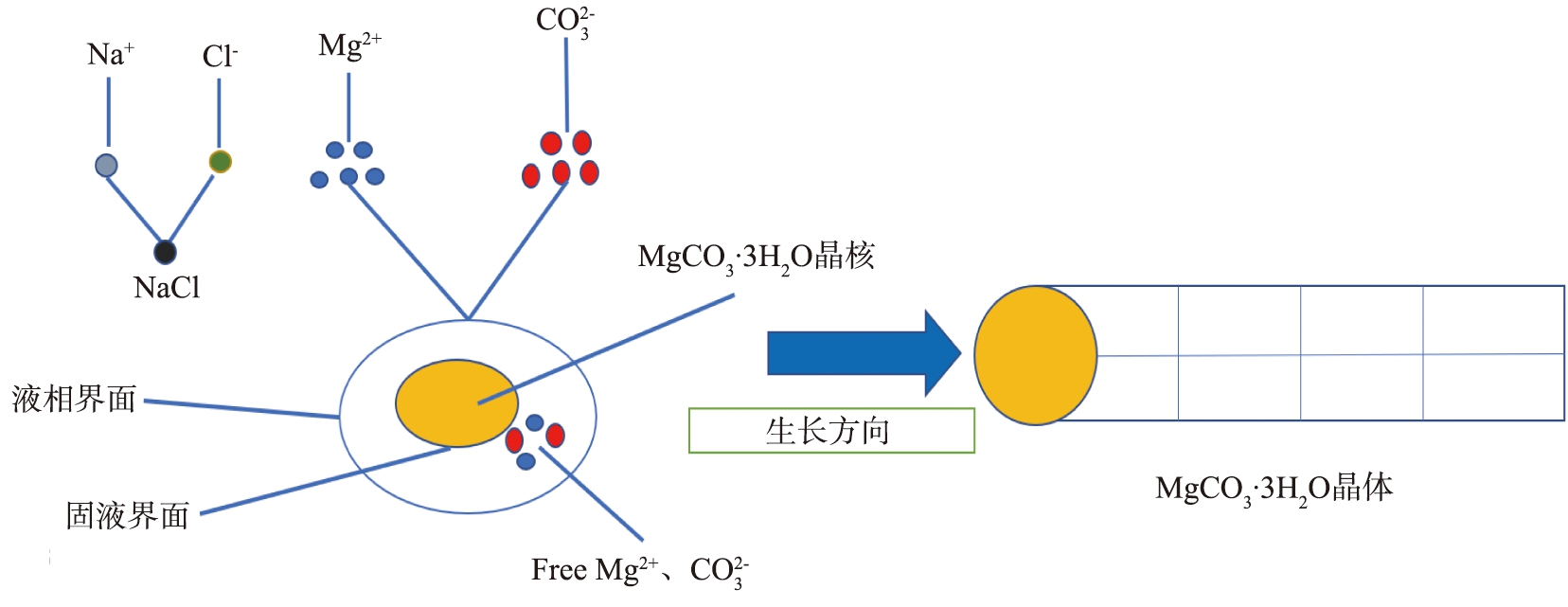
图10 MgCl2·6H2O-Na2CO3体系下MgCO3·3H2O晶体生长图
Fig.10 Diagram of MgCO3·3H2O crystal growth under MgCl2·6H2O-Na2CO3 system
3 结论
1)MgCl2·6H2O浓度为0.30 mol/L、 Na2CO3浓度为0.30 mol/L、 反应温度为50 ℃、 反应时间为15 min、 搅拌速率为300 r/min、 陈化时间为0.5 h时,获得平均直径约为5 μm的棒状MgCO3·3H2O晶体。
2)反应时间对晶体制备过程影响较大,反应时间延长(>15 min),棒状三水碳酸镁晶体转变为絮状碱式碳酸镁。
3)MgCl2·6H2O-Na2CO3体系中柠檬酸钠添加量为2%时,可获得结晶良好的放射状MgCO3·3H2O晶体。
4)MgCl2·6H2O-Na2CO3体系中,MgCO3·3H2O晶体沿固液界面能最低的方向一维生长,推测其符合液-液-固生长机理。
[1]闫平科, 薛国梁, 高玉娟, 等. 表面活性剂对三水碳酸镁晶须形貌的影响研究[J]. 硅酸盐通报, 2013, 32(9): 1729-1732, 1740.
[2]陈娟, 黄志良, 陈常连, 等. 反应温度和反应时间对三水碳酸镁晶须长径比[J]. 武汉工程大学学报, 2017,39(1): 54-58.
[3]王余莲, 印万忠, 李昂, 等. 热分解法制备三水碳酸镁晶须及其结晶动力学研究[J]. 矿产保护与利用, 2018(6): 107-113.
[4]吴丹, 宋达, 张亚南, 等. 三水碳酸镁的晶相调控与自组装[J]. 材料开发与应用, 2018, 33(1): 77-82.
[5]王连连, 田磊, 王明, 等. 立方纳米氧化镁的制备及形貌表征[J]. 中国粉体技术, 2019, 25(6): 50-55.
[6]王道广, 李志宝, 王英军. 三水碳酸镁浆液过滤及脱水性能的测定与模拟[J]. 过程工程学报, 2017, 17(6): 1217-1226.
[7]王余莲. 微/纳米水合碳酸镁的制备及应用研究[D]. 沈阳: 东北大学, 2015.
[8]闫平科, 田海山, 高玉娟, 等. 高长径比三水碳酸镁晶须的合成研究[J]. 人工晶体学报, 2012, 41(1): 158-164.
[9]BOTHA A,STRYDOM C A.Preparation of a magnesium hydroxy carbonate from magnesium hydroxide[J]. Hydrometallurgy, 2002, 62(3): 175-183.
[10]WANG Y, ZHIBAO L, DEMOPOULOS P. Controlled precipitation of nesquehonite (MgCO3·3H2O) by the reaction of MgCl2 with (NH4)2CO3[J]. Journal of Crystal Growth, 2008, 310(6): 1220-1227.
[11]高玉娟, 徐梦旭, 田贵山, 等. 反应物浓度对三水碳酸镁晶体的形貌调控[J]. 山东理工大学学报(自然科学版), 2021, 35(2): 28-30.
[12]赵斌, 贾志丹, 邵朵朵. 硫酸镁为原料制备三水碳酸镁晶须的研究[J]. 人工晶体学报, 2017, 46(1): 18-25.
[13]沈蕊, 杨洪波, 李花, 等. 利用硼泥制备三水碳酸镁晶须[J]. 人工晶体学报, 2014, 43(4): 991-996.
[14]王余莲, 印万忠, 张夏翔, 等. 大长径比三水碳酸镁晶须的制备及晶体生长机理[J]. 硅酸盐学报, 2018, 46(7): 938-945.
[15]欧龙, 刘家祥. 重镁水中通入空气制备三水碳酸镁晶须[J]. 硅酸盐学报, 2016, 44(1): 104-111.
[16]YAO J, SUN H R, YANG B, et al. Selective co-adsorption of a novel mixed collector onto magnesite surface to improve the flotation separation of magnesite from dolomite[J]. Powder Technol, 2020, 371: 180-189.
[17]YAO J, SUN H R, HAN F, et al. Enhancing selectivity of modifier on magnesite and dolomite surfaces by pH control[J]. Powder Technol, 2020, 362: 698-706.
[18]刘珈伊, 王余莲, 时天骄, 等. 无水乙醇辅助低温直接法制备碱式碳酸镁晶体[J]. 中国粉体技术, 2021, 27(1): 41-49.
[19]WANG Y L, LIU J Y, SHI T J, et al. Preparation, properties and phase transition of mesoporous hydromagnesite with various morphologies from naturalmagnesite[J]. Powder Technology, 2020, 364: 822-830.
[20]王余莲, 印万忠, 张夏翔, 等. 三水碳酸镁法制备碱式碳酸镁过程研究[J]. 矿产保护与利用, 2017(4): 81-86.
[21]邵平平, 李志宝, 密建国. 碳酸镁水合物在283~363 K范围内的晶体组成及晶型[J]. 过程工程学报, 2009, 9(3): 520-525.