挥发性有机物(volatile organic compounds,VOCs)是威胁人体健康、污染生存环境的有机污染物的统称。工业生产和室内装修过程中的绝大部分环节都会排放VOCs。VOCs不但会对空气造成严重污染,还会与氮氧化物发生光化学反应,形成危害更大的光化学盐雾,造成二次大气污染[1-2]。许多VOCs被分类为已知或可能的致癌物,会刺激和危害人体的眼睛、 皮肤和呼吸道等器官,甚至与慢性哮喘和癌症的病因有关[3]。
目前,对VOCs的治理技术主要有吸附法[4-5]、 膜分离法[6]、 催化法[7]等。吸附法因具有成本低、 操作简单、 方便高效的特点被广泛采用。活性炭具有丰富的微孔结构,吸附容量大[5,8],是市面上处理VOCs最常用的吸附剂,但活性炭其本身就具有可燃性,而VOCs大多数是碳氢化合物,在存储、运输和热处理再生的过程中会具有易燃、 易爆的潜在危险[9-11]。而锰氧化物(MnOx)因自身为介孔结构,且晶型种类丰富,作为吸附剂可吸附染料相关化合物和重金属离子[12-14]。
综上,为了替代活性炭吸附剂,需要开发一种高效、 安全、 可循环再生使用且性能好的吸附剂颗粒。本文中以甲苯静态吸附为参考,选择制备一种锰基吸附剂用于VOCs的吸附,研究锰基吸附剂的制备工艺参数并进行性能测试,制备出具有良好的VOCs吸附性能和热稳定性的锰基吸附剂。
1 实验
1.1 试剂材料和仪器设备
试剂材料:活性炭(宁夏华辉活性炭股份有限公司);高锰酸钾(KMnO4)、 一水合硫酸锰(MnSO4·H2O)、 碱式碳酸镁(xMgCO3·yMg(OH)2·zH2O)、 甲基纤维素、 40%硅溶胶,均为分析纯试剂。
仪器设备:电子分析天平(ME204E型,梅特勒-托利多仪器上海有限公司);型磁力搅拌器(85-1型,巩义市予华仪器有限责任公司)。
1.2 方法
1.2.1 锰氧化物的合成
将浓度为0.2 mol/L的KMnO4溶液和浓度为0.15 mol/L的MnSO4·H2O溶液等体积混合后,在室温和常压条件下磁力搅拌6 h充分反应;然后将沉淀物减压过滤,并用蒸馏水反复冲洗;最后将得到的滤饼在60 ℃下干燥3 h,即得到棕黑色的锰氧化物产物。
1.2.2 锰基吸附剂的制备
将合成的锰氧化物、 造孔剂、 结构助剂、 黏合剂和水按照质量分数配比为(2%~15%)∶(4%~45%)∶(5%~15%)(3%~10%)∶(20%~80%)混合均匀后制成软团; 然后在挤条机上通过挤压形成直径约1.5 mm的圆柱状长条, 再用刀片切割成长约5 mm的圆柱状颗粒;最后经过120~500 ℃的热处理过程得到锰基吸附剂样品。
1.2.3 材料的表征分析
1)采用全自动比表面和孔径分布分析仪(Quanta Chrome,Autosorb-iQ,美国)测定样品的BET(Burunauer-Emmett-Teller)比表面积。在氮气吸附前,需要在250 ℃下抽真空干燥脱气4 h去除样品内残留水分,然后在-196 ℃下氮气吸附测定,最后用BJH(Barrett-Joymer-Halenda)方法计算孔容和孔径分布。
2)采用扫描电镜(SEM,HITACHI S3400N,日本)分析测定样品表面微观形貌特征及表面扫描元素分析图。
3)用台式X 射线衍射仪(XRD, Aeris系列Malvern Panalytical)测试样品的物相。测试条件为Cu Kα1入射源,管电压为40 kV, 管电流为15 mA。
4)材料的热分析使用STA409PC同步热分析仪,测试条件为空气气氛, 空气流速50 mL/min, 温度区间25~800 ℃。
1.2.4 VOCs饱和吸附容量测试
选择甲苯和甲醛作为VOCs的探针分子进行静态饱和吸附量的测试[15-16]。使用干燥器作为静态吸附装置的密闭容器,先在干燥器底部先放入约15 mL的甲苯或甲醛液体;然后将一定质量的吸附剂样品放在干燥器隔板上,迅速合上盖子密闭干燥器,在室温下维持24 h以上进行吸附,期间需保证干燥器底部始终有甲苯或甲醛液体存留;最后将吸附剂样品从干燥器中快速取出并称重,由吸附剂样品放入静态饱和吸附装置前后的质量差计算饱和吸附量。待测吸附剂样品的静态饱和吸附量计算公式为
(1)
式中: Q为VOCs的静态饱和吸附量, g/g; m0是待测吸附剂样品的初始质量,g; mt是待测吸附剂样品吸附气体后的质量,g。
2 结果与讨论
2.1 锰基吸附剂配方体系的确定
作为主吸附材料的锰氧化物(MnOx)是固体粉末。为了通过挤条法得到具有一定规格尺寸和机械强度的圆柱状吸附剂颗粒,需要首先对锰基吸附剂配方体系中黏合剂、 造孔剂和结构助剂的类型进行筛选。通过控制变量法,将MnOx作为必要的组分,加入胶黏剂(甲基纤维素)、 不同种类的结构助剂(硅溶胶或铝溶胶)和造孔剂(碳酸氢铵或碱式碳酸镁),制备不同体系的锰基吸附剂,并测试吸附剂对甲醛和甲苯的吸附性能。不同配方体系所得锰基吸附剂的吸附性能如表1所示。
表1 不同配方体系所得锰基吸附剂的吸附性能
Tab.1 Adsorption performance of manganese-based adsorbents obtained from different formulation systems
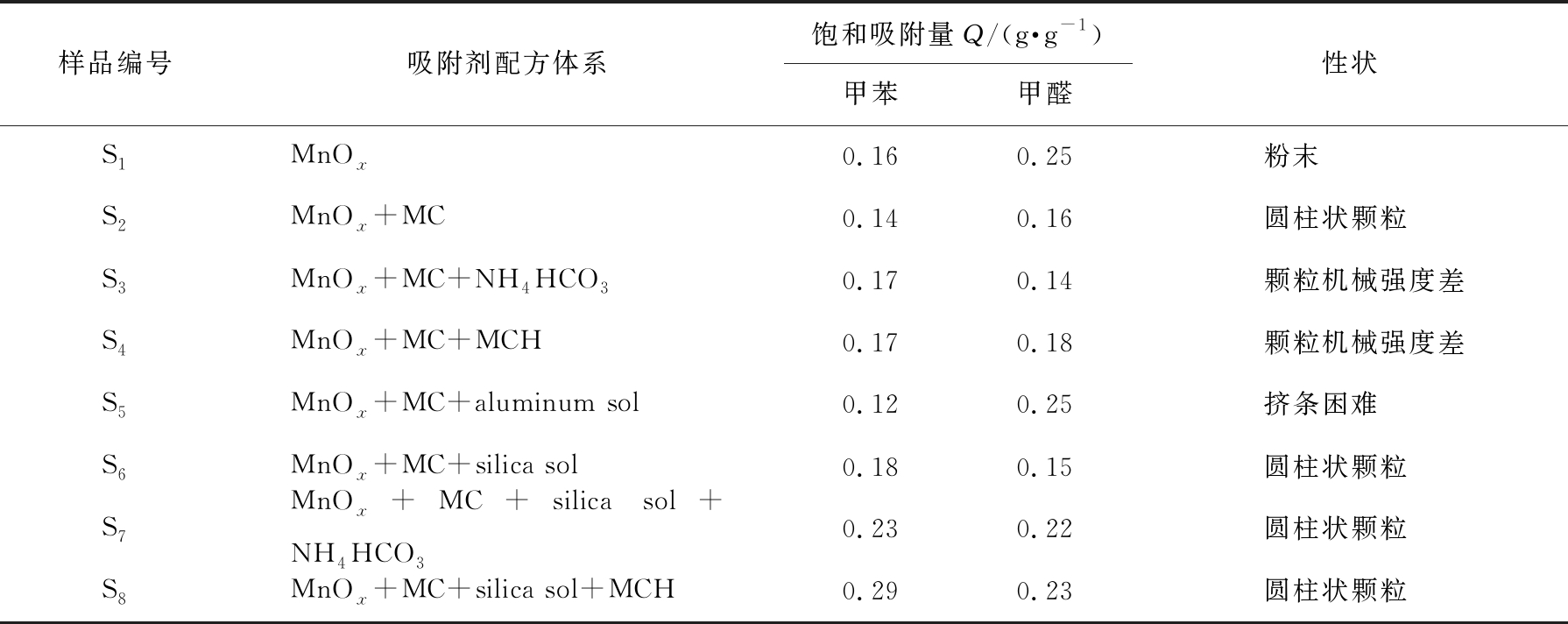
样品编号吸附剂配方体系饱和吸附量Q/(g·g-1)甲苯甲醛性状S1MnOx0.160.25 粉末 S2MnOx+MC0.140.16 圆柱状颗粒 S3MnOx+MC+NH4HCO30.170.14 颗粒机械强度差S4MnOx+MC+MCH0.170.18 颗粒机械强度差S5MnOx+MC+aluminum sol0.120.25 挤条困难 S6MnOx+MC+silica sol0.180.15 圆柱状颗粒 S7MnOx+MC+silica sol+NH4HCO30.230.22 圆柱状颗粒 S8MnOx+MC+silica sol+MCH0.290.23 圆柱状颗粒
由表1可知,在样品S1的基础上添加甲基纤维素(methyl cellulose,MC)作为黏合剂制备的样品S2,可以很好地把主吸附材料MnOx由粉末状成型为圆柱状颗粒,但S2样品的吸附性能明显下降;在S2样品基础上增加造孔剂碳酸氢铵(NH4HCO3)或碱式碳酸镁(magnesium carbonate hydroxide, MCH),分别形成样品S3和S4,虽提升了样品吸附性能,但颗粒机械强度变差,难以成型;若在S2样品基础上先增加结构助剂铝溶胶(aluminum sol)或硅溶胶(silica sol),形成样品S5和S6,颗粒机械强度都得到明显改善,但铝溶胶的加入会导致体系黏度过大,不利于样品S5挤条成型,故选择硅溶胶作为结构助剂;在S6样品基础上增加造孔剂NH4HCO3或MCH,分别形成样品S7和S8,对比发现选择碱式碳酸镁作为造孔剂样品S8的VOCs饱和吸附容量更高。由此,确定锰基吸附剂的配方体系为:主吸附材料为MnOx,黏合剂为甲基纤维素,结构助剂为硅溶胶,造孔剂为碱式碳酸镁。
2.2 碱式碳酸镁质量分数的影响
成型吸附材料的多孔性及合适孔洞结构会对材料的吸附性能有显著提升作用,而造孔剂的用量是其关键因素。碱式碳酸镁的质量分数与锰基吸附剂对甲苯饱和吸附量的关系曲线如图1所示。
由图1可以看出,当碱式碳酸镁的质量分数为0~4%时,甲苯饱和吸附量从0.18 g/g急剧增大到0.27 g/g,说明造孔剂碱式碳酸镁会对锰基吸附剂吸附性能有显著的提升作用;随着碱式碳酸镁质量分数的不断增大,锰基吸附剂的甲苯饱和吸附量呈线性缓慢增大。
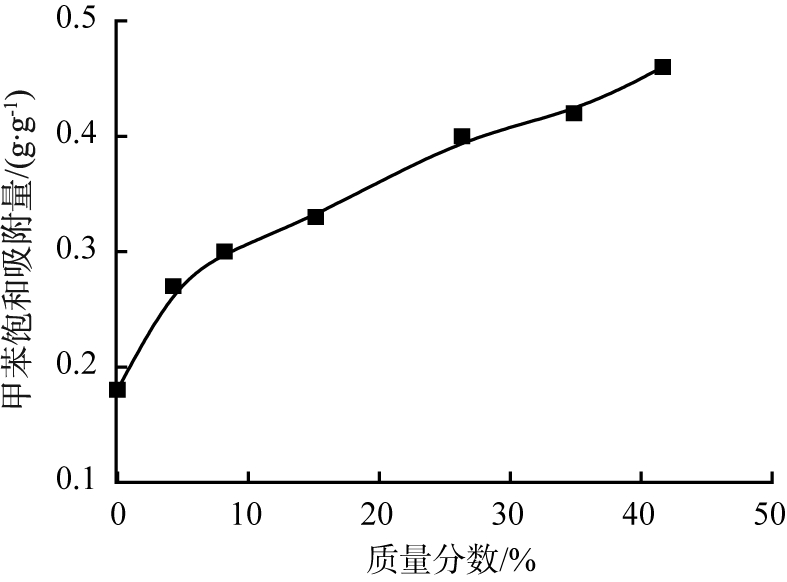
图1 碱式碳酸镁的质量分数与锰基吸附剂对甲苯饱和吸附量的关系曲线
Fig.1 Relationship curve between mass fraction of basic magnesium carbonate and saturated toluene adsorption capacity of manganese-based adsorbent
碱式碳酸镁的质量分数对锰基吸附剂表面微观形貌的影响如图2所示。由图2可知,随着碱式碳酸镁质量分数的增大,吸附剂颗粒样品的表面孔隙数量逐渐增多,孔尺寸也逐渐变大,即吸附剂颗粒的表面结构总体从光滑致密向疏松多孔过渡。

a)4%b)8%c)15%d)26%e)35%f)43%图2 碱式碳酸镁的质量分数对锰基吸附剂表面微观形貌的影响Fig.2 Influence of mass fraction of basic magnesium carbonate on surface morphology of manganese-based adsorbents
碱式碳酸镁质量分数为43%时锰基吸附剂的面扫描元素分析图像如图3所示。 由图3可见, 吸附剂样品表面的Mn、 Si、 Mg和O元素都能形成均匀的点状分布, 说明锰氧化物、 硅溶胶和碱式碳酸镁3种原料热处理后形成的MnOx、 SiO2和MgO这3种对应组分在吸附剂颗粒样品内部以疏松形态高度分散。
综上,增大碱式碳酸镁质量分数会增加锰基吸附剂样品的孔隙数量,辅助MnOx等主要成分的均匀分散,提升吸附剂样品对VOCs的吸附性能,但是在碱式碳酸镁的质量分数过大(超过43%)时,所形成软团的黏稠度显著增加,一方面不利于在挤条机上顺利挤压形成圆柱状长条,另一方面挤条得到的圆柱状样品在高温焙烧后表面会出现细裂纹,按压时容易碎裂,因此,造孔剂碱式碳酸镁的质量分数不宜超过43%。

a)SEM图像b)C元素c)O元素d)Mg元素e)Si元素f)Mn元素图3 碱式碳酸镁质量分数为43%时锰基吸附剂的面扫描元素分析图像Fig.3 Surface scanning elemental analysis images of manganese-based adsorbent when mass fraction of basic magnesium carbonate is 43%
2.3 热处理温度的影响
造孔剂碱式碳酸镁原料在添加后还需要经过后续热处理步骤, 才能真正产生致孔效果, 所以选择合适的热处理温度也十分重要。 碱式碳酸镁纯样品和未热处理的锰基吸附剂样品的热重曲线如图4所示。
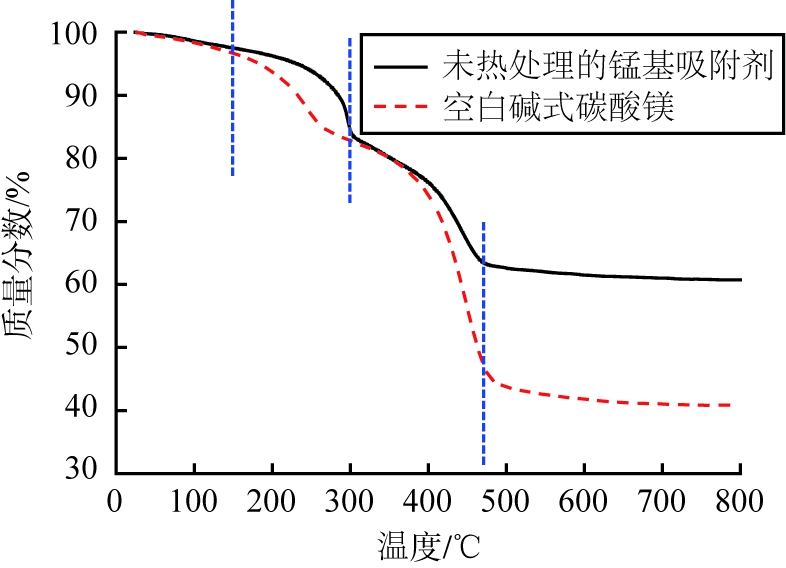
图4 碱式碳酸镁纯样品和未热处理的锰基吸附剂的热重曲线
Fig.4 Thermogravimetric curve of pure basic magnesium carbonate sample and unheated manganese-based adsorbent
由图4可知,碱式碳酸镁纯样品的热重曲线主要存在150~300 ℃和350~490 ℃ 2个失质量阶段,由文献[17]可知,低温段主要是碱式碳酸镁失结晶水和脱羟基过程,而高温段主要是碳酸镁进一步分解释放出CO2的过程,所以高温段是碱式碳酸镁产生致孔效果的关键温度范围。未经热处理的锰基吸附剂样品的热重曲线也存在2个相似的失质量阶段,即150~310 ℃和350~470 ℃,只是高温段的失质量减少了一半以上;鉴于造孔剂碱式碳酸镁的质量分数约为30%~40%,由此推断高温段的失质量主要由碱式碳酸镁受热分解释放CO2所致。也就是说,350~470 ℃是未经热处理的锰基吸附剂样品大量产生孔隙的关键温度范围。
不同热处理温度时锰基吸附剂的甲苯吸附性能如图5所示。理论上,热处理温度超过470 ℃更有利于碱式碳酸镁分解完全,得到更多的孔隙,从而使锰基吸附剂样品的吸附性能更优。但是,由图5可知,热处理温度为400 ℃吸附剂样品的甲苯饱和吸附量最高,热处理温度达到450 ℃时甲苯饱和吸附量却有所下降,说明未经热处理的锰基吸附剂样品在350~470 ℃热处理温度范围内,除了碱式碳酸镁高温致孔正效应外,吸附剂中其他原料可能还发生了不利于吸附性能的负效应。
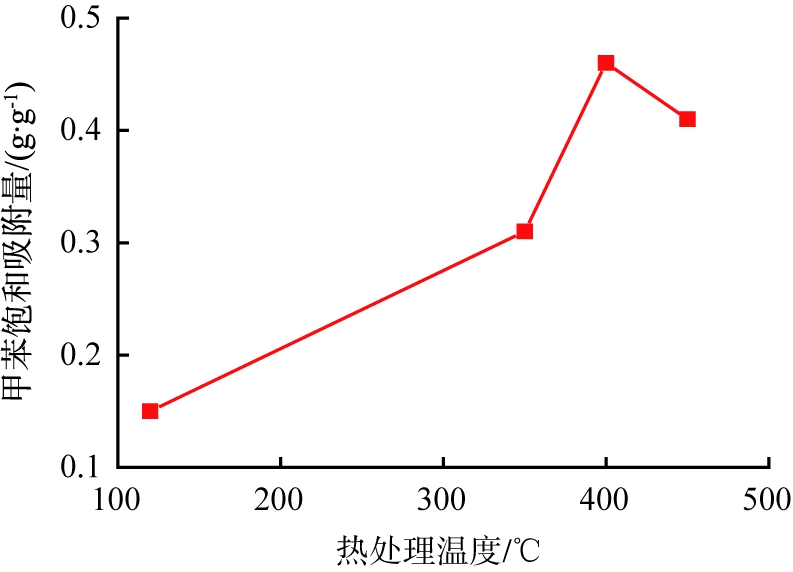
图5 不同热处理温度时锰基吸附剂的甲苯吸附性能
Fig.5 Toluene adsorption performance of manganese-based adsorbents at different temperatures of heat treatment
不同热处理温度时主吸附材料MnOx纯样品的XRD图谱如图6所示。由图6可见,当热处理温度低于400 ℃时, MnOx样品的X-射线特征衍射峰主要在2θ为37.35 °、 67.73 °处, 归属于Birnessite晶型[18], 而且其衍射峰强度有明显的弱化和宽化, 说明样品颗粒很小, 结晶度差; 当热处理温度达到450 ℃时, MnOx样品在2θ为12.75 °、 18.07 °、 28.72 °、 37.58 °、 41.97 °、 49.79 °、 60.11 °处出现新的特征衍射峰, 归属于Cryptomelane晶型[19], 而且衍射峰强度显著增强, 说明样品颗粒变大, 结晶度提高。 Birnessite晶型的MnOx虽然结晶度差, 趋于无定形;但具有更高的比表面积,更有利于其吸附性能的提升,因此,热处理温度从400 ℃升高到450 ℃时,锰基吸附剂样品的甲苯饱和吸附量出现下降的现象,这是由于主吸附材料MnOx从Birnessite晶型转变为Cryptomelane晶型,材料比表面积减小所致。综上可知,锰基吸附剂的最佳热处理温度应选择400 ℃。
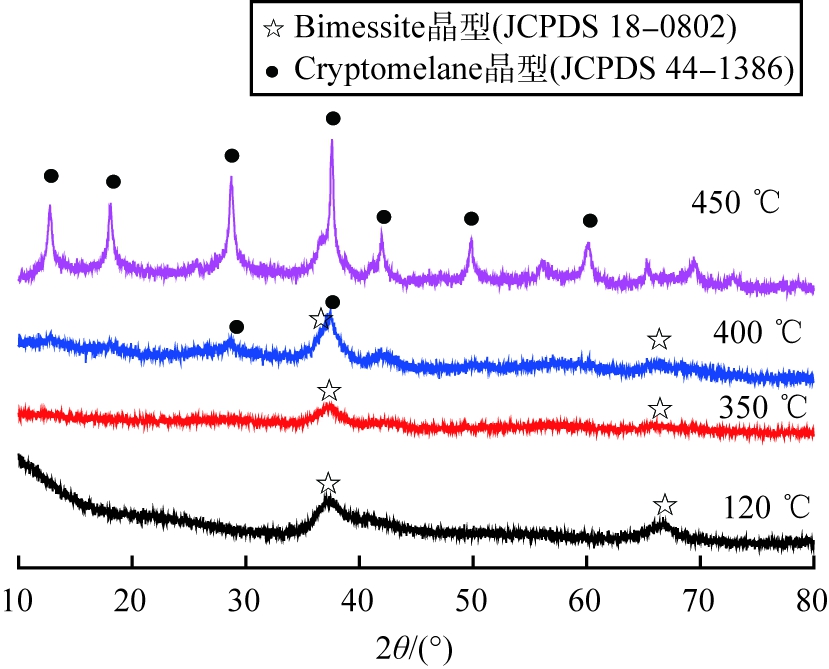
图6 不同热处理温度时主吸附材料MnOx纯样品的XRD图谱
Fig.6 XRD patterns of pure samples of MnOx as main adsorbent at different temperatures of heat treatment
2.4 多次再生和重复使用效果测评
选择MnOx、 甲基纤维素、硅溶胶和碱式碳酸镁的最优质量分数配比以及最佳热处理温度400 ℃,批量制备锰基吸附剂产品。最优制备条件时锰基吸附剂的实物图如图7所示,产品为直径为1.5 mm、长度为5 mm的规整圆柱状颗粒,颜色为均匀的深棕色。

图7 最优制备条件时锰基吸附剂的实物图
Fig.7 Physical map of manganese-based adsorbents under optimal preparation conditions
在吸附剂产品完成饱和吸附量测试后, 在400 ℃焙烧3 h进行再生, 然后继续进行饱和吸附量测试, 重复3次, 记录每次饱和吸附量数值, 锰基吸附剂产品多次再生和重复使用测试效果如图8所示。 由图8可见, 锰基吸附剂产品在多次再生与重复使用测试中, 甲苯和甲醛饱和吸附容量分别维持在[(0.42~0.43)±0.01]g/g, 表现出优越的多次重复使用效果。
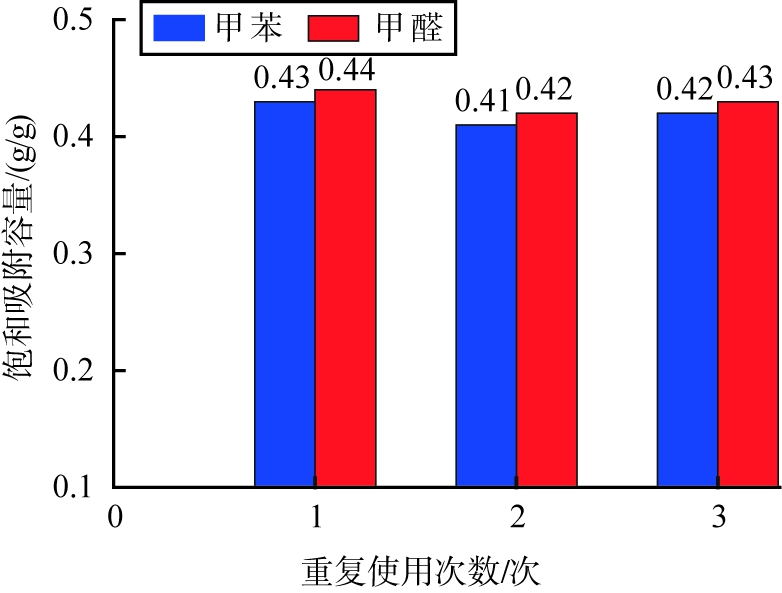
图8 最优制备条件时锰基吸附剂多次再生和重复使用效果测试图
Fig.8 Test chart of effects of multiple regeneration and repeated use of manganese-based adsorbent obtainedunder optimal preparation conditions
2.5 自制锰基吸附剂与商业吸附剂的对比
选择常见的多种商业吸附剂,如煤质活性炭、椰壳活性炭、变色硅胶和4A分子筛,与自制锰基吸附剂产品进行甲苯和甲醛饱和吸附容量的对比测试,结果见表2。由表2可见,自制锰基吸附剂产品的甲苯饱和吸附容量最大,达到为0.43 g/g;甲醛饱和吸附容量为0.44 g/g,也与煤质活性炭的吸附性能相当,表现出优异的VOCs吸附净化能力。
表2 自制锰基吸附剂颗粒与商业吸附剂的吸附性能
Tab.2 Adsorption performance of self-made manganese-based adsorbent particles and commercial adsorbents
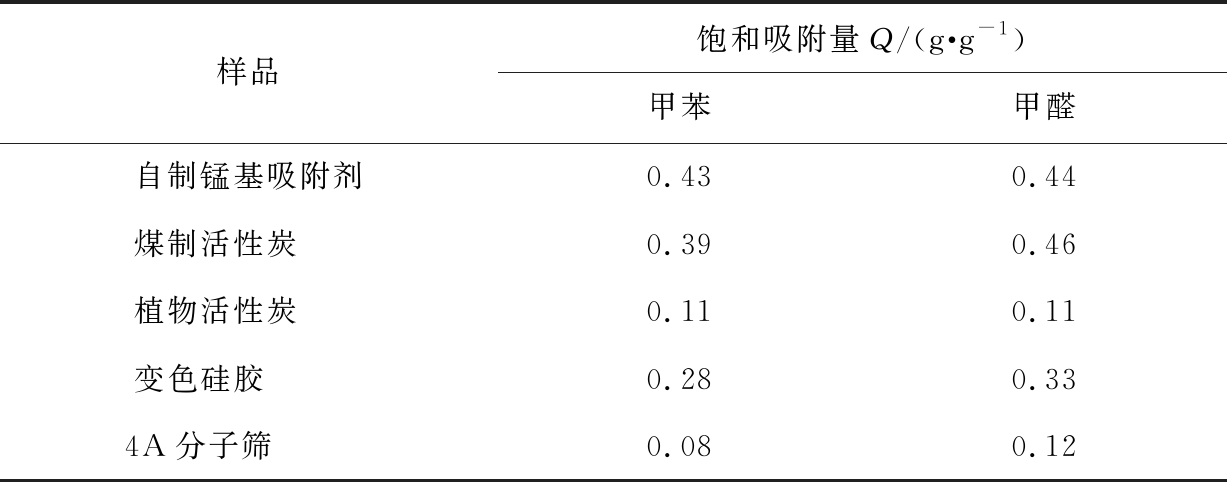
样品饱和吸附量Q/(g·g-1)甲苯甲醛自制锰基吸附剂0.430.44煤制活性炭 0.390.46植物活性炭 0.110.11变色硅胶 0.280.334A分子筛 0.080.12
图9是自制锰基吸附剂与煤质活性炭的N2吸附-脱附等温线及其孔径分布图。由图9 a)可知,煤质活性炭具有很大的BET比表面积(1 232 m2/g)和较大的比孔体积(0.43 cm3/g),这主要是由其微孔贡献的;由介孔孔径分布曲线可知,煤质活性炭的介孔尺寸较小,孔径主要集中在2~5 nm。由图9 b)可见,自制锰基活性炭虽然BET比表面积只有135 m2/g,但其吸附等温线具有明显的滞后环,表明材料具有丰富的介孔结构;由介孔孔径分布曲线可知,自制锰基吸附剂除了具有2~5 nm较小孔径介孔外,还具有大量孔径为6~33 nm的介孔结构,因此其材料孔体积并可达0.32 cm3/g。相对煤质活性炭,自制锰基吸附剂具有更多大孔径的介孔结构,使得锰基吸附剂对甲苯等大分子VOCs污染物有更优异的吸附能力。
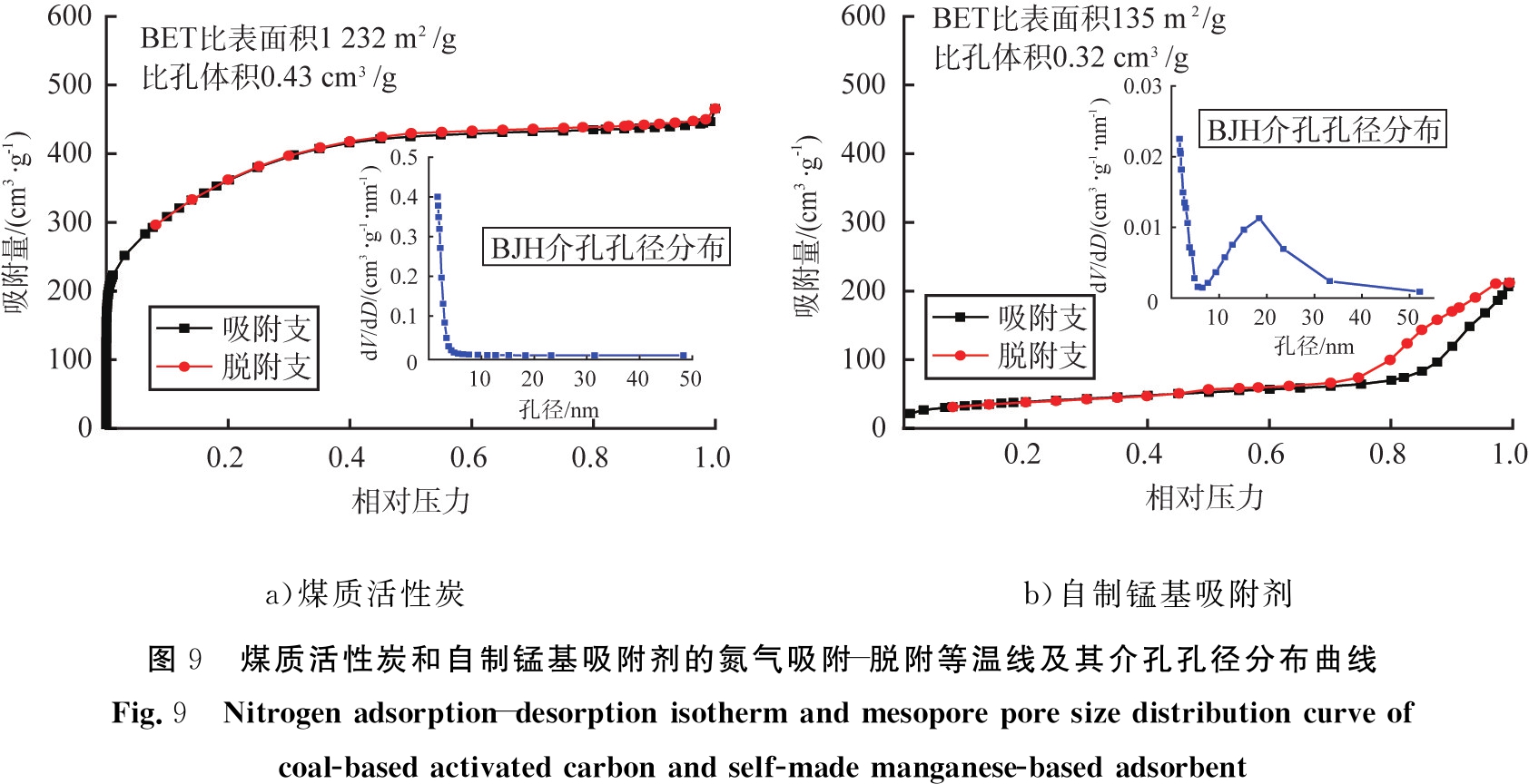
a)煤质活性炭b)自制锰基吸附剂图9 煤质活性炭和自制锰基吸附剂的氮气吸附-脱附等温线及其介孔孔径分布曲线Fig.9 Nitrogen adsorption-desorption isotherm and mesopore pore size distribution curve of coal-based activated carbon and self-made manganese-based adsorbent
为了对比样品的热稳定性, 自制锰基吸附剂和煤质活性炭的TG-DSC曲线见图10。 由图10 a)可见, 煤质活性炭在400~700 ℃的失质量分数约为80%, 释放出大量热量, 表明活性炭吸附材料在较高温度通过燃烧基本损耗完全。 文献[11]也指出普通活性炭的起燃点一般在300~400 ℃, 随着活性炭堆积量增多, 燃烧和爆炸的危险系数也越高。 由图10 b)可见, 自制锰基吸附剂在整个测试温度范围40~800 ℃内总失质量分数约为10%,没有明显的热量释放,这主要是因为吸附剂中残留的少量碱式碳酸镁和硅溶胶等的受热分解引起的。由此可见,自制锰基吸附剂表现出良好的耐热稳定性,预示产品的市场适用温度范围更广,使用过程也更安全。
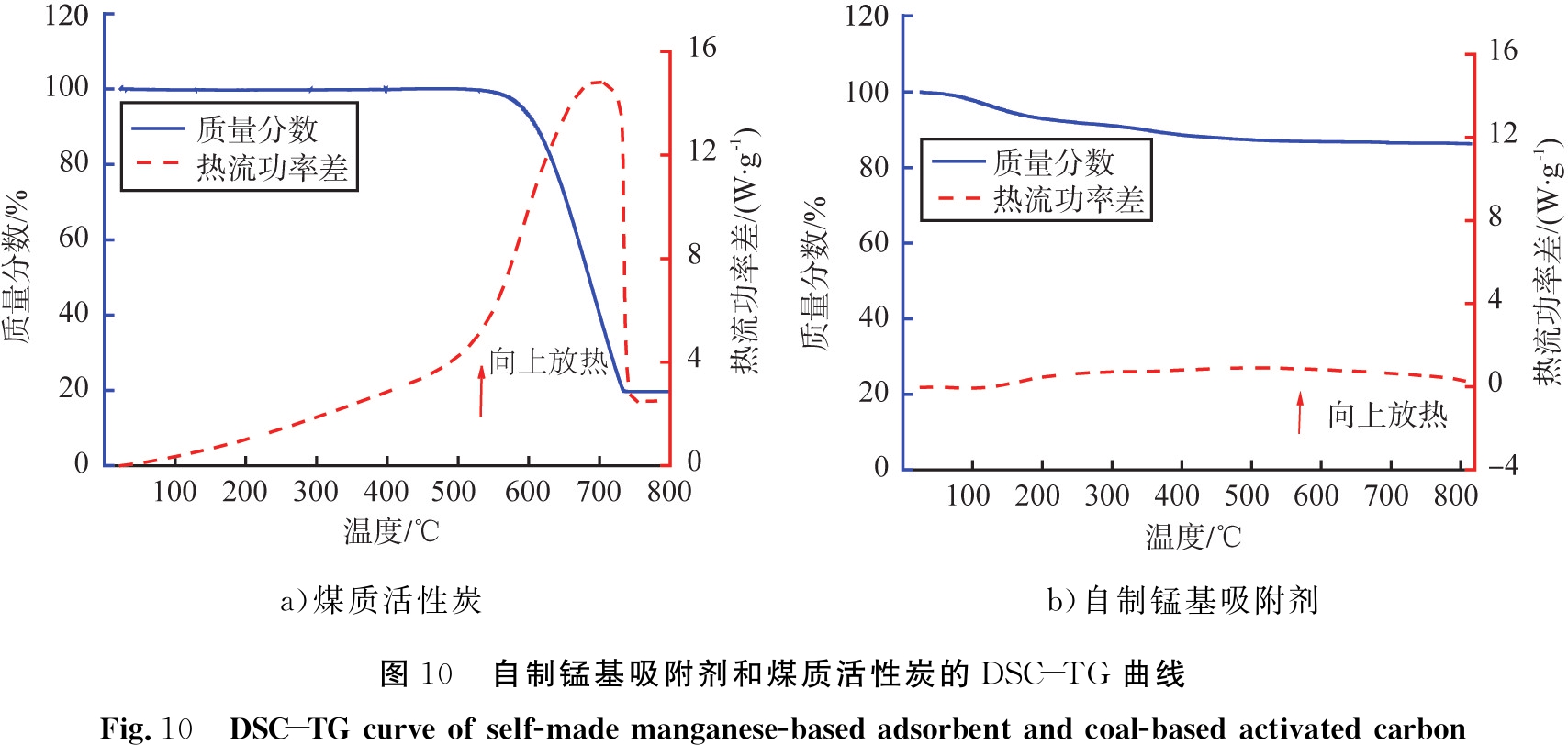
a)煤质活性炭b)自制锰基吸附剂图10 自制锰基吸附剂和煤质活性炭的DSC-TG曲线Fig.10 DSC-TG curve of self-made manganese-based adsorbent and coal-based activated carbon
3 结论
1)以锰氧化物为主吸附材料, 碱式碳酸镁为造孔剂,甲基纤维素为胶黏剂, 硅溶胶为结构助剂,采用挤条法制备锰基吸附剂,方法简单,吸附性能好,机械强度优。
2)成型吸附材料中造孔剂的质量分数和热处理温度是调变吸附性能的关键。通过控制变量法,得到造孔剂碱式碳酸镁最佳质量分数为43%,最优热处理温度为400 ℃。
3)自制锰基吸附剂产品的甲醛饱和吸附容量达0.44 g/g,与最优的煤质活性炭相当;经多次再生和重复使用甲苯吸附容量能维持在(0.42±0.01)g/g。
4)与活性炭相比,自制锰基吸附剂具有更多大孔径的介孔结构,对甲苯等大分子VOCs污染物有更优异的吸附能力;自制锰基吸附剂产品在25~800 ℃温度范围内无明显放热和失质量现象,表现出良好耐热稳定性,也预示该吸附剂在市场适用的温度范围更广,使用过程中的安全性更好。
[1]MOZAFFAR A, ZHANG Y L. Atmospheric volatile organic compounds (VOCs) in China: a review[J]. Current Pollution Reports, 2020, 6(3): 250-263.
[2]HE C, CHENG J, ZHANG X, et al. Recent advances in the catalytic oxidation of volatile organic compounds: a review based on pollutant sorts and sources[J]. Chemical Reviews, 2019, 119(7): 4471-4568.
[3]SINGLETON R, SALKOSKI A J, BULKOW L, et al. Housing characteristics and indoor air quality in households of Alaska Native children with chronic lung conditions[J]. Indoor Air, 2017, 27(2): 478-486.
[4]孟凡飞, 王海波, 刘志禹, 等. 工业挥发性有机物处理技术分析与展望[J]. 化工环保, 2019, 39(4): 387-395.
[5]ZHANG X, GAO B, CREAMER AE, et al. Adsorption of VOCs onto engineered carbon materials: a review[J]. Journal of Hazard Mater, 2017, 338(9): 102-123.
[6]DONG X A, CUI W, WANG H, et al. Promoting ring-opening efficiency for suppressing toxic intermediates during photocatalytic toluene degradation via surface oxygen vacancies[J]. Science Bulletin, 2019, 64(10): 669-678.
[7]YANG CT, MIAO G, PI YH, et al. Abatement of various types of VOCs by adsorption/catalytic oxidation: a review[J]. Chemical Engineering Journal, 2019, 370(8): 1128-1153.
[8]宋磊, 王春颖, 陈虹霖, 等. 不同孔结构对活性炭动态吸附高浓度甲苯的影响 [J]. 环境工程学报, 2017, 11(1): 457-464.
[9]李平, 尤飞, 周慧婷, 等. 煤质粉末活性炭自燃和热稳定性分析[J]. 安全与环境学报, 2017, 17(2): 435-439.
[10]王浩, 任红威, 张金锋, 等. 活性炭粉体燃爆特性实验研究[J]. 消防科学与技术, 2018, 37(10): 1301-1303.
[11]ZHANG H P, WU A B, FU H Y, et al. Efficient removal of Pb(Ⅱ) ions using manganese oxides: the role of crystal structure[J]. RSC Advances, 2017, 7(65): 41228-41240.
[12]DINH V-P, LE N C, TUYEN L A, et al. Insight into adsorption mechanism of lead(Ⅱ) from aqueous solution by chitosan loaded MnO2 nanoparticles[J]. Materials Chemistry and Physics, 2018, 207: 294-302.
[13]HU X H, ZHANG F S, WANG H, et al. Synthesis of MnO2 hollow nanospheres through selective etching method as an effective absorbent to remove methyl orange from aqueous solution[J]. Journal of Nanomaterials, 2019, 2019(1): 1-12.
[14]HE Y, JIANG B, CHEN J, et al. Synthesis of MnO2 nanosheets on montmorillonite for oxidative degradation and adsorption of methylene blue[J]. Journal of Colloid and Interface Science, 2018, 510: 207-220.
[15]SAINI V K, PIRES J. Synthesis of foam-shaped nanoporouszeolite material: a simple template-based method[J]. Journal of Chemical Education, 2011, 89(2): 276-279.
[16]HAURIE L, FERNANDEZ A I, VELASCO J I, et al. Effects of milling on the thermal stability of synthetic hydromagnesite[J]. Materials Research Bulletin, 2006, 42(6): 1010-1018.
[17]BOTHA A, STRYDOM C A. DTA and FT-IR analysis of the rehydration of basic magnesium magnesium carbonate[J]. Journal of Thermal Analysis and Calorimetry, 2003, 71(3): 987-996.
[18]ATRIBAK I, BUENO-L PEZ A,GARC
PEZ A,GARC A-GARC
A-GARC A, et al. Catalytic activity for soot combustion of birnessite and cryptomelane[J]. Applied Catalysis B: Environmental, 2009, 93(3/4): 267-273.
A, et al. Catalytic activity for soot combustion of birnessite and cryptomelane[J]. Applied Catalysis B: Environmental, 2009, 93(3/4): 267-273.
[19]BIRKNER N, NAVROTSKY A. Thermodynamics of manganese oxides: sodium, potassium, and calcium birnessite and cryptomelane[J]. Proceedings of the National Academy of Sciences, 2017, 114(7): 1046-1053.