水滑石,又称层状双金属氢氧化物(layered double hydroxides, LDHs),归类为胶体纳米材料。LDHs具有较大的比表面积、可调变的主体层板和可交换层间阴离子等性质[1-4],独特的结构和性质使其可以作为优良的吸附剂,高效去除水中有毒的重金属离子和阴离子氧化物[5-8]。以六价铬(Cr(VI))为例,工业生产活动导致了大量Cr(VI)排放到水体中,造成了严重的环境污染,并影响社会的可持续发展[9-10],而利用纳米材料吸附水中Cr(VI)是一种有效的去除方法[11-12]。国内外学者对LDHs去除废水中Cr(VI)进行了广泛的研究。 Lu等[13]制备了Ni和Fe不同物质的量之比(4∶1、 3∶1、 7∶3和1∶1)的NiFe-LDH, 其中Ni4Fe1-LDH对Cr(VI)的饱和吸附容量为26.78 g/kg, 吸附过程符合拟二级动力学模型和Langmuir等温线模型。 Li等[14]将EDTA插入MgAl-LDH层间制备了MgAl-EDTA-LDH, 具有更大的层间距、 更丰富的官能团, 对Cr(VI)的吸附容量为47.62 g/kg, 吸附机理涉及静电吸引、 表面络合、 层间阴离子交换和还原反应。Gore等[15]将LDHs与聚丙烯腈(PAN)纳米纤维交织在一起, 获得了一种新型多功能LDH-PAN纳米复合膜, 对质量浓度为10 mg/L Cr(VI)溶液具有99%以上的去除效率。 Chen等[16]采用水热法将NiAl-LDH修饰在H3PO4活化的多孔碳上(Ni-Al@PAB), 基于2种材料的优势叠加,Ni-Al@PAB对Cr(VI)表现了良好的吸附性能,最大吸附量为271.5 g/kg。Ogata等[17]制备了2种不同物质的量之比的MgFe-LDH(n(Mg2+)/n(Fe3+)=3.0或5.0), 对Cr(VI)的吸附量随温度的升高而增加,在Cr(VI)的单一体系中的吸附量比Cr(VI)和As(III)的二元体系中的小,说明吸附量受吸附剂性能、层间空间和溶液pH值的影响。Yue等[18]制备了层间阴离子为Cl-的MgAl-Cl-LDH,并用于去除水中的Cr(VI)和Cu(II),发现其对两者的吸附量比单一吸附Cu(II)和Cr(VI)分别提高81.05%和49.56%,其共吸附过程机理包括Cr(VI)与层间Cl-的阴离子交换、Mg2+与Cu2+的同构取代、形成Cu2Cl(OH)3沉淀以及Cu2Cl(OH)3对Cr(VI)的吸附。Tran等[2]综述了LDHs对Cr(VI)的吸附研究进展并对其吸附机理进行了系统的分析,认为LDHs表面的羟基质子化后对Cr(VI)具有较强的亲和力,通过静电吸引将铬酸根吸附在表面;铬酸根还能与LDHs的层间阴离子![]() 和
和![]() 交换;当Cr(VI)与电子供体提供的电子相互作用时被还原为Cr(III),还原后的Cr(III)通过同构取代和络合等多种作用机制被LDHs吸附。
交换;当Cr(VI)与电子供体提供的电子相互作用时被还原为Cr(III),还原后的Cr(III)通过同构取代和络合等多种作用机制被LDHs吸附。
LDHs的结构式为![]() 其中M2+和M3+为金属阳离子,最常用的元素是Mg2+和Al3+[1-2],Ca2+和Fe2+更为常见,作为M2+制备水滑石的研究较少[19-20],因此本研究中从LDHs的特性和制备方法出发,针对性地利用Ca2+和Fe2+作为二价金属离子,采用水热法制备了CaAl-LDH和FeAl-LDH 2种水滑石,以工业废水中常见的Cr(VI)为代表性重金属污染物,研究其吸附性能。
其中M2+和M3+为金属阳离子,最常用的元素是Mg2+和Al3+[1-2],Ca2+和Fe2+更为常见,作为M2+制备水滑石的研究较少[19-20],因此本研究中从LDHs的特性和制备方法出发,针对性地利用Ca2+和Fe2+作为二价金属离子,采用水热法制备了CaAl-LDH和FeAl-LDH 2种水滑石,以工业废水中常见的Cr(VI)为代表性重金属污染物,研究其吸附性能。
1 实验
1.1 试剂、材料
硝酸钙(Ca(NO3)2·4H2O)和硝酸钠(NaNO3)(分析纯, 天津市大茂化学试剂厂); 硝酸铝(Al(NO3)3·9H2O分析纯,天津市红岩化学试剂厂);氢氧化钠(NaOH,分析纯,国药集团化学试剂有限公司);氯化亚铁(FeCl2·4H2O,分析纯,天津市广成化学试剂有限公司)。
1.2 CaAl-LDH和FeAl-LDH的制备
将3.78 g的Ca(NO3)2·4H2O和3.09 g的Al(NO3)3·9H2O加入到50 mL浓度为0.5 mol/L的NaNO3溶液中,超声1 h,然后不断搅拌的同时,用浓度为2 mol/L的NaOH溶液逐滴加入到上述溶液中,直至溶液pH值维持在12左右。将上述混合物转移到反应釜,置于鼓风干燥箱中,100 ℃反应36 h,冷却后取出,用蒸馏水洗涤3次,在80 ℃条件下干燥12 h,过0.150 mm筛,得到CaAl-LDH。
将8.0 g的FeCl2·4H2O和4.8 g的AlCl3·6H2O加入到150 mL的去离子水中,超声1 h,得到均匀的混合溶液,然后在不断搅拌的同时,用浓度为4 mol/L的NaOH溶液缓慢加入到上述溶液中,直到溶液pH值维持在10左右。将上述混合物转移到反应釜,置于鼓风干燥箱中,120 ℃反应24 h,冷却后取出,用蒸馏水洗涤3次,在80 ℃干燥12 h,过孔径0.150 mm筛,得到FeAl-LDH。
1.3 样品表征测试
采用D8 Advance型X-射线衍射仪(XRD, 德国Bruker公司)对CaAl-LDH和FeAl-LDH进行晶体结构分析,扫描范围为5 °~90 °,扫描速度为0.03 °/s;采用Vertex 70型红外光谱仪(FTIR, 德国Bruker公司)对样品的表面官能团进行分析,光谱范围为400~4 000 cm-1,步频为4 cm-1;使用S4800型扫描电镜(SEM, 日本Hitachi公司)观察材料的微观形貌和元素分布;使用ASAP2460比表面积分析仪(美国Micromeritics公司)测定样品的比表面积、孔容和孔径大小。
1.4 吸附作用
首先配制质量浓度为1 000 mg/L的Cr(VI)储备液, 然后将储备液稀释到不同质量浓度用于吸附实验。 在50 mL离心管中, 分别先加入0.03 g的CaAl-LDH或FeAl-LDH吸附剂,再加入20 mL Cr(VI)溶液,置于恒温振荡箱内进行吸附实验(T=298 K;v=200 r/min)。吸附反应结束后采用离心机进行固液分离。上清液中Cr(VI)的质量浓度采用二苯碳酰二肼分光光度法(GB 7467—1987)测定,显色后在波长540 nm测定吸光度。吸附率(R,%)和吸附量(qe,mg/g)采用下述公式进行计算:
(1)
(2)
式中: ρ0为Cr(VI)的初始质量浓度, mg/L; ρe为吸附后Cr(VI)的质量浓度, mg/L; m为吸附剂的质量, g;V为溶液体积,L。
根据预实验结果,Cr(VI)溶液的质量浓度设为50 mg/L。为研究溶液初始pH值对吸附性能的影响,用体积分数为5%的HCl或0.1 mol/L的NaOH溶液调节溶液初始pH值在2~10左右,加入0.03 g的CaAl-LDH或FeAl-LDH,振荡180 min。为研究吸附时间的影响,在20 mL 50 mg/L Cr(VI)溶液中分别加入0.03 g的CaAl-LDH或FeAl-LDH,振荡5~120 min。为绘制吸附等温线,将Cr(VI)储备液分别稀释到5~200 mg/L,在20 mL Cr(VI)溶液中加入0.03 g的CaAl-LDH或FeAl-LDH,振荡180 min。为研究常见阴离子对CaAl-LDH和FeAl-LDH吸附Cr(VI)的影响,在20 mL 50 mg/L Cr(VI)溶液中分别加入0.03 g的CaAl-LDH或FeAl-LDH后,再分别加入质量浓度为1 mL 1 000 mg/L的Cl-、 ![]() 或
或![]() 溶液,振荡180 min,至反应达到平衡。将Cr(VI)溶液加入自来水、 湖水、 黄河水或泉水中,使Cr(VI)的质量浓度为50 mg/L,然后加入水滑石吸附剂,进行实际水样中Cr(VI)的去除性能实验。
溶液,振荡180 min,至反应达到平衡。将Cr(VI)溶液加入自来水、 湖水、 黄河水或泉水中,使Cr(VI)的质量浓度为50 mg/L,然后加入水滑石吸附剂,进行实际水样中Cr(VI)的去除性能实验。
2 结果与讨论
2.1 产物表征
图1、 2分别为CaAl-LDH和FeAl-LDH的SEM表征结果。水热法合成的CaAl-LDH和FeAl-LDH都呈现出不规则的正六边形片状结构,其中CaAl-LDH表面略粗糙,均是LDHs材料的典型结晶形态[21]。通过图1和图2的EDS元素分布图可以看到,O、 Al和Ca元素在CaAl-LDH的表面均匀分布,FeAl-LDH的表面均匀分布了O、 Al和Fe元素。

a)SEM图像

b)元素分布图
图1 CaAl-LDH的SEM图像和元素分布图
Fig.1 SEM images and element distribution diagram of CaAl-LDH

a)SEM图像
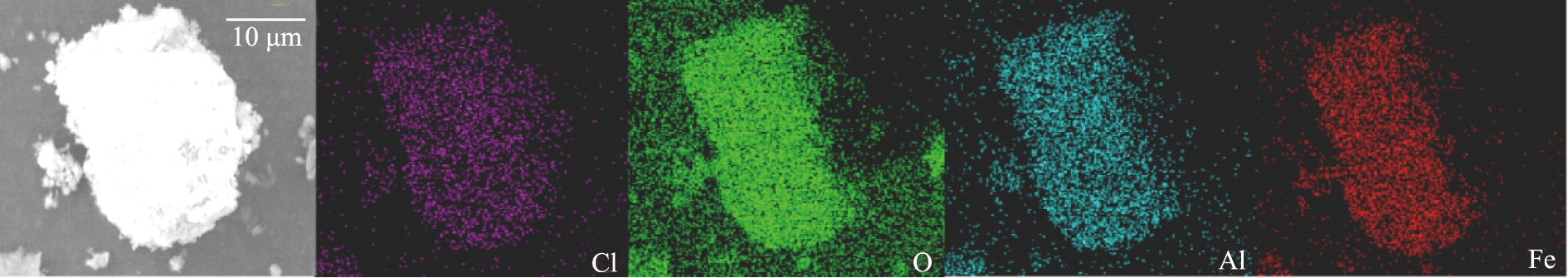
b)元素分布图
图2 FeAl-LDH的SEM图像和元素分布图
Fig.2 SEM images and element distribution diagram of FeAl-LDH
LDHs的(003)、 (006)、 (012)和(015)晶面衍射峰通常出现在2θ为10.37 °、 20.95 °、 31.77 °和36.75 °处左右的位置[22-23]。 如图3 a)所示,CaAl-LDH的(003)、 (006)、 (012)和(015)晶面衍射峰较强,分别出现在2θ=10.31 °、 20.66 °、 31.14 °和38.50 °处, 说明CaAl-LDH材料具有LDHs的特征衍射峰; FeAl-LDH的(003)和(006)晶面衍射峰出现在2θ的10.25 °和20.76 °处, 说明FeAl-LDH也为典型的LDHs层状结构。
图3 b)是CaAl-LDH和FeAl-LDH的FTIR谱图。FeAl-LDH和CaAl-LDH在3 500 cm-1处都具有宽而强的吸收带,是属于—OH的伸缩振动[24-25]。在FeAl-LDH的FTIR图谱中,1 624 cm-1处附近的吸收带归因于H—O—H的伸缩振动,CaAl-LDH在1 651、 1 348 cm-1处的特征峰归因于N![]() O的伸缩振动,位于1 022 cm-1处的峰是C—N的伸缩振动,782、 510 cm-1处的特征峰归属于M—O—M的伸缩振动[26]。
O的伸缩振动,位于1 022 cm-1处的峰是C—N的伸缩振动,782、 510 cm-1处的特征峰归属于M—O—M的伸缩振动[26]。
图3 c)是CaAl-LDH、FeAl-LDH的N2吸附-解吸等温线,按照IUPAC的描述,CaAl-LDH和FeAl-LDH吸附-脱附曲线均属于IV型并伴有H3型迟滞回线[27]。 在较高的压力比范围(P/P0=0.8~1.0), 吸附容量快速增加, 说明合成的水滑石材料是介孔结构。 CaAl-LDH和FeAl-LDH的平均孔径分别为31.48、 8.20 nm,孔体积分别为0.050、 0.379 cm3/g,比表面积分别为8.746、 159.5 m2/g。FeAl-LDH的比表面积比CaAl-LDH的大,会提供更多的吸附位点,因此能够改善其吸附性能。
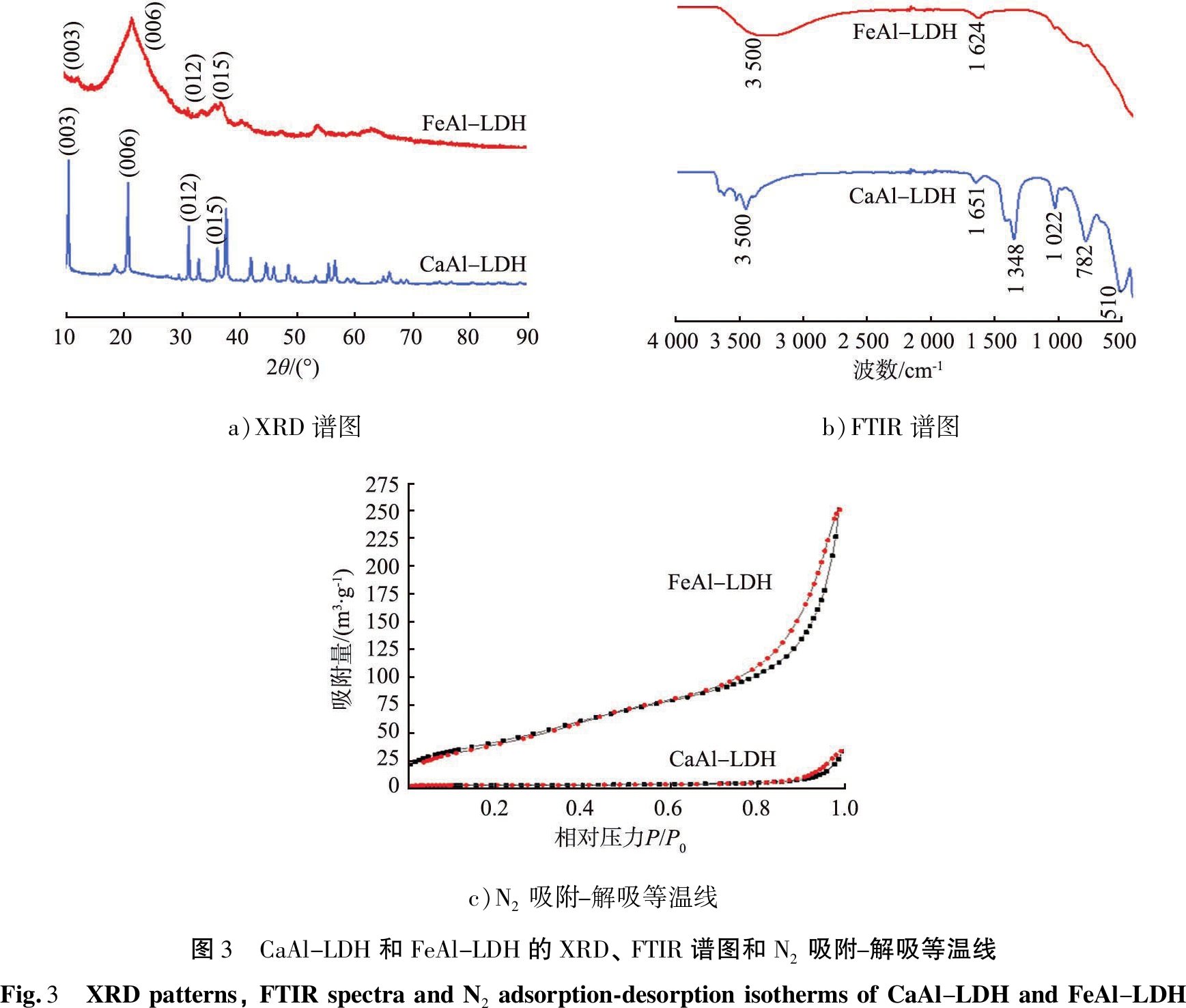
a)XRD谱图b)FTIR谱图c)N2吸附-解吸等温线图3 CaAl-LDH和FeAl-LDH的XRD、FTIR谱图和N2吸附-解吸等温线Fig.3 XRDpatterns,FTIRspectraandN2adsorption-desorptionisothermsofCaAl-LDHandFeAl-LDH
2.2 水滑石吸附Cr(VI)的实验条件优化
溶液的pH值会影响Cr(VI)在水中的存在状态,同时也是影响吸附剂表面酸碱性质的重要因素。图4 a)是初始溶液pH值对CaAl-LDH和FeAl-LDH去除Cr(VI)的影响, 可见溶液pH值的变化对CaAl-LDH和FeAl-LDH吸附Cr(VI)的影响很小, 去除率保持在90%以上。 考虑到实际废水的pH值为6~9, 在后续的实验中未调整溶液的pH值。
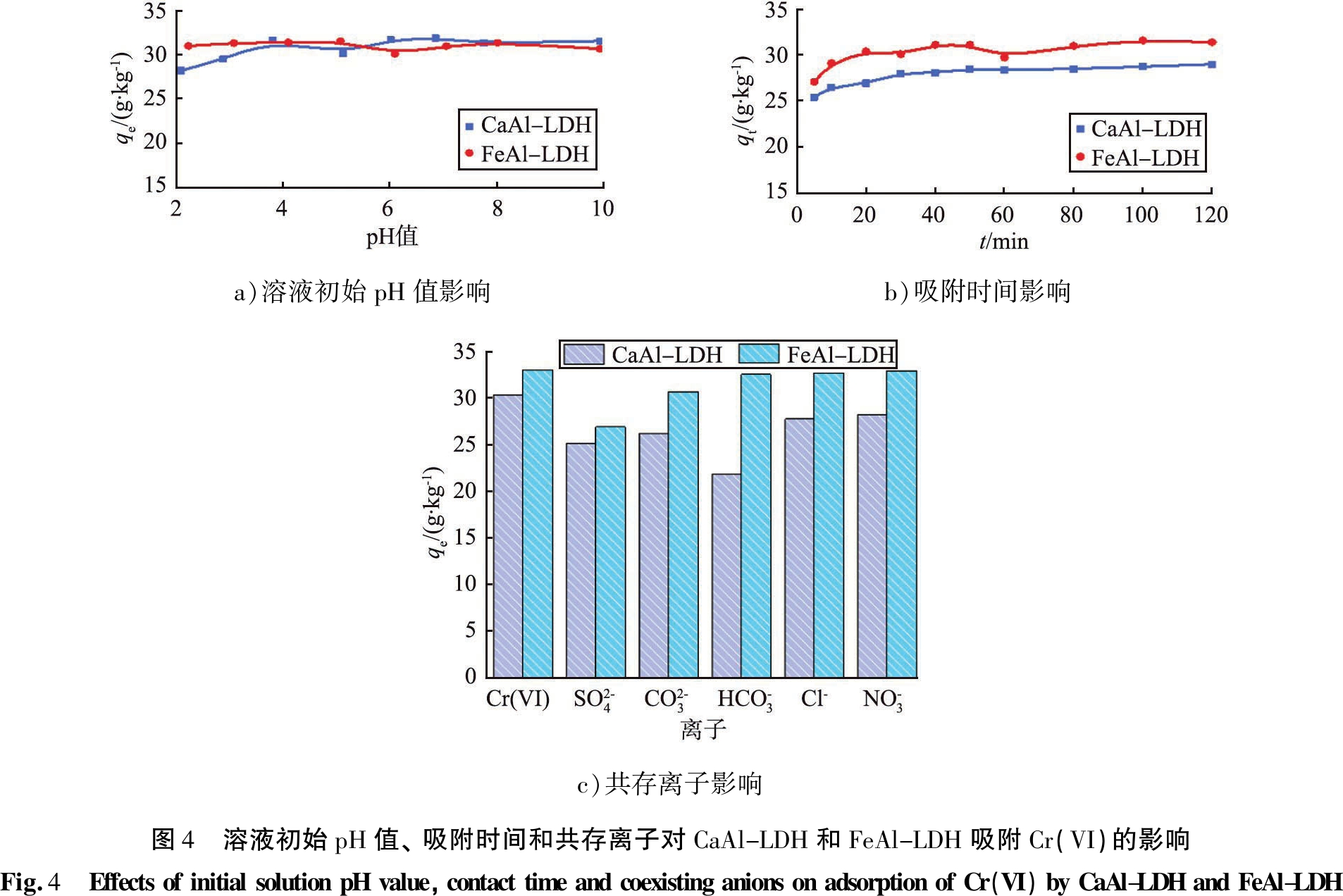
a)溶液初始pH值影响b)吸附时间影响c)共存离子影响图4 溶液初始pH值、吸附时间和共存离子对CaAl-LDH和FeAl-LDH吸附Cr(VI)的影响Fig.4 EffectsofinitialsolutionpHvalue,contacttimeandcoexistinganionsonadsorptionofCr(VI)byCaAl-LDHandFeAl-LDH
图4 b)为吸附时间与吸附量的关系曲线。在10 min时,CaAl-LDH和FeAl-LDH的吸附容量分别为26.48、 29.12 mg/g。随着时间地增加,CaAl-LDH和FeAl-LDH对Cr(VI)的吸附量缓慢增加,随后达到平衡状态,因此在后续实验中,选择30 min作为吸附振荡时间。
在实际废水中存在的各种阴离子,也是影响吸附剂去除Cr(VI)的重要因素。图4 c)是共存离子![]() 和
和![]() 对CaAl-LDH和FeAl-LDH去除Cr(VI)的影响。加入的
对CaAl-LDH和FeAl-LDH去除Cr(VI)的影响。加入的![]() 和
和![]() 对FeAl-LDH去除Cr(VI)几乎没有影响,而
对FeAl-LDH去除Cr(VI)几乎没有影响,而![]() 和
和![]() 的加入稍微降低了其对Cr(VI)去除,可能是这2种二价阴离子与铬酸根阴离子的竞争吸附所致;对于CaAl-LDH,加入的常见阴离子均使其对Cr(VI)吸附量有所降低。
的加入稍微降低了其对Cr(VI)去除,可能是这2种二价阴离子与铬酸根阴离子的竞争吸附所致;对于CaAl-LDH,加入的常见阴离子均使其对Cr(VI)吸附量有所降低。
2.3 动力学研究
吸附动力学是对吸附过程分析的重要分析手段。采用拟一级和拟二级动力学方程对实验数据进行了动力学分析[28-30],所用公式如下:
(3)
(4)
式中: t为水滑石与Cr(VI)的反应时间, min; qe和qt分别为反应平衡时和t时对Cr(VI)的去除量, g/kg; k1为拟一级动力学方程速率常数, 1/min; k2为拟二级动力学方程速率常数,g/(mg·min)。
表1和图5分别为动力学模型的计算参数和拟合图。从表1中相关系数(R2)可知,CaAl-LDH和FeAl-LDH吸附剂对Cr(VI)的吸附去除与拟二级动力学方程(R2>0.999)拟合较好,拟二级方程计算的吸附量和实测值非常接近,也进一步表明该吸附过程符合拟二级动力学,主要是化学吸附控制,这与文献报道的一致[14,21]。
表1 CaAl-LDH和FeAl-LDH吸附Cr(VI)的动力学方程参数
Tab.1 Adsorption kinetic constants of CaAl-LDH and FeAl-LDH for Cr(VI)
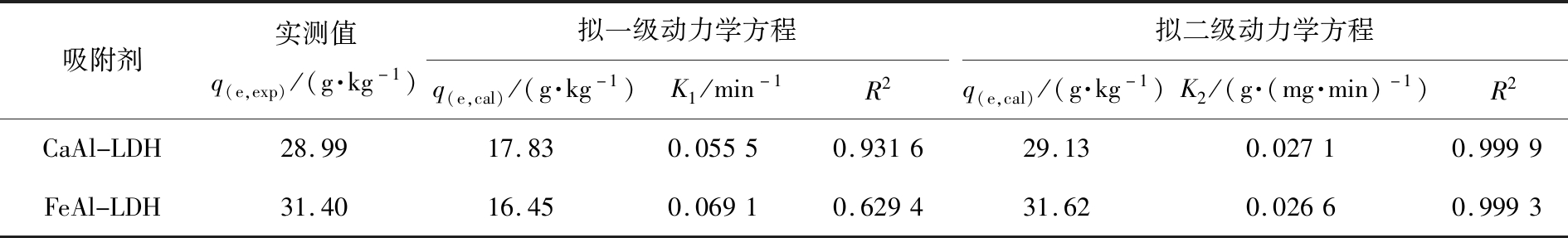
吸附剂实测值q(e,exp)/(g·kg-1)拟一级动力学方程q(e,cal)/(g·kg-1)K1/min-1R2拟二级动力学方程q(e,cal)/(g·kg-1)K2/(g·(mg·min)-1)R2CaAl-LDH28.9917.830.05550.931629.130.02710.9999FeAl-LDH31.4016.450.06910.629431.620.02660.9993
2.4 等温线研究
在优化的实验条件下进行了CaAl-LDH和FeAl-LDH吸附去除水中Cr(VI)的吸附等温线实验,结果见图6,并用常见的Langmuir和Freundlich等温线吸附模型拟合了实验数据[31-33]。所用方程如下:
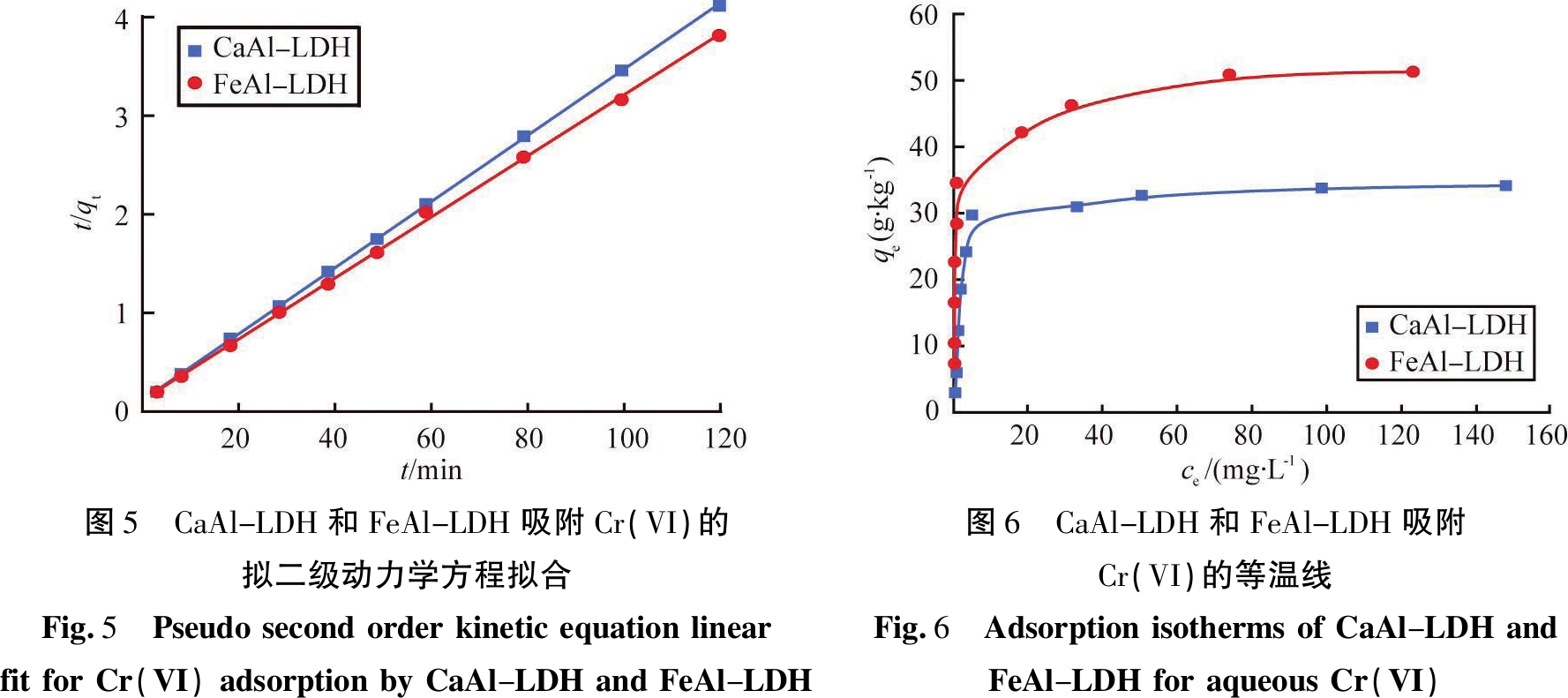
图5 CaAl-LDH和FeAl-LDH吸附Cr(VI)的拟二级动力学方程拟合Fig.5 PseudosecondorderkineticequationlinearfitforCr(VI)adsorptionbyCaAl-LDHandFeAl-LDH图6 CaAl-LDH和FeAl-LDH吸附Cr(VI)的等温线Fig.6 AdsorptionisothermsofCaAl-LDHandFeAl-LDHforaqueousCr(VI)
qe=qmKLρe/(1+KLρe),
(5)
(6)
式中: qe和qm分别表示2种水滑石的平衡吸附量和最大吸附量, g/kg; ρe为吸附平衡时Cr(VI)溶液的质量浓度, mg/L; KL为Langmuir方程的常数, L/mg; KF为Freundlich方程的常数,(g/kg) (L/mg)n。
表2是等温线数据拟合后得到的相关参数。从R2值可以看出,Langmuir方程较好地拟合了CaAl-LDH和FeAl-LDH吸附去除溶液中Cr(VI)的等温线数据,对Cr(VI)的理论最大吸附量分别为34.92、 51.31 mg/g,说明FeAl-LDH的吸附性能优于CaAl-LDH,与比表面积数据一致。
表2 CaAl-LDH和FeAl-LDH吸附Cr(VI)的等温线模型参数
Tab.2 Adsorption isotherm constants of CaAl-LDH and FeAl-LDH for Cr(VI)
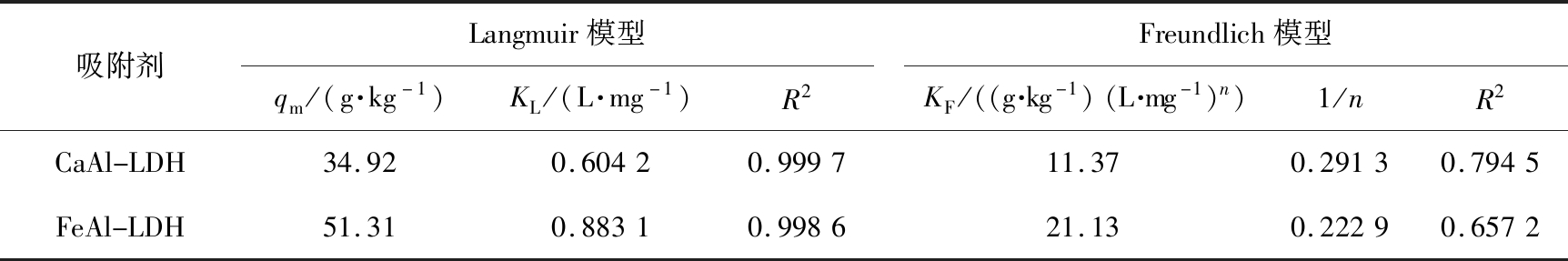
吸附剂Langmuir模型qm/(g·kg-1)KL/(L·mg-1)R2Freundlich模型KF/((g·kg-1)(L·mg-1)n)1/nR2CaAl-LDH34.920.60420.999711.370.29130.7945FeAl-LDH51.310.88310.998621.130.22290.6572
2.5 吸附剂评价
表3是不同水滑石对Cr(VI)吸附性能的比较。与其他报道的LDHs吸附剂相比,CaAl-LDH和FeAl-LDH的最大吸附容量较高,且水溶液pH值对吸附过程的影响较小,因此,CaAl-LDH和FeAl-LDH可作为高效去除Cr(VI)的优良吸附剂,具有广阔的应用前景。
表3 不同LDH对Cr(VI)吸附性能比较
Tab.3 Comparison of adsorption capacities of various LDHs for aqueous Cr(VI)
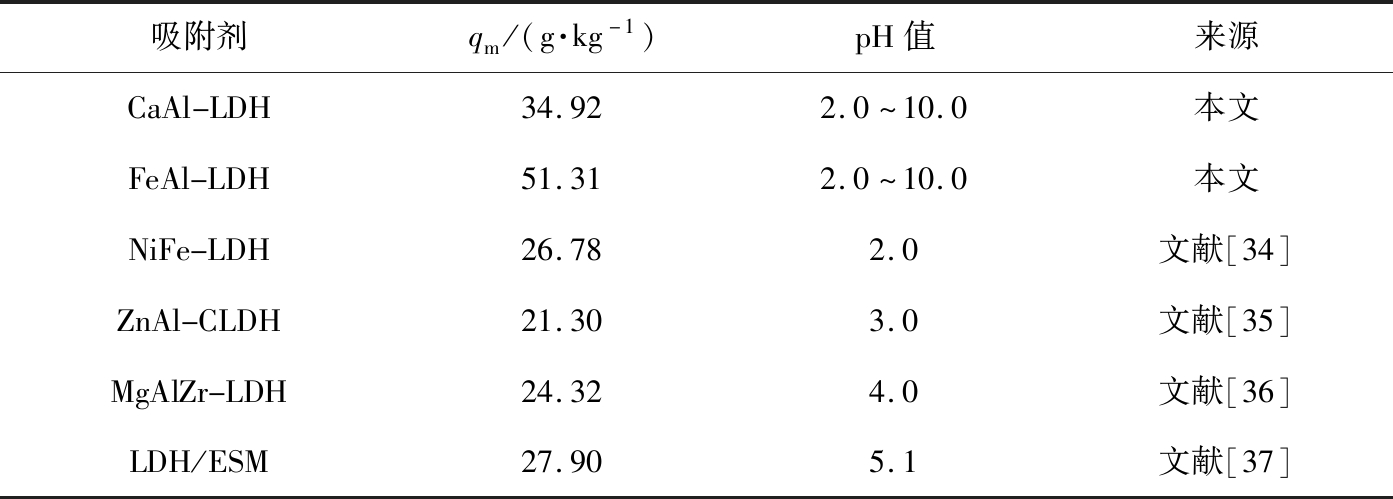
吸附剂qm/(g·kg-1)pH值来源CaAl-LDH34.922.0~10.0本文FeAl-LDH51.312.0~10.0本文NiFe-LDH26.782.0文献[34]ZnAl-CLDH21.303.0文献[35]MgAlZr-LDH24.324.0文献[36]LDH/ESM27.905.1文献[37]
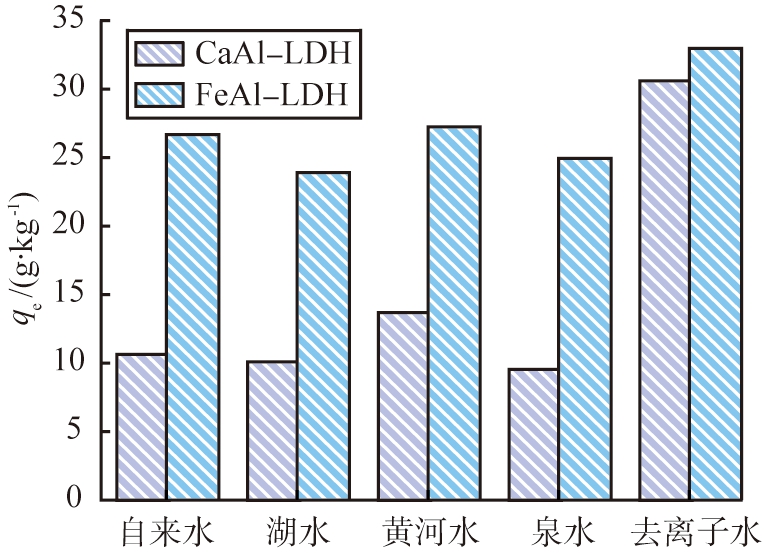
图7 FeAl-LDH和CaAl-LDH对实际水样中Cr(VI)的吸附量
Fig.7 Adsorption capacities of FeAl-LDH and CaAl-LDH for Cr(VI) in real wastewater samples
图7为2种水滑石去除实际水样中Cr(VI)的效果。相比于去除蒸馏水中的Cr(VI), FeAl-LDH对实际水样中Cr(VI)的吸附量有所减小,而CaAl-LDH对实际水样中Cr(VI)的吸附量减少较大,这可能与实际水样中含有较多的离子,存在竞争吸附有关。FeAl-LDH在实际水样中对Cr(VI)的吸附量仍在25 g·kg-1左右,说明有较大的应用价值。
3 结论
1)以常见的Ca、 Fe、 Al盐为原材料,采用水热法制备了2种水滑石纳米材料CaAl-LDH和FeAl-LDH,XRD、 FTIR、 SEM和BET表征结果说明材料呈六边形片状结构,具有典型的水滑石特征衍射峰,FeAl-LDH的比表面积大于CaAl-LDH的。
2)通过静态吸附实验对CaAl-LDH和FeAl-LDH吸附Cr(VI)的实验条件进行了优化,最佳实验条件为:振荡时间30 min,不受溶液初始pH的影响,溶液中共存的阴离子对吸附影响较小。
3)CaAl-LDH和FeAl-LDH对Cr(VI)的吸附过程较快,在30 min达到平衡,动力学数据均符合拟二级动力学模型。
4)CaAl-LDH和FeAl-LDH吸附Cr(VI)的等温线符合Langmuir模型,理论最大吸附量分别为34.92、 51.31 g/kg。
[1]张爽, 丁欣欣, 闫良国. 改性水滑石类材料的制备及其吸附性能研究进展[J]. 中国粉体技术, 2021, 27(1): 1-10.
[2]TRAN H N, NGUYEN D T, LE G T, et al. Adsorption mechanism of hexavalent chromium onto layered double hydroxides-based adsorbents: a systematic in-depth review[J]. Journal of Hazardous Materials, 2019, 373: 258-270.
[3]JOSE N A, ZENG H C, LAPKIN A A. Hydrodynamic assembly of two-dimensional layered double hydroxide nanostructures[J]. Nature Communication, 2018, 9(1): 4913-4917.
[4]ZUBAIR M, DAUD M, MCKAY G, et al. Recent progress in layered double hydroxides (LDH)-containing hybrids as adsorbents for water remediation[J]. Applied Clay Science, 2017, 143: 279-292.
[5]GUPTA K, HUO J B, YANG J C, et al. (MoS4)2- intercalated CAMoS4·LDH material for the efficient and facile sequestration of antibiotics from aqueous solution[J]. Chemical Engineering Journal, 2019, 355: 637-649.
[6]ASIABI H, YAMINI Y, SHAMSAYEI M, et al. Highly selective and efficient removal and extraction of heavy metals by layered double hydroxides intercalated with the diphenylamine-4-sulfonate: a comparative study[J]. Chemical Engineering Journal, 2017, 323: 212-223.
[7]YU S J, WANG X X, CHEN Z S, et al. Layered double hydroxide intercalated with aromatic acid anions for the efficient capture of aniline from aqueous solution[J]. Journal of Hazardous Materials, 2017, 321: 111-120.
[8]CHEN H, LIN J H, ZHANG N, et al. Preparation of MgAl-EDTA-LDH based electrospun nanofiber membrane and its adsorption properties of copper(II) from wastewater[J]. Journal of Hazardous Materials, 2018, 345: 1-9.
[9]ZHANG L, FU F L, TANG B. Adsorption and redox conversion behaviors of Cr(VI) on goethite/carbon microspheres and akaganeite/carbon microspheres composites[J]. Chemical Engineering Journal, 2019, 356: 151-160.
[10]RAJAPAKSHA A U, VITHANAG M, OK Y S, et al. Cr(VI) Formation related to Cr(III)-muscovite and birnessite interactions in ultramafic environments[J]. Environmental Science & Technology, 2013, 47(17): 9722-9729.
[11]张帆, 李菁, 谭建华, 等. 吸附法处理重金属废水的研究进展[J]. 化工进展, 2013, 11: 220-227.
[12]苏欣悦, 丁欣欣, 闫良国. 改性水Fe3O4磁性纳米材料的制备及水处理应用进展[J]. 中国粉体技术, 2020, 26(6): 1-10.
[13]LU Y, JIANG B, FANG L, et al. High performance NiFe layered double hydroxide for methyl orange dye and Cr(VI) adsorption[J]. Chemosphere, 2016, 152: 415-422.
[14]LI J, YAN L G, YANG Y T, et al. Insight into the adsorption mechanisms of aqueous hexavalent chromium by EDTA intercalated layered double hydroxides: XRD, FTIR, XPS, and zeta potential studies[J]. New Journal of Chemistry, 2019, 43: 15915-15923.
[15]GORE C T, OMWOMA S, CHEN W, et al. Interweaved LDH/PAN nanocomposite films: application in the design of effective hexavalent chromium adsorption technology[J]. Chemical Engineering Journal, 2016, 284: 794-801.
[16]CHEN S X, HUANG Y F, HAN X X, et al. Simultaneous and efficient removal of Cr(VI) and methyl orange on LDHs decorated porous carbons[J]. Chemical Engineering Journal, 2018, 352: 306-315.
[17]OGATA F, UETA E, KAWASAKI N. Characteristics of a novel adsorbent Fe-Mg-type hydrotalcite and its adsorption capability of As(III) and Cr(VI) from aqueous solution[J]. Journal of Industrial and Engineering Chemistry, 2018, 59: 56-63.
[18]YUE X Y, LIU W Z, CHEN Z L, et al. Simultaneous removal of Cu(II) and Cr(VI) by Mg-Al-Cl layered double hydroxide and mechanism insight[J]. Journal of Environmental Sciences, 2017, 53: 16-26.
[19]HE X, QIU XH, CHEN JY. Preparation of Fe(II)-Al layered double hydroxides: application to the adsorption/reduction of chromium[J]. Colloids and Surfaces A: Physicochemical and Engineering Aspects, 2017, 516: 362-374.
[20]贾云生, 王火焰, 赵雪松, 等. CaAl类水滑石的磷酸根吸附性能及其影响因素研究[J]. 化学学报, 2015, 73(11): 1207-1213.
[21]SHAN R R, YAN L G, YANG K, et al. Magnetic Fe3O4/MgAl-LDH composite for effective removal of three red dyes from aqueous solution[J]. Chemical Engineering Journal, 2014, 252: 38-46.
[22]WANG X X, YU S Q, WU Y H, et al. The synergistic elimination of uranium (VI) species from aqueous solution using bi-functional nanocomposite of carbon sphere and layered double hydroxide[J]. Chemical Engineering Journal, 2018, 342: 321-330.
[23]PEREZ M R, PAVLOVIC I, BARRIGA C, et al. Uptake of Cu2+, Cd2+ and Pb2+ on Zn-Al layered double hydroxide intercalated with EDTA[J]. Applied Clay Science, 2006, 32(3/4): 245-251
[24]LU Y, JIANG B, FANG L, et al. High performance NiFe layered double hydroxide for methyl orange dye and Cr(VI) adsorption[J]. Chemosphere, 2016, 152: 415-422.
[25]LI J, FAN Q H, WU Y J, et al. Magnetic polydopamine decorated with Mg-Al LDH nanoflakes as a novel bio-based adsorbent for simultaneous removal of potentially toxic metals and anionic dyes[J]. Journal of Materials Chemistry A, 2016, 4(5): 1737-1746.
[26]ZHU K R, GAO Y, TAN X L, et al. Polyaniline-modified Mg/Al layered double hydroxide composites and their application in efficient removal of Cr(VI)[J]. ACS Sustainable Chemistry & Engineering, 2016, 4(8): 4361-4369.
[27]DENG L, ZENG H X, SHI Z, et al. Sodium dodecyl sulfate intercalated and acrylamide anchored layered double hydroxides: a multifunctional adsorbent for highly efficient removal of Congo red[J]. Journal of Colloid and Interface Science, 2018, 521: 172-182.
[28]林巧莺, 陈岳民. 碳酸根型镁铝水滑石对铬酸根和磷酸根离子的吸附性能[J]. 环境工程学报, 2015, 9: 4687-4696.
[29]LI L, QI G X, WANG B D, et al. Fulvic acid anchored layered double hydroxides: a multifunctional composite adsorbent for the removal of anionic dye and toxic metal[J]. Journal of Hazardous Materials, 2018, 343: 19-28.
[30]LI B, ZHANG Y X, ZHOU X H, et al. Different dye removal mechanisms between monodispersed and uniform hexagonal thin plate-like ![]() and its calcined product in efficient removal of Congo red from water[J]. Journal of Alloys and Compounds, 2016, 673: 265-271.
and its calcined product in efficient removal of Congo red from water[J]. Journal of Alloys and Compounds, 2016, 673: 265-271.
[31]MIRETZKY P, CIRELLI A F. Cr(VI) and Cr(III) removal from aqueous solution by raw and modified lignocellulosic materials: a review[J]. Journal of Hazardous Materials, 2010, 180(1/2/3): 1-19.
[32]CUI L M, WANG Y G, GAO L, et al. EDTA functionalized magnetic graphene oxide for removal of Pb(II), Hg(II) and Cu(II) in water treatment: adsorption mechanism and separation property[J]. Chemical Engineering Journal, 2015, 281: 1-10.
[33]WANG X X, YU S Q, WU Y H, et al. The synergistic elimination of uranium (VI) species from aqueous solution using bi-functional nanocomposite of carbon sphere and layered double hydroxide[J]. Chemical Engineering Journal, 2018, 342: 321-330.
[34]LU Y, JIANG B, FANG L, et al. High performance NiFe-layered double hydroxide for methyl orange dye and Cr(VI) adsorption[J]. Chemosphere, 2016, 152: 415-422.
[35]YAN L, YANG K, SHAN R, et al. Calcined ZnAl- and Fe3O4/ZnAl-layered double hydroxides for efficient removal of Cr(VI) from aqueous solution[J]. RSC Advances, 2015, 5(117): 96495-96503.
[36]DAS N N, KONAR J, MOHANTA M K, et al. Adsorption of Cr(VI) and Se(IV) from their aqueous solutions onto Zr4+-substituted ZnAl/MgAl-layered double hydroxides: effect of Zr4+ substitution in the layer[J]. Journal of Colloid and Interface Science, 2004, 270: 1-8.
[37]GUO X X, ZHANG F Z, PENG Q, et al. Layered double hydroxide/eggshell membrane: an inorganic biocomposite membrane as an efficient adsorbent for Cr(VI) removal[J]. Chemical Engineering Journal, 2011, 166: 81-87.