碱式碳酸镁(4MgCO3·Mg(OH)2·4H2O)是一种重要的新型矿物材料和粉体制备原料,具有热力学性质稳定、无毒、无污染、可循环再生、质轻等优点[1-5],广泛应用于建筑和电子工业等领域制备耐火材料[6-7]。
碱式碳酸镁晶体具有多种形貌,性能差异较大。多孔棒状碱式碳酸镁可作为吸附材料,具有比表面积大、吸附速率快、分离性能良好[8]等优点。球状碱式碳酸镁,经煅烧后得到球形氧化镁可以作为高分离度液相色谱封装材料[9]。晶须状碱式碳酸镁,分解时吸热量大,能够阻止燃烧,可用作汽车安全气囊气体发生剂,也可用于塑料、涂料和建筑材料的补强剂、阻燃剂[10-11]。
国内外对碱式碳酸镁的合成进行了多方面研究。Chen等[12]采用MgCl2·6H2O和CO(NH2)2为原料,分别采用模板介导法和均相沉淀法,在沸水水浴中加热24 h,经5 h陈化处理,合成出结晶形态良好、具有板状结构的碱式碳酸镁晶体。王余莲等[13-14]采用菱镁矿为原料,以异丙醇为添加剂,利用水化碳化法-直接热解法,在50 ℃下热解2 h,制备棉棒状碱式碳酸镁晶体;在70 ℃下热解1.5 h,通过改变pH合成了多孔棒状、多孔玫瑰花球状、层状等不同形貌碱式碳酸镁晶体。Hao等[15]先以Mg(NO3)2和Na2CO3为原料,利用间接法制备MgCO3·3H2O晶体,再将温度提高至80 ℃,反应30 min得到碱式碳酸镁。
陈娟等[16]以MgCl2为原料,分别以CO(NH2)2、NH4HCO3和NaHCO3为沉淀剂,采用水热法,在100 ℃水浴中加热8 h,经3 h陈化处理,合成板片状、花状和球形碱式碳酸镁。王国胜等[17]以MgSO4溶液和NH4HCO3溶液为原料,在55~100 ℃下合成了碱式碳酸镁。
Bhattacharjva等[18]以MgCl2和Na2CO3为原料,在100~120 ℃的温度下反应12 h,制备了巢状碳酸镁微球。郭毅夫等[19]利用盐湖共生矿产为原料,在80 ℃下反应3 h,再经过陈化处理,合成了碱式碳酸镁。
李慧芳等[20]以Mg(NO3)2·6H2O、无水Na2CO3为原料,SDBS为添加剂,热解温度120 ℃,通过先合成MgCO3·3H2O再热解的间接合成法,合成了球状碱式碳酸镁。Hariharan等[21]以MgCl2和NaHCO3为原料,通过共沉淀法,在90 ℃时,利用不同CO2分压,制备了碱式碳酸镁。
王志强等[22]利用轻烧白云石为原料,经过2次碳化后,在反应温度为95 ℃时,合成了纯度较高的碱式碳酸镁。张英才等[23]以NH4HCO3和MgCl2为原料、PVA为发泡剂,当温度低于45 ℃时,合成了空腔结构的棒状三水碳酸镁晶体,陈化后,得到空腔结构的碱式碳酸镁晶体。常睿璇等[24]以重镁水为原料,采用热解法,在分解时间为30 min、不同压力条件下,合成出碱式碳酸镁晶体; 初始温度为40 ℃,当温度增加至70 ℃时,产物形貌由棒状转变为片状,最终变成花球状。杨晨等[25]以MgCl2和Na2CO3为原料,SDS为添加剂,于30~50 ℃温度下制备碱式碳酸镁微球,但合成成本较高,且存在含氯离子的废液。
综上,碱式碳酸镁制备温度多在70~100 ℃,原料以化学试剂为主,反应条件较为苛刻。本文中以菱镁矿为原料,拟采用水化碳化法制备重镁水溶液,并以无水乙醇为辅助剂,在较低温度下(55 ℃)直接热解重镁水溶液,从而制备出碱式碳酸镁晶体;并考察热解时间、无水乙醇添加量、前驱溶液pH等因素对产物组成与形貌影响,初步探究无水乙醇碱辅助下碱式碳酸镁生长机理。
1 实验
1.1 主要原料
原料产自辽宁海城的岫岩菱镁矿(MgO质量分数为46.83%)。取适量破碎后的菱镁矿放入坩埚内,再将坩埚置于700 ℃箱式电阻炉内煅烧120 min,获得MgO质量分数为92.11%的轻烧氧化镁。无水乙醇(C2H5OH)、氢氧化钠(NaOH)均为分析纯。
1.2 前驱溶液Mg(HCO3)2的制备
轻烧氧化镁经研磨、75 μm标准筛筛分除杂获得粒径为≤74 μm氧化镁,将其与90 ℃蒸馏水按照质量比m(MgO)∶m(H2O)=1∶40混合,将混合溶液于60 ℃温水水浴中加热、搅拌210 min,待温度冷却至室温后,向所得水化溶液中通入CO2气体,冰水水浴下搅拌,待溶液pH值达7.5左右时,停止通气、搅拌,过滤所得澄清滤液即为前驱体Mg(HCO3)2溶液。
1.3 碱式碳酸镁晶体制备
量取一定体积的重镁水溶液放置于烧杯内,测量记录初始pH,并采用5 mol/L的NaOH溶液调节前驱溶液的pH,并对烧杯进行密封处理; 将其置于55 ℃水浴中,搅拌、热解、过滤得白色沉淀,置于80 ℃恒温干燥箱中干燥10 h,即得碱式碳酸镁晶体产物。
1.4 样品表征
采用日本Rigaku公司生产的UltimaⅣ 型X射线衍射仪检测产物物相:辐射源为Cu铜靶Kα,λ=0.154 1 nm,固体探测器,管电压为40 KV,管电流为40 mA,扫描速率12(°)/min,扫描范围5 °~90 °。采用日本日立公司S-3400N型扫描电子显微镜观察产物形貌。
2 结果与讨论
2.1 热解时间的影响
热解温度恒定为55 ℃,Mg(HCO3)2溶液初始pH值为7.70,体积比为v(无水乙醇)∶v(Mg(HCO3)2)=1∶2,无水乙醇在初始时刻加入。图1为不同热解时间下所得产物的XRD图谱。
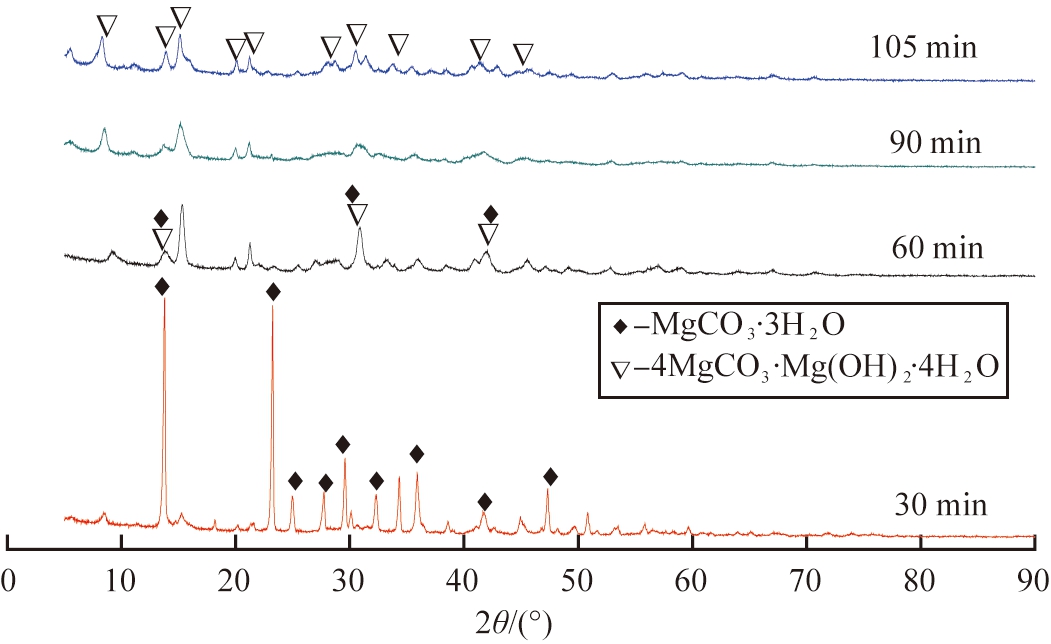
图1 不同反应时间时产物的XRD图谱
Fig.1 XRD patterns of products at different reaction time
由图1可以看出:热解至30 min时,产物衍射峰均与三水碳酸镁(MgCO·3H2O,PDF#70-1433)标准特征峰一一对应,衍射峰强度高,基底平滑,无杂峰,表明产物结晶良好,纯度相对较高; 延长热解时间至60 min时,所得产物中MgCO3·3H2O特征峰数量减少、强度降低,同时存在MgCO3·3H2O与碱式碳酸镁(4MgCO3·Mg(OH)2·4H2O)特征峰,说明所得产物为2者混合物;延长热解时间至90 min时,产物中MgCO3·3H2O衍射峰消失,衍射峰全部对应于4MgCO3·Mg(OH)2·4H2O (PDF#70-0361)特征峰,峰基底平滑,没有杂峰,表明所得4MgCO3·Mg(OH)2·4H2O纯度较高; 时间继续延长至105 min,所得产物仍为4MgCO3·Mg(OH)2·4H2O。综上,当热解时间≥90 min时,均可获得结晶良好、纯度较高的4MgCO3·Mg(OH)2·4H2O。
图2为不同反应时间时产物的SEM图像。

a)30 min

b)45 min

c)60 min

d)70 min

e)90 min

f)105 min
图2 不同反应时间时产物的SEM图像
Fig.2 SEM images of products at different reaction time
从图2可知:热解时间为30 min时,晶体形貌呈现出光滑针状晶体或棒状晶须,晶体均匀性较好;热解时间为45 min时,晶体结构无明显变化;热解至60 min时,晶须表面开始出现絮状物质,棒状晶须逐渐消失;当热解时间延长至90 min时,棒状晶须消失,产物全为无规则絮状物质;热解至105 min时,产物全为无规则絮状物质,表面呈现多孔结构。综上,随着热解时间延长,产物最终会全部转变为碱式碳酸镁,最佳热解时间为105 min。
2.2 无水乙醇添加量的影响
通过改变无水乙醇与重镁水溶液体积比,探究晶体物相结构和微观形貌的变化。设定热解温度为55 ℃,Mg(HCO3)2溶液pH值为7.70,热解时间105 min,无水乙醇在初始时刻加入。图3为无水乙醇与重镁水溶液不同体积比时所得产物的XRD图谱。
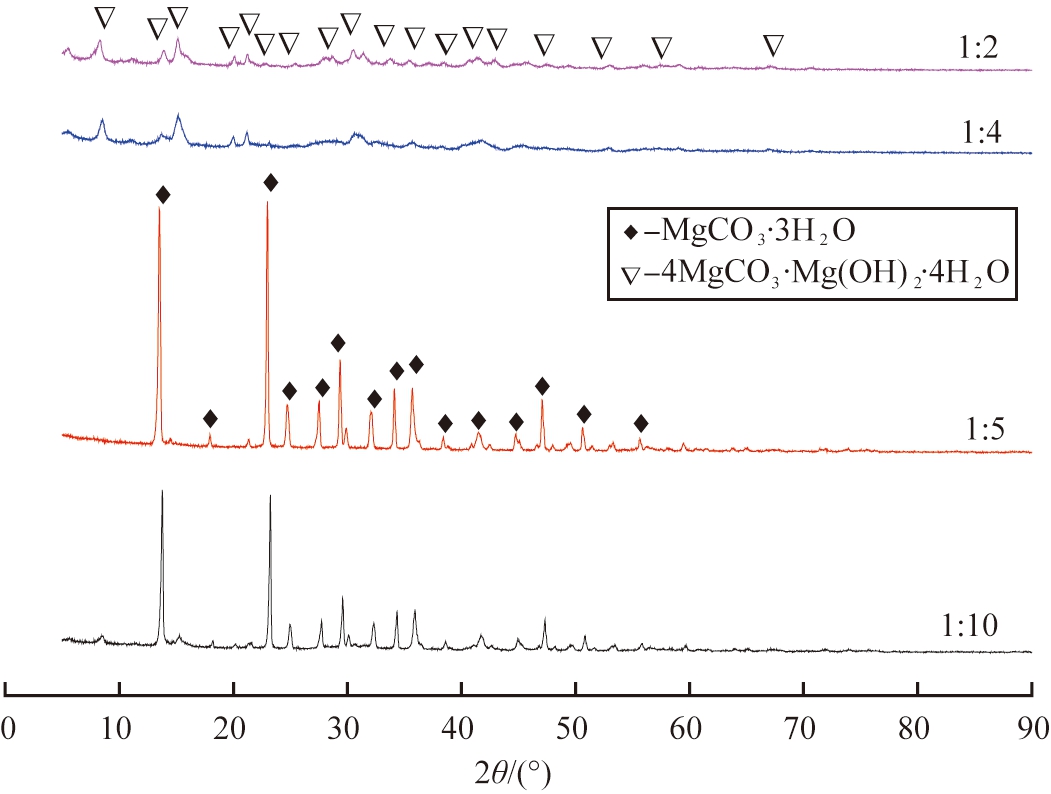
图3 无水乙醇与Mg(HCO3)2溶液不同体积比时所得产物XRD图谱
Fig.3 XRD patterns of products obtained at different volume ratios of anhydrous ethanol and Mg(HCO3)2 solution
由图3可知,当无水乙醇与Mg(HCO3)2溶液体积比为1∶10时,产物衍射峰和MgCO3·3H2O特征峰基本重合,峰形尖锐、无杂峰、基底平滑、衍射峰强度高,表明所得MgCO3·3H2O结晶度较好;体积比为1∶5时,产物仍为MgCO3·3H2O,为团聚生长的光滑棒状晶体;体积比为1∶4时,产物衍射峰对应于4MgCO3·Mg(OH)2·4H2O特征峰,峰明显宽化,数量增多;体积比增大到1∶2时,产物没有改变,但其衍射峰宽化现象减弱。
图4为无水乙醇与重镁水溶液不同体积比时所得产物的SEM图像。由图4 a)和图4 b)可见,产物为团聚生长的光滑棒状MgCO3·3H2O晶体;由图4 c)和图4 d)可见,随着体积比增大,棒状晶体会逐步转变成絮状,最终转变为相互堆叠紧密的无规则扁平片状物质,直径约为5 μm。

a)1∶10

b)1∶5

c)1∶4

d)1∶2
图4 无水乙醇与Mg(HCO3)2溶液不同体积比时所得产物SEM图像
Fig.4 SEM images of products obtained at different volume ratios of anhydrous ethanol and Mg(HCO3)2 solution
综上,随着无水乙醇与Mg(HCO3)2溶液体积比的不断增大,产物由MgCO3·3H2O向4MgCO3·Mg(OH)2·4H2O转变;无水乙醇与Mg(HCO3)2溶液最佳体积比为1∶2。
2.3 前驱Mg(HCO3)2溶液pH的影响
其他条件保持不变,探究热解不同pH的前驱Mg(HCO3)2溶液对产物结晶过程的影响。图5为不同pH的Mg(HCO3)2溶液所得产物的XRD图谱。
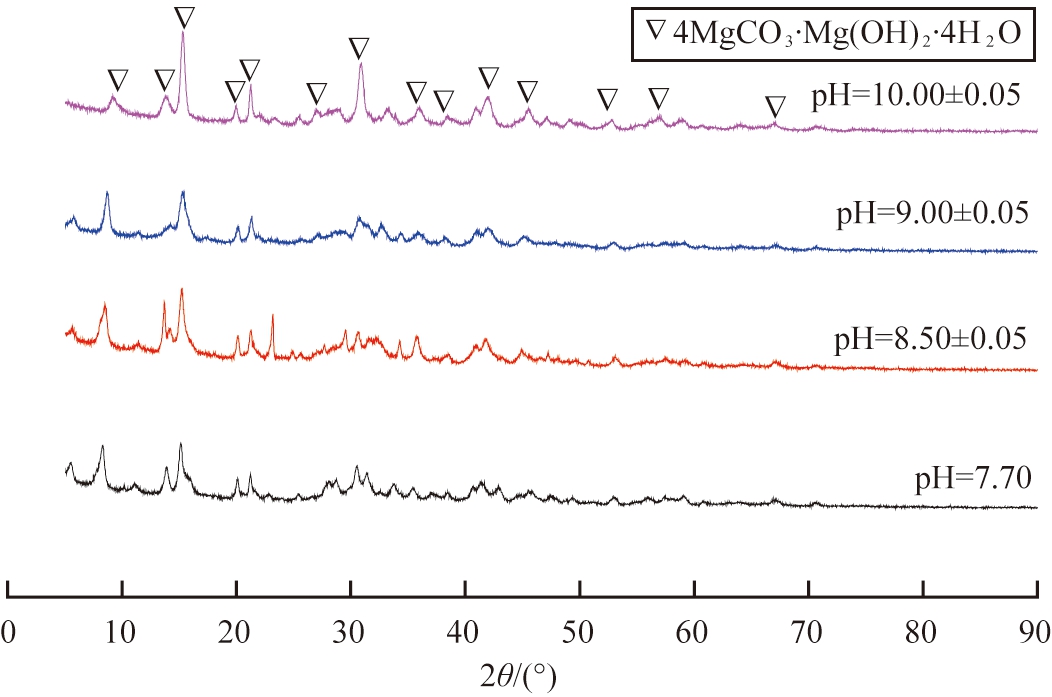
图5 不同pH的Mg(HCO3)2溶液所得产物的XRD图谱
Fig.5 XRD patterns of products obtained from pyrolysis of Mg(HCO3)2 solutions with different pH values
观察图5可以看出:当Mg(HCO3)2溶液pH值为7.70时,产物衍射峰与4MgCO3·Mg(OH)2·4H2O特征峰对应,但其衍射峰明显宽化、强度较低,说明产物中混有粒度较小的4MgCO3·Mg(OH)2·4H2O;随着pH增大,衍射峰强度增强,无杂质峰,峰形变得尖锐,衍射峰和4MgCO3·Mg(OH)2·4H2O特征峰重合,产物结晶度好,纯度较高。
图6为不同pH的Mg(HCO3)2溶液所得产物的SEM图像。由图6可以看出:当溶液pH值为7.70和8.00±0.05时,晶体形貌无明显变化,多为无规则多孔絮状结构; 当pH值为8.50±0.05时,晶体形貌发生明显改变,粒度增大,呈棉絮状;当pH值调节到9.00±0.05时,产物由多孔棒状晶体和微球晶体组成,多孔棒状晶体尺寸小,交叉排列紧密;当pH值增大至9.50±0.05时,棒状晶体减少,产物多为不规则球状;当pH值进一步增大至10.00±0.05时,产物粒径均匀、形貌规整,为纳米扁平片状堆积而成的三维结构,即“玫瑰花苞状”晶体,平均直径为2.3 μm。

a)pH=7.70

b)pH=8.00±0.05

c)pH=8.50±0.05

d)pH=9.00±0.05

e)pH=9.50±0.05

f)pH=10.00±0.05
图6 不同pH的Mg(HCO3)2溶液所得产物SEM图像
Fig.6 SEM images of of products obtained from pyrolysis of Mg(HCO3)2 solutions with different pH values
综上,Mg(HCO3)2溶液的pH对产物微观形貌影响较大。当pH值低于8.50±0.05时,产物为不规则絮状4MgCO3·Mg(OH)2·4H2O晶体; pH值在9.00±0.05时,产物为多孔棒状晶体;pH值达到10.00±0.05时,产物为“玫瑰花苞状”晶体。
2.4 无水乙醇加入时刻的影响
由前述可知,当热解温度恒定为55 ℃、热解时间为105 min、无水乙醇与Mg(HCO3)2溶液体积比为1∶2,溶液pH值分别设为9.00±0.05和10.00±0.05时,在反应时间分别达到0、10、20、30 min时加入无水乙醇,可获得图7和图8这2组不同形貌4MgCO3·Mg(OH)2·4H2O晶体。

a)0 min

b)10 min
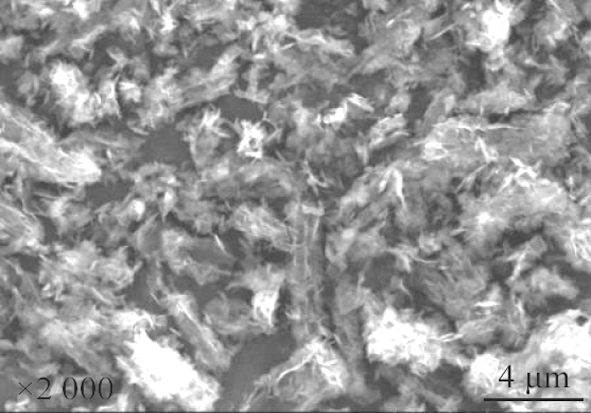
c)20 min

d)30 min
图7 pH值为9.00±0.05时无水乙醇不同加入时刻所得产物SEM图像
Fig.7 SEM images of products obtained at different adding time of anhydrous ethanol when pH value is 9.00±0.05

a)0 min

b)10 min

c)20 min

d)30 min
图8 pH 值为10.00±0.05时无水乙醇不同加入时刻所得产物SEM图像
Fig.8 SEM images of products obtained at different adding time of anhydrous ethanol when pH value is 10.00±0.05
由图7可看出,pH值为10.00±0.05时,反应开始时加入无水乙醇,产物由多孔棒状晶体和微球晶体组成,堆积紧密; 反应时间为10、20、30 min时加入无水乙醇,所得产物多为无规则絮状,仅有少量棒状结构。
由图8可见,pH值为10.00±0.05时,反应开始时加入无水乙醇,产物为纳米扁平片状堆积起来的三维结构,之后虽然无水乙醇加入时反应时间不同,但产物形貌基本不发生改变。
2.5 无水乙醇辅助下碱式碳酸镁生长机理分析
MgCO3·3H2O属热力学上亚稳相。由Ostwald递变法则可知,MgCO3·3H2O有着向稳定相4MgCO3·Mg(OH)2·4H2O转变的倾向。在不添加无水乙醇且较低温度(55 ℃)条件下,MgCO3·3H2O需要经过较长时间才会相转变为4MgCO3·Mg(OH)2·4H2O。
其他条件相同时,仅仅增大无水乙醇添加量,所需热解时间会缩短,MgCO3·3H2O向4MgCO3·Mg(OH)2·4H2O转变进程加快。说明在无水乙醇的辅助下,亚稳相MgCO3·3H2O转变为稳定相4MgCO3·Mg(OH)2·4H2O过程中所需能量减少。
由于无水乙醇和异丙醇作为添加剂时所得碱式碳酸镁形貌极为相似[26],两者都属于羟基醇类化合物,因此关于异丙醇的相关研究成果[13]同样也适用于无水乙醇辅助下碱式碳酸镁生长机理的分析。
为了对上述论断进行验证,根据Arrhenius方程[26]
k=k0exp(-Ea/RT),
(1)
对方程两边进行对数变换
ln k=ln k0-Ea/RT,
(2)
式中:k为反应速率; k0为积分常数; Ea为表观活化自由能; R为摩尔气体常量,T为热力学温度。
由式(2)可知,ln k与1/T符合一次函数关系,直线斜率即为Ea。利用电导法,反应溶液中离子浓度变化即化学反应速率k,可以根据溶液中电导率变化来表示;电导与反应速率k符合关系式
(3)
式中:c为Mg(HCO3)2溶液初始浓度; G0为t=0时的电导值; Gt为时间t时溶液的电导值; G∞为反应完毕时溶液的电导值。式(3)中,反应速率数k可以通过直线斜率求出。
测得无水乙醇辅助下热解Mg(HCO3)2溶液过程中不同温度和不同时刻所对应的电导率(G),可以求出其反应速率k′和ln k′,再利用式(1)对ln k′与1/T进行线性拟合计算并绘图,根据拟合后直线斜率,即可求出对应的表观活化能![]() 再进行对比分析可知,在无水乙醇辅助下可以减少MgCO3·3H2O向4MgCO3·Mg(OH)2·4H2O转变所需的能量[26]。
再进行对比分析可知,在无水乙醇辅助下可以减少MgCO3·3H2O向4MgCO3·Mg(OH)2·4H2O转变所需的能量[26]。
图9为无水乙醇辅助下碱式碳酸镁生长过程示意图。
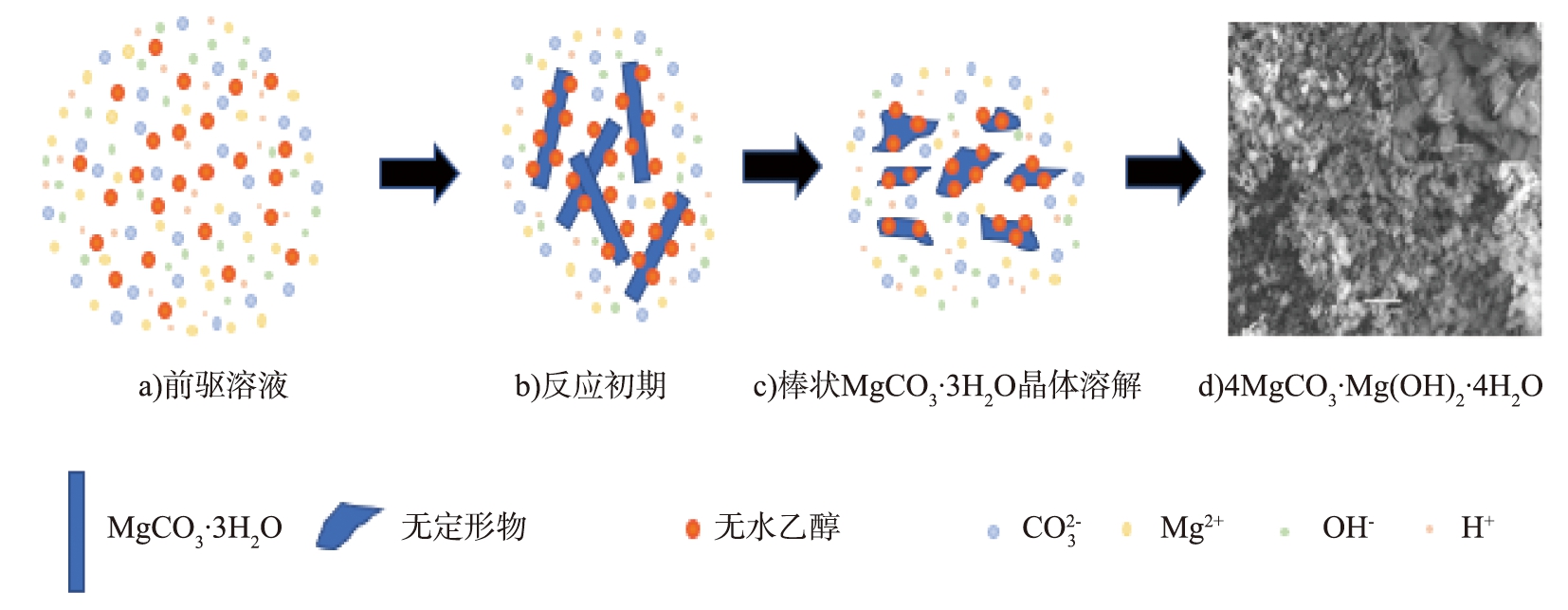
图9 无水乙醇辅助下碱式碳酸镁生长过程示意图
Fig.9 Schematic diagram of growth process of basic magnesium carbonate assisted by anhydrous ethanol
图9 a)为前驱溶液示意图。从图9 b)中可以看出,在反应初期中间相产物仍为MgCO3·3H2O,溶液中游离的Mg2+和![]() 有向着三水碳酸镁晶体表面处聚集的趋势,而溶液中无水乙醇则会生成致密度较好的双电层保护膜附着在晶体表面,防止晶体表面与溶液中Mg2+和
有向着三水碳酸镁晶体表面处聚集的趋势,而溶液中无水乙醇则会生成致密度较好的双电层保护膜附着在晶体表面,防止晶体表面与溶液中Mg2+和![]() 接触,促进了新核形成; 在图9 c)中,棒状MgCO3·3H2O溶解成无定形物质,由于无水乙醇的吸附作用,形成了阻碍Mg2+和
接触,促进了新核形成; 在图9 c)中,棒状MgCO3·3H2O溶解成无定形物质,由于无水乙醇的吸附作用,形成了阻碍Mg2+和![]() 与晶体接触的双电层保护膜,新晶核形成速率加快,从而进一步提高了4MgCO3·Mg(OH)2·4H2O晶体生成速率; 如图9 d)所示,最终会形成不同形貌的4MgCO3·Mg(OH)2·4H2O。
与晶体接触的双电层保护膜,新晶核形成速率加快,从而进一步提高了4MgCO3·Mg(OH)2·4H2O晶体生成速率; 如图9 d)所示,最终会形成不同形貌的4MgCO3·Mg(OH)2·4H2O。
3 结论
1)热解时间、无水乙醇添加量、前驱溶液pH以及无水乙醇加入时刻对4MgCO3·Mg(OH)2·4H2O微观形貌和尺寸均起到调节作用。
2)获得平均直径为2.3 μm、形貌为“玫瑰花苞状”4MgCO3·Mg(OH)2·4H2O晶体的最佳条件为:热解温度为55 ℃、热解时间为105 min、无水乙醇与Mg(HCO3)2溶液体积比为1∶2、前驱溶液pH值为10.00±0.05,在此条件下,无水乙醇加入时刻对晶体形貌基本没有影响。
3)加入无水乙醇辅助碱式碳酸镁生长过程,不仅可以减少反应所需能量,还可以形成致密度较好的双电层保护膜,吸附在晶体表面,防止溶液中![]() 和Mg2+聚集在已经生成的晶体表面成核,促进了新核形成,加快了MgCO3·3H2O向4MgCO3·Mg(OH)2·4H2O的转变速率。
和Mg2+聚集在已经生成的晶体表面成核,促进了新核形成,加快了MgCO3·3H2O向4MgCO3·Mg(OH)2·4H2O的转变速率。
[1]于生慧.纳米环境矿物材料的制备及重金属处理研究[D].合肥:中国科学技术大学,2016.
[2]王余莲,印万忠,李闯,等.碱式碳酸镁的表面有机改性及性能表征[J].硅酸盐学报,2020,48(1):120-127.
[3]王余莲,印万忠,张夏翔,等.三水碳酸镁法制备碱式碳酸镁过程研究[J].矿产保护与利用,2017(4):81-86.
[4]王蕾,王国胜.碱式碳酸镁热解机理研究进展[J].化学工程师,2009,23(11):42-45.
[5]刘晓光,陈大明,仝建峰,等.某涂料用MgTiO3粉体的制备研究[J].中国粉体技术,2006,12(1):5-7.
[6]YAO J,SUN H R,HAN F,et al.Enhancing selectivity of modifier on magnesite and dolomite surfaces by pH control[J].Powder Technology,2020,362:698-706.
[7]YAO J,SUN H R,YANG B,et al.Selective co-adsorption of a novel mixed collector onto magnesite surface to improve the flotation separation of magnesite from dolomite[J].Powder Technology,2020,371:180-189.
[8]谢发之,胡婷婷,付浩瀚,等.碱式碳酸镁为新结合相的薄膜梯度扩散技术原位富集测定富营养水体中的磷[J].分析化学,2016,44(6):965-969.
[9]ZHANG Z P,ZHENG Y J,ZHANG J X,et al.Magnesium oxide microspheres as a packing material for the separation of basic compounds in normal-phase liquid chromatography[J].Journal of Chromatography.A,2007,1165(1):116-121.
[10]王秋雨,范智,付文斌,等.关于碱式碳酸镁在气体发生剂中的作用研究[J].当代化 工,2015,44(9):2140-2142,2145.
[11]王静,王彩丽,王怀法,等.纳米Mg(OH)2包覆粉煤灰空心微珠复合粉体的制备及表征[J].中国粉体技术,2018,24(2):7-10,59.
[12]CHEN J,HUANG Z L,CHEN C L,et al.Preparation and growth mechanism of plate-like basic magnesium carbonate by template-mediated/homogeneous precipitation method[J].Journal of Central South University,2018,25(4):729-735.
[13]王余莲,印万忠,李昂,等.异丙醇催化碱式碳酸镁晶体的合成[J].硅酸盐学报,2019,47(7):995-1002.
[14]WANG Y L,LIU J Y,SHI T J,et al.Preparation,properties and phase transition of mesoporous hydromagnesite with various morphologies from natural magnesite[J].Powder Technology,2019,364:822-830.
[15]HAO Z H,DU F L.Synthesis of basic magnesium carbonate microrods with a“house of cards”surface structure using rod-like particle template[J].Journal of Physics and Chemistry of Solids,2008,70(2):401-404.
[16]陈娟,黄小雨,黄志良.不同碱源对碱式碳酸镁晶形的影响[J].材料保护,2016,49(S1):196-197.
[17]王国胜,王迪,张天天.利用硼酸母液制备碱式碳酸镁并用于母液除铁的研究[J].无机盐工业,2017,49(5):61-63.
[18]BHATTACHARJVA D,SELVAMANI T,MUKHOPADHYAY I.Thernal decomposition of hydromagnesite[J].J Therm Anal Calorim,2012,107:439-445.
[19]郭毅夫,张瑶,郭日杰.均匀沉淀法制备碱式碳酸镁粉体工艺研究[J].内蒙古石油化工,2015,41(20):38-39,154.
[20]李慧芳,仲剑初.十二烷基苯磺酸钠作为添加剂制备球形碱式碳酸镁[J].无机盐工业,2017,49(2):39-42.
[21]HARIHARAN S,MAZZOTTI M.Growth kinetics hydromagnesite at 90 ℃[J].Cryst Growth Des,2017,17:317-327.
[22]王志强,刘家祥,饶发明.以轻烧白云石为原料二次碳化法制备高纯碱式碳酸镁[J].硅酸盐学报,2013,41(10):1437-1441.
[23]张英才,向兰,金涌.液相法合成多孔棒状碱式碳酸镁初探[J].盐业与化工,2006(4):4-6.
[24]常睿璇,丁珂,孙晓君,等.热解法制备不同形貌碱式碳酸镁[J].硅酸盐学报,2018,46(7):922-928.
[25]杨晨,宋兴福,黄姗姗,等.十二烷基硫酸钠辅助下低温合成碱式碳酸镁微球[J].无机化学学报,2012,28(4):757-762.
[26]王余莲.微/纳米水合碳酸镁的制备及应用研究[D].沈阳:东北大学,2015.