随着上世纪80年代纳米材料的出现,磁性纳米材料发展为新型磁性材料,随后成为国内外学者的热门研究课题[1]。 除了纳米材料的优点之外,它们还具有特殊的超顺磁性、 强吸附性和易于回收利用的特点。 与传统材料相比,磁性纳米材料具有磁响应的表面效应,比表面积大,粒径小,在外加磁场的作用下容易与溶液分离,大大简化了分离操作,解决了传统粉末材料回收困难、 成本高和二次污染等问题[2]。
随着社会经济、现代工业和农业的发展,水污染问题日趋严重。污水中包含许多污染物,我国的水体污染主要是重金属和有机物造成的[3]。废水处理和循环利用为解决全球水污染和缺水问题提供了一种途径,新工艺与新技术的发展迫在眉睫。近年来,磁性纳米材料已在工业废水处理中得到广泛关注[4]。在进一步的研究中,通过改变磁性纳米材料理化特性和表面结构功能,可以进一步提高污水处理性能,在水处理方面拥有广阔的应用前景。又由于单个磁性纳米颗粒中存在强磁性,因此易团聚,导致表面积减小,吸附性能降低。可以通过进行稳定化、表面改性或合成复合材料等,减少颗粒之间的团聚,增加在溶液中的分散度,并且提高对废水处理的效果。纳米Fe3O4作为一种磁性纳米材料,近年来受到了广泛的关注。
1 概述
磁性纳米材料是指同时具有纳米效应和磁性能的材料,常见的铁系磁性材料有: 纳米零价铁(nZVI)[5]、 赤铁矿(α-Fe2O3)[6]、 磁性赤铁矿(γ-Fe2O3)[7]、 磁铁矿(Fe3O4)[8]等。nZVI是零价铁颗粒,粒径为1~100 nm,比表面积为10~70 m2·g-1;γ-Fe2O3是一种常见的亚铁磁性矿物,主要由氧化条件下磁铁矿的二次转变形成,也可由氧化铁的有机作用形成;Fe3O4是最常见的磁性纳米材料,同时含有Fe(Ⅱ)和Fe(Ⅲ),其晶体结构为八面体(图1)。一半的Fe(Ⅲ)占据四面体位点,另一半Fe(Ⅲ)和Fe(Ⅱ)占据八面体位点,因此稳定性极佳[9]。
Fe3O4纳米颗粒具有稳定的化学性质,可将其粒径减小至纳米级,具有高催化活性、良好的磁响应性和吸附性,可普遍用以生物传感器[10]、 吸附剂[11]、 医疗[12]、 催化剂[13]等方面。
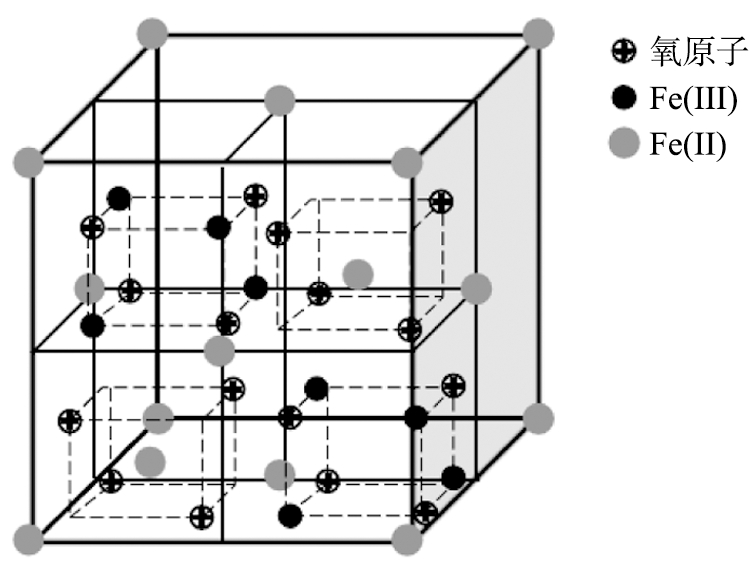
图1 Fe3O4晶体结构
Fig.1 Crystal structure of Fe3O4
2 磁性纳米材料的制备及改性
制备Fe3O4磁性纳米材料的方式有很多,如共沉淀法、 水热法、 微乳液法等,但是,不同方法对设备和操作程序有不同的要求,具有不同的优缺点,而且,采用不同方法制备的材料的性能和应用范围差异很大。
2.1 共沉淀法
共沉淀法是在含可溶性盐的溶液中加入沉淀剂,形成不溶性氢氧化物或氧化物,然后加热所得到的氧化物或氢氧化物,使其发生分解反应,最终产生纳米微粒[14]。 溶液pH、 反应时间等因素都会影响共沉淀法制备的磁性纳米粒子的形貌和尺寸。 共沉淀法的优点是操作简便,制得的纳米颗粒具有很高的化学活性、 均一的粒径和其他优良的性能; 但是,受反应条件限制,制备过程中会出现材料团聚现象。
Nabiyouni等[15]采用共沉淀法,以FeCl2·4H2O与Fe(NO3)3·9H2O为原料,添加十六烷基三甲基溴化铵(CTAB)以及十二烷基磺酸钠2种不同的表面活性剂,控制反应时间以及干燥温度,得到不同粒径的Fe3O4纳米粒子,在反应时间为60 min、使用CTAB为催化剂、干燥温度为60 ℃时,可以获得更均匀的粒径。Chen等[16]以FeSO4·7H2O为铁源、NaOH为沉淀剂,NaNO3作为氧化剂,在N2条件下控制溶液的pH值,制得形貌各异的Fe3O4纳米颗粒。结果表明,Fe3O4颗粒在高pH值下呈八面体,在低pH值下呈球形。这是因为纳米颗粒的形态与晶面的自由能有关,不同的pH条件下铁原子与氧原子的含量不同,表面自由能的差异直接影响晶体平面的生长速率。
2.2 水热法
水热法是以水为溶剂,加入特定比例的金属盐溶液,通过添加碱性溶液调节pH值,然后将混合物放入高温高压反应器中进行结晶,再经分离、热处理等即可得到磁性纳米材料。水热法具有2个优点,一是130~250 ℃的高温条件利于提高磁性能,二是在0.3~4 MPa的高压封闭容器中的反应避免了组分挥发。
水热法制备的颗粒形态及粒径受很多因素的影响。Lei等[17]通过用一步水热法,以FeSO4·7H2O为铁源,NaOH为沉淀剂,合成了八面体磁性纳米微粒Fe3O4,并且可以通过改变反应温度的升高速度,控制各个方向的生长速率,从而决定晶粒的形状。Su等[18]研究了尿素对水热法制备的Fe3O4纳米颗粒的影响。实验结果表明,尿素原位热分解生成NH3和CO2会影响粒径和颗粒形态。加入尿素后,Fe3O4颗粒从空心球演变为松果状,并最终形成纳米结构,制备的纳米材料对亚甲基蓝具有良好的去除作用。
2.3 溶剂热法
溶剂热法是在水热法的基础上发展起来的。与水热法的区别在于所用的溶剂是有机溶剂而不是水;与水热法相同的是,溶剂热法得到的产品也具有形貌可控、磁性高、分散性好的优点,但也存在成本高的缺点。
Huang等[19]利用溶剂热法,以NaAc为沉淀剂,FeCl3·6H2O为铁源,乙二醇为溶剂制备了Fe3O4纳米微粒,并探究反应条件对磁性纳米粒子的影响。NaAc在系统中形成静电平衡,先与FeCl3·6H2O形成中间体Fe(Ac)3,然后与乙二醇反应生成Fe3O4颗粒;晶体微粒随着反应时间的增加而生长团聚,粒径与反应时间呈正相关;铁源浓度对纳米形貌有显著影响,铁源浓度越低,纳米Fe3O4粒子的尺寸越小。Bai等[20]以FeCl2·4H2O与FeCl3·6H2O晶体为铁源,甲醇为溶剂并加入油酸,制得纳米Fe3O4。油酸的质量分数可以控制Fe3O4的形貌和粒径。颗粒形态为方形且表面积大的材料比圆形的材料在制备过程中使用更多油酸。其他学者利用Fe3O4纳米颗粒矫顽力高、饱和磁化强度低的特点,在利用溶剂热法制备的过程中加入不同的表面活性剂,获得了菜花状[21]、 环状[22]、 三角形[23]以及球形[24]等不同形态的纳米颗粒。
2.4 微乳液法
微乳液法是使用2种不混溶的液体,以表面活性剂分子为界面膜,形成热稳定的各向同性的油相和水相分散系,这样可以使成核、生长、团聚等过程限制为一个尺寸很小的空间中[25]。微乳液法的制备过程可控制产品形貌,获得的纳米颗粒的粒度分布范围小,分散性强,然而添加大量的表面活性剂增加了反应成本。
赵增宝等[26]以甲苯为油相,十二烷基苯磺酸钠为表面活性剂,FeCl3和FeSO4为铁源,采用微乳液法制备纳米Fe3O4颗粒,得到的颗粒结晶性良好,饱和磁感应强度可达47.269 A·m2·g-1,具有高磁性。 在温度低于80 ℃且时间小于1.5 h范围内,较高的温度和较长的时间会使Fe3O4颗粒更好的乳化和结晶。 Lu等[27]设计了油-水界面微乳液法合成路线,在氩气条件下,正庚烷作油相,分别以十二烷基硫酸钠、 甲基三丁基溴化铵和十二烷基三乙基溴化铵作为表面活性剂,添加FeCl3和FeSO4到NH3·H2O溶液中,最终得到粒径不同的Fe3O4纳米粒子。 Xue等[28]使用相同方法,在六氟己烷中与FeSO4溶液反应制备出均匀的油溶性Fe3O4纳米粒子。
2.5 溶胶-凝胶法
溶胶-凝胶法是使用有机或无机金属化合物作为前驱体,在特定条件下将溶液加热脱水变成微弹性凝胶,然后烧制以获得磁性纳米粒子,即经过溶液、溶胶和凝胶3种形态而固化。溶胶-凝胶法的优点是操作简便、 易于控制、 产物分散性好、 颗粒均匀、 易于获得高纯度,但是加工成本较高,高温煅烧不利于较小粒径磁性纳米颗粒的合成。
Cui等[29]使用溶胶-凝胶法制备高分散性的Fe3O4。溶剂为乙醇,铁源为FeCl2·4H2O,加入环氧丙烷后加热搅拌,获得不透明的灰色凝胶。继续加热和搅拌,灰色变成糊状并变成黑色,表明Fe3O4已经开始形成,最终离心干燥得到Fe3O4。通过改变溶胶溶液的干燥温度,可以获得具有不同氧化铁相的纳米材料。Zhou等[30]按照溶胶-凝胶法合成路线,将FeSO4加入到KNO3与KOH混合溶液得到Fe3O4凝胶,探究试剂的不同浓度对粒径的影响。随着Fe(Ⅱ)浓度增加且反应体系的pH接近Fe3O4颗粒的等电点(约5.4)时,粒子表面的净电荷变为0,此时表面斥力最小的微粒趋于附聚成更大的粒子。由于过量OH-吸附在初级形成的微粒上,产生斥力阻止了微粒的进一步长大,所以OH-对粒径的影响呈现相反趋势。
2.6 表面改性方法
单一的纳米Fe3O4颗粒的稳定性受到易团聚和氧化等缺点影响,为了改善磁性纳米材料的性能,例如对废水的吸附性能与吸附选择性等,可以使用无机材料和有机材料对其表面进行功能化修饰。
无机材料可与Fe3O4形成核-壳式或包埋式结构的复合磁性纳米材料。Yang等[31]用湿润浸渍法将Al2O3修饰磁性纳米颗粒Fe3O4的表面,制备了Fe3O4@Al2O3催化剂。与纯臭氧化处理相比,加入Fe3O4@Al2O3后臭氧对废水中苯酚的降解率可提高27%。Chen等[32]使用正硅酸乙酯(TEOS)作为硅源,在室温下可获得SiO2涂层的磁性纳米颗粒Fe3O4@SiO2,该材料具有很好的稳定性,改变TEOS的用量可调整涂层厚度。
有机材料的表面改性主要是将表面烷基化改性剂的官能团,将诸如—NH2和—SH等引入颗粒表面,使磁性纳米材料可以选择性吸附废水中污染物。Jia等[33]以3-氨基丙基三乙氧基硅烷(APTES)为原料提供氨基,用2种不同的方法对Fe3O4颗粒的表面进行改性:一是直接改性,二是用SiO2包裹磁性壳后在进行改性。结果表明,直接改性磁性颗粒中的氨基数量明显少于涂覆硅壳中的氨基数量,表明APTES在单个纳米颗粒表面的水解接枝率低,SiO2涂层的磁性纳米颗粒表面有更多易于连接的基团。除氨基外,Wang等[34]将羧基巯基修饰在磁性介孔SiO2纳米颗粒表面,修饰后的材料均表现出良好的磁性与稳定性。
2.7 磁性复合材料
为将Fe3O4的磁性与其他功能材料的性能结合起来,研究者制备了多种多样的高性能磁性复合材料,如磁性生物炭[35]、磁性矿物材料[36]、磁性生物材料[37]等。
闫良国课题组分别采用溶剂热法、共沉淀法和溶胶-凝胶法等制备了不同的磁性矿物材料。利用溶剂热法的特点,在获得Fe3O4纳米颗粒的同时将其负载到矿物材料,例如,膨润土[38]、蛭石[39]、高岭土[40]、硅藻土和伊利石[41]、水滑石(LDHs)[42-45]等。具体操作步骤如下:将乙酸钠和FeCl3溶解于乙二醇中,加入乙二胺和矿物材料粉末,混合均匀后移入反应釜中,在200 ℃下加热8 h并洗涤干燥(以磁性膨润土为例,制备过程见图2[38])。X射线衍射(XRD)、傅里叶红外光谱(FTIR)、X射线光电子能谱(XPS)、扫描电镜(SEM)、透射电镜(TEM)等表征结果表明,溶剂热法制备的磁性材料不仅保持了矿物材料本身的特性,还负载了羟基、氨基等官能团,具备了超顺磁性。参照上述工作,按照相同合成路线合成Fe3O4-氧化石墨烯-LDHs复合材料复合磁性材料[46],对重金属有良好的吸附性且材料的磁性由Fe3O4来决定。
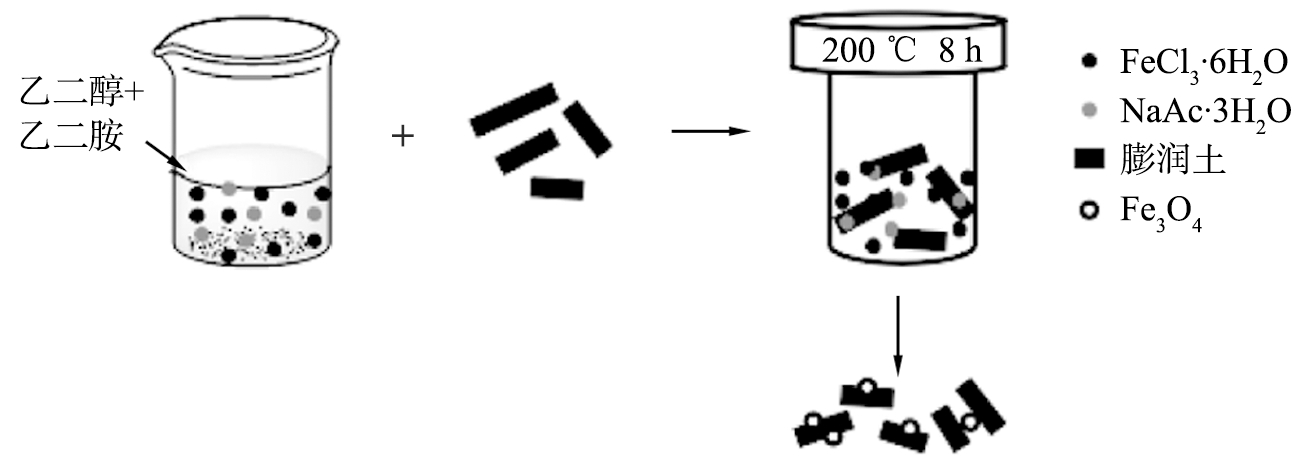
图2 溶剂热法制备磁性膨润土示意图
Fig.2 Schematic diagram of solvothermal preparation of magnetic bentonite
LDHs常用共沉淀法制备,因此以Fe3O4纳米颗粒为基体,可以利用该方法制备磁性LDHs材料[47-50],同时保留了Fe3O4和LDHs的晶体结构,具有良好吸附性和超顺磁性,合成策略示意图如图3[47]所示。
Yang等[51]采用溶胶-凝胶法制备了TiO2与Fe3O4-ZnAl-LDHs的复合材料,吸附和光催化效率可以通过调控TiO2与LDHs的质量比而改变,从而高效去除Cr(Ⅵ)。
Madhubala等[52]利用水热法,以FeSO4·7H2O、 Fe(NO3)3·9H2O、ZnCl2和NaOH作为原料制备Fe3O4@ZnO磁性纳米粒子。 在合成过程中加入印楝提取物起到了稳定作用,利用植物合成纳米颗粒具有环保、 简单、 经济、 生物相容性好等优点。 Xue等[53]发现氧化石墨烯(GO)可作为强氧化剂,有效氧化Fe(Ⅱ)转化为Fe3O4纳米粒子,同时沉积在氧化石墨烯的表面。先加入FeCl2溶液,用NH3·H2O调节溶液pH=9,可直接制备生成Fe3O4-GO纳米复合材料。这种方法为开发新型石墨烯基多功能纳米材料提供了依据。
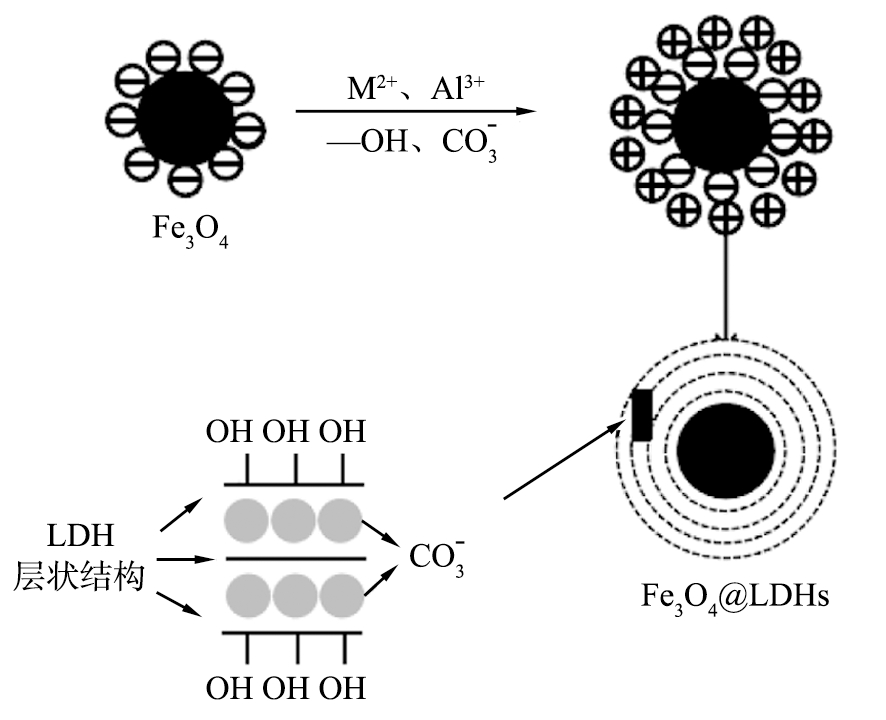
图3 Fe3O4@LDHs的合成策略
Fig.3 Synthesis strategy of Fe3O4@LDHs
以上工艺是制备Fe3O4磁性纳米材料的常规工艺,其他制备方法还有微波辅助法[54]、多元醇还原法[55]、热分解法[56]等,由于这些方法需要比较严格的操作条件,并且后续处理相对复杂,因此相关的研究相对较少。其中一些工艺仍在实验室研究阶段,难以适应大型连续生产。改进这些加工方法以实现工业化或开发新的制备方法,可以获得更好的磁性纳米材料。
3 磁性纳米材料在废水处理中的应用
3.1 重金属废水
目前,重金属污染是最严重的环境污染问题之一,由于重金属本身不能降解并且很容易富集,因此即使在低浓度下也可以显示出毒性。目前,有很多方法可以去除水中的重金属离子,包括沉淀、反渗透、电化学处理、膜过滤和离子交换[57],其中,吸附法已被广泛研究,具有去除效率高、操作简单、成本低等优点。
许多因素,如反应温度、 底物浓度和溶液pH等会影响磁性纳米粒子吸附重金属离子的能力。 Rajput等[58]用共沉淀法制备的Fe3O4纳米粒子成功去除水中的Pb(Ⅱ)。最佳吸附条件为:初始质量浓度为100 mg·L-1,温度为45 ℃,pH=5.0,吸附数据符合Langmuir等温线,动力学数据符合拟二级模型,吸附过程是由静电吸引产生的物化过程。Wang等[59]使用溶剂热法以聚二烯丙基二甲基氯化铵为原料合成了具有可调粒度的多孔Fe3O4粒子,并探究对水中As(Ⅴ)和As(Ⅲ)的吸附效果。结果表明,Fe3O4颗粒具有表面积大和磁性强的特点,对砷具有高吸附性能以及良好的磁性与可回收性。
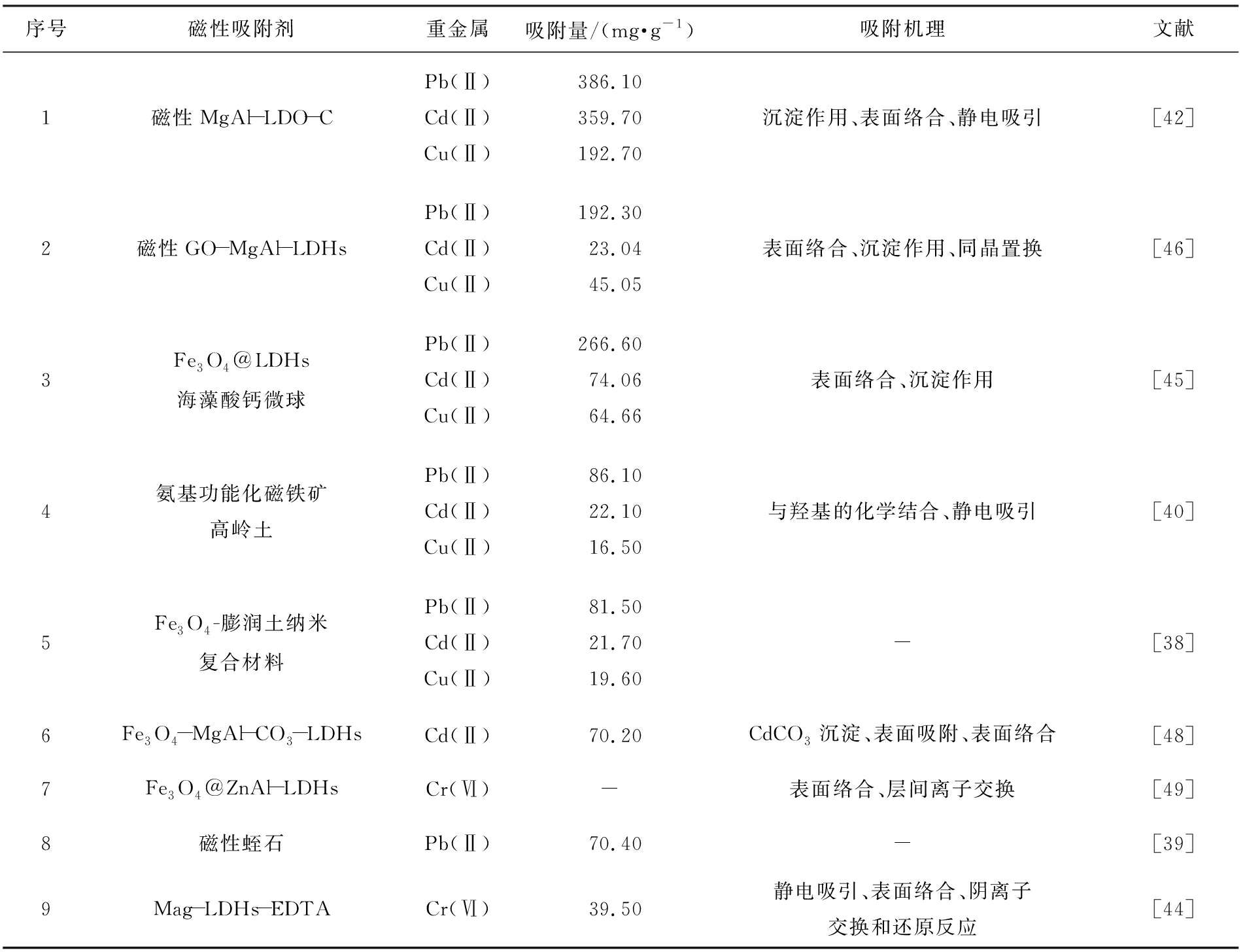
为了进一步提高Fe3O4的吸附性能,可以将其与另一种吸附剂结合或添加功能化基团,2种粒子共同作用减少其在废水中的团聚,增加对重金属吸附亲和力并大大提高吸附能力。 闫良国课题组将一系列磁性纳米材料(磁性LDHs、 磁性膨润土、 磁性高岭土、 磁性蛭石等)用于水中重金属Pb(Ⅱ)、 Cd(Ⅱ)、 Cu(Ⅱ)和Cr(Ⅵ)的去除(表1),材料均表现出良好的吸附性能和可再生性,且在吸附过程完成后可以在外加磁场的作用下快速从固液体系中分离。
采用XRD、 FTIR、 XPS、 zeta电位等多种手段详细研究了重金属吸附作用机理。对于Pb(Ⅱ)、 Cd(Ⅱ)、 Cu(Ⅱ),主要作用机制包括表面络合、沉淀反应、同晶置换、静电作用等;对于Cr(Ⅵ),还包含吸附-还原耦合机制,即LDHs的给电子基团将吸附的Cr(Ⅵ)还原为Cr(Ⅲ),Cr(Ⅲ)再通过络合作用和同晶置换作用也被LDHs吸附。以Pb(Ⅱ)、 Cd(Ⅱ)、 Cu(Ⅱ)在磁性MgAl-LDO-C上的吸附为例,吸附机理示意图如图4[42]所示。
为了更好地利用TiO2的光催化还原能力,Yang等[51]制备了Fe3O4-ZnAl-LDHs与TiO2的复合材料,并详细研究了对水中Cr(VI)吸附与光催化的协同作用及机理。对质量浓度为20 mg·L-1的Cr(VI)溶液,Fe3O4-ZnAl-LDHs仅能吸附26%和74%,而复合TiO2后,通过紫外光照射,去除率可达到97%以上。Khodadadi等[60]用沸石和SiO2包覆的磁性纳米吸附剂对水中Cu(Ⅱ)和Pb(Ⅱ)的吸附性能显著提高。这种吸附剂不仅保持了原有沸石的较好吸附性能,降低了团聚现象,而且可以通过外部磁场有效地分离。Li等[61]将Fe3O4纳米颗粒引入碳框架中合成了粒径小、比表面积大的含铁磁的介孔碳纳米球(Fe-MCNs),用以除去水溶液中的Cr(Ⅵ)。形成的Fe-MCNs通过对Cr(Ⅵ)的吸附表现优于Fe3O4且再生性良好。
表1 LDHs去除重金属吸附量及吸附机理
Tab.1 Adsorption amounts and mechanisms of heavy metals by LDHs
序号磁性吸附剂重金属吸附量/(mg·g-1)吸附机理文献1磁性MgAl-LDO-CPb(Ⅱ)Cd(Ⅱ)Cu(Ⅱ)386.10359.70192.70沉淀作用、表面络合、静电吸引[42]2磁性GO-MgAl-LDHsPb(Ⅱ)Cd(Ⅱ)Cu(Ⅱ)192.3023.0445.05表面络合、沉淀作用、同晶置换[46]3Fe3O4@LDHs海藻酸钙微球Pb(Ⅱ)Cd(Ⅱ)Cu(Ⅱ)266.6074.0664.66表面络合、沉淀作用[45]4氨基功能化磁铁矿高岭土Pb(Ⅱ)Cd(Ⅱ)Cu(Ⅱ)86.1022.1016.50与羟基的化学结合、静电吸引[40]5Fe3O4-膨润土纳米复合材料Pb(Ⅱ)Cd(Ⅱ)Cu(Ⅱ)81.5021.7019.60-[38]6Fe3O4-MgAl-CO3-LDHsCd(Ⅱ)70.20CdCO3沉淀、表面吸附、表面络合[48]7Fe3O4@ZnAl-LDHsCr(Ⅵ)-表面络合、层间离子交换[49]8磁性蛭石Pb(Ⅱ)70.40-[39]9Mag-LDHs-EDTACr(Ⅵ)39.50静电吸引、表面络合、阴离子交换和还原反应[44]
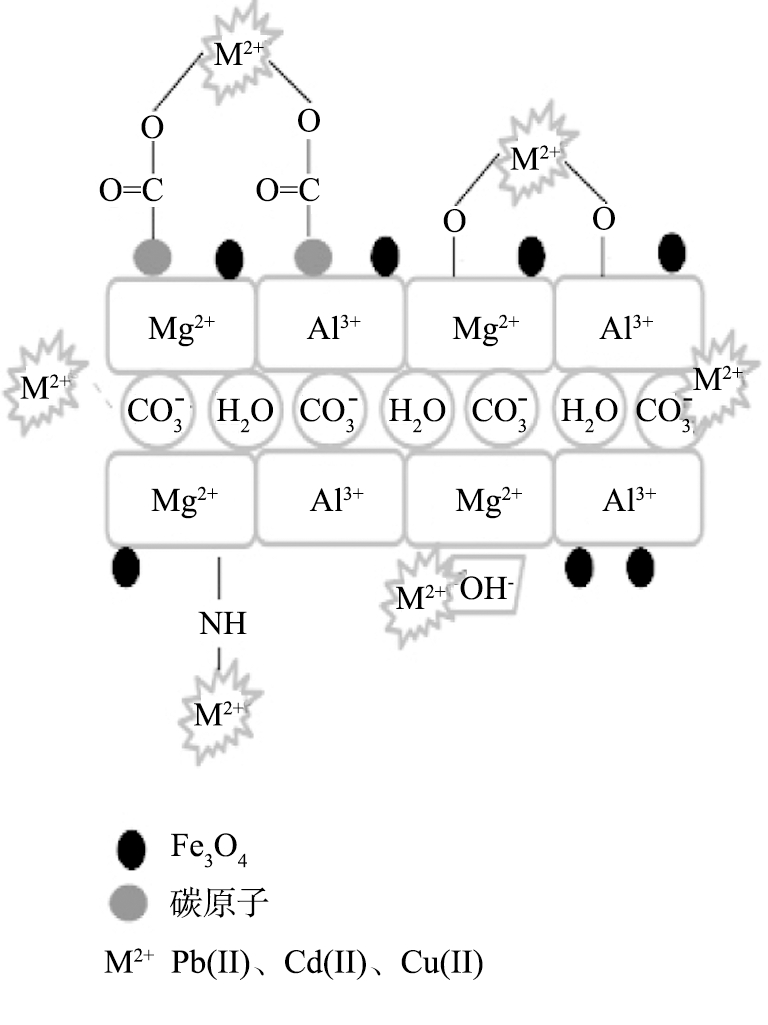
图4 磁性MgAl-LDO-C对重金属吸附作用机理示意图
Fig.4 Adsorption mechanisms of magnetic
MgAl-LDO-C for heavy metals
3.2 难降解有机污染物废水
除重金属污染外,难降解有机废水也是最重要的工业污染物之一,如印染、 纺织、 化工和染料制造等。 磁性纳米材料不仅可以吸附水中重金属,在处理难降解的有机污染物方面也展示出良好的效果。
3.2.1 吸附作用
磁性纳米材料对有机污染物的去除机理包括静电吸引、 π-π键相互作用、 疏水作用和氢键等[62]。
Shan等[50]将制备的Fe3O4与LDHs的复合材料(Fe3O4@LDHs),用于吸附水中活性红、刚果红和酸性红1,反应在30 min达到平衡,符合拟二级动力学模型。对染料的吸附为3步反应:一是通过静电吸引在磁性复合材料表面发生吸附;二是![]() 通过离子交换取代染料中的
通过离子交换取代染料中的![]() 三是C
三是C![]() C和N
C和N![]() N化学键的引入增加了染料吸附量。 吴帅等[63]制备磁性膨润土微球,用于吸附碱性品红与碱性品蓝2种染料,最大吸附量出现在pH=6的条件下。吸附动力学过程符合拟二级动力学模型,说明吸附过程为化学吸附。材料均变表现出良好的分离性和可再利用性。
N化学键的引入增加了染料吸附量。 吴帅等[63]制备磁性膨润土微球,用于吸附碱性品红与碱性品蓝2种染料,最大吸附量出现在pH=6的条件下。吸附动力学过程符合拟二级动力学模型,说明吸附过程为化学吸附。材料均变表现出良好的分离性和可再利用性。
Xu等[64]制备的碳纳米管(MWCNTs)抑制了Fe3O4的聚集和钝化,合成了磁性纳米复合材料Fe3O4@MWCNTs,并研究对2,4-二氯酚(2,4-DCP)吸附-脱氯-脱附的过程。动力学数据符合拟一级模型,吸附机理为π-π键相互作用和静电吸引。
3.2.2 催化降解作用
磁性纳米材料除了具有吸附作用外,还对有机污染物具有催化分解作用,在催化过程中起重要作用的是具有很强的氧化还原特性的电子-空穴对,反应可以生成氧化能力强的基团(例如·OH),将水中的有机污染物分解为小分子物质,从而减少了对环境的危害[65]。
TiO2基纳米材料催化剂对有机污染物的降解具有良好的效果。任学昌等[66]先后将Al2O3和TiO2与Fe3O4复合,制得磁负载光催化剂,用于研究对苯酚的光催化降解及其光催化活性。 结果表明,该材料对苯酚的光催化降解遵循一级速率方程。 经过5个周期的使用后,活性略有下降,并拥有良好的磁回收性能和催化活性。 Choi等[67]用溶胶-凝胶法,在Fe3O4上涂覆TiO2形成Fe3O4@TiO2颗粒,然后通过化学还原在表面沉积银纳米粒子,从而形成Ag-Fe3O4@TiO2核壳型磁性纳米催化剂。 催化剂对罗丹明B的光催化降解效果明显优于Fe3O4@TiO2颗粒,这是因为Ag-Fe3O4@TiO2粒子对光的吸收扩展到了可见光范围,有效地防止光生电子的复合和光生空穴,从而提升光催化性能。
3.3 其他污染物
除了主要的重金属和有机污染物外,废水还包含其他污染物,例如无机和放射性污染物。 由于它们在废水中的含量低,通常被忽略。 磷是水生植物生长的必要元素,但是,由于大量使用含磷物质,导致水体富营养化,除磷是重要的含磷废水治理手段。
Yan等[47]制备了磁性Fe3O4@LDHs材料,Chen等[41]制备了磁性硅藻土和磁性伊利石材料,对水中磷酸盐进行吸附去除研究。吸附动力学遵循拟二阶动力学方程,吸附等温线符合Langmuir模型,吸附机理包括吸附剂之间的静电吸引以及磷酸基团与羟基之间的配体交换。所制备的磁性材料表现出较好的选择性、可再生性和可再利用性。
随着氧化石墨烯(GO)在工业上的广泛使用,将不可避免地排放到环境中,对动物和细胞有毒害作用。 Hou等[43]制得的磁性Fe3O4@LDHs材料对水中的GO表现出良好的吸附性,最大吸附量为82.4 mg/g-1,动力学数据符合拟二阶方程,吸附等温线符合与Freundlich和Langmuir模型,吸附后的材料可在10 s内被磁铁吸附分离。
环境中放射性污染物的浓度非常低,但是具有致癌性和高毒性。 铀离子流动性强,易溶于水,并且可以直接或间接进入食物链。 Calì等[68]在Fe3O4纳米颗粒的表面上,功能化加入磷酸盐基复合涂层,形成超顺磁性氧化铁纳米颗粒,去除溶液中的铀,在pH=7的条件下,对U(Ⅵ)的选择性和吸附性能良好。
4 总结与展望
与传统材料相比,磁性Fe3O4纳米材料可以有效提高污染物的去除效率,具有易于分离、可再生的优点,具有广阔的应用前景,但是磁性材料在废水处理中的应用现在存在一些缺陷,未来研究需进一步深入。
1)进一步优化磁性材料的加工方法和性能,探索简单、 经济且绿色的加工方法,发展成熟的制备工艺,简化功能化修饰步骤,促进功能性磁性材料的产业化,为材料的实际应用奠定基础。
2)在磁性材料的改性领域,应继续进行深入研究。 对于污水中的各种污染物,在磁性纳米粒子的表面上选择性地修饰官能团,以增强光催化性和吸附性,为表面功能化磁性纳米吸附材料的实际应用提供技术性支持。
3)许多研究表明,磁性纳米吸附剂是可再生的,但是,很少有研究对回收材料的结构与性质进行详细的表征。 故而今后可以加强这方面的研究,并且结合表征制定相应的优化和调整方案,延长其使用寿命。
4)结合磁性纳米材料的特性,尝试处理其他环境目标污染物,扩大其应用领域。
[1]MUKHERJEE S, LIANG L, VEISEH O. Recent advancements of magnetic nanomaterials in cancer therapy[J]. Pharmaceutics, 2020, 12(2): 147-165.
[2]肖雨诗, 曹强, 孟庆一, 等. 磁性纳米材料制备及其在传感器检测领域的应用[J]. 食品安全质量检测学报, 2019, 10: 6893-6902.
[3]贺敏岚, 李伟, 苏鑫, 等. 纳米磁性材料在水处理领域的研究进展[J]. 化工新型材料, 2015, 43(11): 28-29.
[4]DI S, NING T, YU J, et al. Recent advances and applications of magnetic nanomaterials in environmental sample analysis[J]. Trends in Analytical Chemistry, 2020, 126: 115864-115891.
[5]LI J, ZHOU Q, LIU Y, et al. Recyclable nanoscale zero-valent iron-based magnetic polydopamine coated nanomaterials for the adsorption and removal of phenanthrene and anthracene[J]. Science & Technology of Advanced Materials, 2017, 18(1): 3-16.
[6]NASSAR M Y, AHMED I S, MOHAMED T Y, et al. Controlled, template-free, and hydrothermal synthesis route to sphere-like α-Fe2O3 nanostructures for textile dye removal[J]. RSC Advance, 2016, 6(4): 20001-20013.
[7]KHAN M,LO I M C. Removal of ionizable aromatic pollutants from contaminated water using nano gamma-Fe2O3 based magnetic cationic hydrogel: Sorptive performance,magnetic separation and reusability[J]. Journal of Hazardous Materials, 2017, 322: 195-204.
[8]ZHOU Z H, LI L, ZHANG Z B, et al. Syntheses of magnetic nanocomposite and its adsorption of uranyl ions[J]. Applied Chemical Industry, 2016, 45(2): 198-202.
[9]YANG C, WU J J, HOU Y L. Fe3O4 nanostructures: synthesis, growth mechanism, properties and applications[J]. Chemical Communications, 2011, 47(18): 5130-5141.
[10]RAWAL R, CHAWLA S, PUNDIR C S. An electrochemical sulfite biosensor based on gold coated magnetic nanoparticles modified gold electrode[J]. Biosensors and Bioelectronics, 2012, 31(1): 144-150.
[11]BAI L Z, LI Z P, ZHANG Y, et al. Synthesis of water-dispersible graphene-modified magnetic polypyrrole nanocomposite and its ability to efficiently adsorb methylene blue from aqueous solution[J]. Chemical Engineering Journal, 2015, 279: 757-766.
[12]LI J C, HU Y, YANG J, et al. Hyaluronic acid-modified Fe3O4@Au core/shell nanostars for multimodal imaging and photothermal therapy of tumors[J]. Biomaterials, 2015, 38: 10-21.
[13]GAWANDE M, BRANCO P, VARMA R. Nano-magnetite (Fe3O4) as a support for recyclable catalysts in the development of sustainable methodologies[J]. ChemInform, 2013, 42(8): 3371-3393.
[14]GHASEMI N, GHASEMI M, MOAZENI S, et al. Zn(Ⅱ) removal by aminofunctionalized magnetic nanoparticles: Kinetics, isotherm, and thermodynamic aspects of adsorption[J]. Journal of Industrial and Engineering Chemistry, 2018, 62: 302-310.
[15]NABIYOUNI G, JULAEE M, GHANBARi D, et al. Room temperature synthesis and magnetic property studies of Fe3O4 nanoparticles prepared by a simple precipitation method[J]. Journal of Industrial and Engineering Chemistry, 2015, 21: 599-603.
[16]CHEN K, WANG G H, LI W B, et al. Application of response surface methodology for optimization of Orange II removal by heterogeneous Fenton-like process using Fe3O4 nanoparticles[J]. Chinese Chemical Letters, 2014, 25(11): 1455-1460.
[17]LEI W, LIU Y S, SI X D, et al. Synthesis and magnetic properties of octahedral Fe3O4 via a one-pot hydrothermal route[J]. Physics Letters A, 2016, 381(4): 314-318.
[18]SU M H, HE C, SHIH K. Facile synthesis of morphology and size-controlled, α-Fe2O3, and Fe3O4, nano-and microstructures by hydrothermal/solvothermal process: The roles of reaction medium and urea dose[J]. Ceramics International, 2016, 42: 14793-14804.
[19]HUANG Y, ZHANG L P, HUAN W W, et al. A study on synthesis and properties of Fe3O4 nanoparticles by solvothermal method[J]. Glass Physics and Chemistry, 2010, 36(3): 325-331.
[20]BAI X L, DU J Y, WU B, et al. Shape controlled synthesis and growth mechanism of magnetic Fe3O4 nanoparticles[J]. Materials Review, 2011, 25: 77-80.
[21]ZHU L P, LIAO G H, BING N C, et al. Self-assembly of Fe3O4 nanocrystal-clusters into cauliflower-like architectures: Synthesis and characterization[J]. Journal of Solid State Chemistry, 2011, 184(9): 2405-2411.
[22]LV B L, XU Y, GAO Q, et al. Controllable synthesis and magnetism of iron oxides nanorings[J]. Journal of Nanoscience & Nanotechnology, 2010, 10(4): 2348-2359.
[23]LI X Y, SI Z J, LEI Y Q, et al. Direct hydrothermal synthesis of single-crystalline triangular Fe3O4 nanoprisms[J]. Cryst Eng Comm, 2010, 12(7): 2060-2064.
[24]XUAN S H, WANG F, WANG Y X, et al. Facile synthesis of size-controllable monodispersed ferrite nanospheres[J]. Journal of Materials Chemistry, 2010, 20(24): 5086-5094.
[25]NAJAFI A, NEMATIPOUR K. Synthesis and magnetic properties evaluation of monosized FeCo alloy nanoparticles through microemulsion method[J]. Journal of Superconductivity & Novel Magnetism, 2017, 30(9): 1-7.
[26]赵增宝, 刘福田, 耿明鑫, 等. 微乳液法制备Fe3O4纳米颗粒[J]. 济南大学学报(自然科学版), 2010, 24(1): 17-20.
[27]LU T, WANG J H, YIN J, et al. Surfactant effects on the microstructures of Fe3O4 nanoparticles synthesized by microemulsion method[J]. Colloids & Surfaces A Physicochemical & Engineering Aspects, 2013, 436: 675-683.
[28]XUE J C, WANG H, ZHENG X S, et al. Formation of uniform oil-soluble Fe3O4 nanoparticles via oil-water interface system[J]. Journal of Donghua University (English Edition), 2015, 32(2): 175-179.
[29]CUI H T, LIU Y, REN W Z. Structure switch between α-Fe2O3, γ-Fe2O3 and Fe3O4 during the large scale and low temperature sol-gel synthesis of nearly monodispersed iron oxide nanoparticles[J]. Advanced Powder Technology, 2013, 24(1): 93-97.
[30]ZHOU J, MA M, ZHANG Y, et al. Synthesis and characterization of magnetite particles with different diameters[J]. Journal of Southeast University (Natural Science Edition), 2005, 35(4): 615-618.
[31]YANG Z D, LV A H, NIE Y L, et al. Catalytic ozonation performance and surface property of supported Fe3O4 catalysts dispersions[J]. Frontiers of Environmental Science & Engineering, 2013, 7(3): 451-456.
[32]CHEN X C. Core/shell structured silica spheres with controllable thickness of mesoporous shell and its adsorption, drug storage and release properties[J]. Colloids and Surfaces A: Physicochemical and Engineering Aspects, 2013, 428: 79-85.
[33]JIA Y T, GAO Z X, CUI J S. Preparation and characterization of two different amino-modified iron oxide magnetic nanoparticles and determination of the amount of amino on nanoparticle surface[J]. Journal of Preventive Medicine of Chinese Peoples Liberation Army, 2017, 35(1): 1-5.
[34]WANG Z X, XU J, HU Y J, et al. Functional nanomaterials: Study on aqueous Hg(Ⅱ) adsorption by magnetic Fe3O4@SiO2-SH nanoparticles[J]. Journal of the Taiwan Institute of Chemical Engineers, 2015, 60: 394-402.
[35]LI X P, WANG C B, ZHANG J G, et al. Preparation and application of magnetic biochar in water treatment: a critical review[J]. Science of the Total Environment, 2020, 711: 134847-134860.
[36]CHEERA P, TANG H, LIU W. Magnetic Fe3O4 based layered double hydroxides (LDHs) nanocomposites (Fe3O4/LDHs): Recent review of progress in synthesis, properties and applications[J]. Journal of Nanostructure in Chemistry, 2018, 8(4): 393-412.
[37]MASUD H, RAVI N, DU J H, et al. Critical review of magnetic biosorbents: their preparation, application, and regeneration for wastewater treatment[J]. Science of the Total Environment, 2020, 702: 134893-134913.
[38]YAN L G, LI S, YU H Q, et al. Facile solvothermal synthesis of Fe3O4/bentonite for efficient removal of heavy metals from aqueous solution[J]. Powder Technology, 2016, 301: 632-640.
[39]YAO J, CHEN Y, YU H Q, et al. Efficient and fast removal of Pb(Ⅱ) by facile prepared magnetic vermiculite from aqueous solution[J]. RSC Advance, 2016, 6: 101353-101360.
[40]QIN L L, YAN L G, CHEN J, et al. Enhanced removal of Pb2+, Cu2+, and Cd2+ by amino-functionalized magnetite/kaolin clay[J]. Industrial & Engineering Chemistry Research, 2016, 55: 7344-7354.
[41]CHEN J, YAN L G, YU H Q, et al. Efficient removal of phosphate by facile prepared magnetic diatomite and illite clay from aqueous solution[J]. Chemical Engineering Journal, 2016, 287: 162-172.
[42]HOU T L, YAN L G, LI J, et al. Adsorption performance and mechanistic study of heavy metals by facile synthesized magnetic layered double oxide/carbon composite from spent adsorbent[J]. Chemical Engineering Journal, 2020,384: 123331-123341.
[43]HOU T L, YAN L G, YANG S Y, et al. Efficient removal of graphene oxide by Fe3O4/MgAl-layered double hydroxide and oxide from aqueous solution[J]. Journal of Molecular Liquids, 2019, 284: 300-306.
[44]LI J, YAN L G, YANG Y T, et al. Insight into the adsorption mechanisms of aqueous hexavalent chromium by EDTA intercalated layered double hydroxides: XRD, FTIR, XPS, and zeta potential studies[J]. New Journal of Chemistry, 2019, 43: 15915-15923.
[45]SUN J H, CHEN Y, YU H Q, et al. Removal of Cu2+, Cd2+ and Pb2+ from aqueous solutions by magnetic alginate microsphere based on Fe3O4/MgAl-layered double hydroxide[J]. Journal of Colloid and Interface Science, 2018, 532: 474-484.
[46]HUANG Q Q, CHEN Y, YU H Q, et al. Magnetic graphene oxide/MgAl-layered double hydroxide nanocomposite: one-pot solvothermal synthesis, adsorption performance and mechanisms for Pb2+, Cd2+, and Cu2+[J]. Chemical Engineering Journal, 2018, 341: 1-9.
[47]YAN L G, YANG K, SHAN R R, et al. Kinetic, isotherm and thermodynamic investigations of phosphate adsorption onto core-shell Fe3O4@LDHs composites with easy magnetic separation assistance[J]. Journal of Colloid and Interface Science, 2015, 448: 508-516.
[48]SHAN R R, YAN L G, YANG K, et al. Adsorption of Cd(Ⅱ) by Mg-Al-CO3 and magnetic Fe3O4/Mg-Al-CO3-layered double hydroxides: Kinetic, isothermal, thermodynamic and mechanistic studies[J]. Journal of Hazardous Materials, 2015, 299: 42-49.
[49]YAN L G, YANG K, SHAN R R, et al. Calcined ZnAl and Fe3O4/ZnAl-layered double hydroxides for efficient removal of Cr(Ⅵ) from aqueous solution[J]. RSC Advances, 2015, 5: 96495-96503.
[50]SHAN R R, YAN L G, YANG K, et al. MagneticFe3O4/MgAl-LDH composite for effective removal of three red dyes from aqueous solution[J]. Chemical Engineering Journal, 2014, 252: 38-46.
[51]YANG Y T, LI J, YAN T, et al. Adsorption and photocatalytic reduction of aqueous Cr(Ⅵ) by Fe3O4-ZnAl-layered double hydroxide/TiO2 composites[J]. Journal of Colloid and Interface Science, 2020, 562: 493-501.
[52]MADHUBALA V, KALAIVANI T. Phyto and hydrothermal synthesis of Fe3O4@ZnO core-shell nanoparticles using azadirachta indica and its cytotoxicity studies[J]. Applied Surface Science, 2018, 499: 584-590.
[53]XUE Y H, CHEN H, YU D S, et al. Oxidizing metal ions with graphene oxide: the in situ formation of magnetic nanoparticles on self-reduced graphene sheets for multifunctional applications[J]. Chemical Communications, 2011, 47: 11689-11691.
[54]崔琳, 刘臻龙, 郭世宇. 微波辅助制备Fe/Fe3O4/ZnO纳米复合物及其吸波性能[J]. 现代电子技术, 2015, 38(9): 151-154.
[55]蒋丽萍, 邱建华, 韦谷韫, 等. 多元醇还原法制备Fe3O4纳米粒子及磁性能表征[J]. 化工新型材料, 2015, 43(1): 166-168.
[56]ASUHA S, SUYALA B, SIQINTANA X, et al. Direct synthesis of Fe3O4 nanopowder by thermal decomposition of Fe-urea complex and its properties[J]. Journal of Alloys and Compounds, 2011, 509(6): 2870-2873.
[57]GIWA A, DINDI G, KUJAWA J. Membrane bioreactors and electrochemical processes for treatment of wastewaters containing heavy metal ions, organics, micropollutants and dyes: recent developments[J]. Journal of Hazardous Materials, 2019, 370: 172-195.
[58]RAJPUT S, PITTMAN C U, MOHAN D. Magnetic magnetite (Fe3O4) nanoparticle synthesis and applications for lead (Pb2+) removal from water[J]. Journal of Colloid and Interface Science, 2015, 468: 334-346.
[59]WANG T, ZHANG L Y, WANG H Y, et al. Controllable synthesis of hierarchical porous Fe3O4 particles mediated by poly(diallyldimethylammoniumchloride) and their application in arsenic removal[J]. ACS Applied Materials & Interfaces, 2013, 5(23): 12449-12459.
[60]KHODADADI M, MALEKPOUR A, ANSARITABAR M. Removal of Pb(Ⅱ) and Cu(Ⅱ) from aqueous solutions by NaA zeolite coated magnetic nanoparticles and optimization of method using experimental design[J]. Microporous and Mesoporous Materials, 2017, 248: 256-265.
[61]LI S H, LIU L, YU Y F, et al. Fe3O4 modified mesoporous carbon nanospheres: magnetically separable adsorbent for hexavalent chromium[J]. Journal of Alloys and Compounds, 2017, 698: 20-26.
[62]MA H, PU S Y,HOU Y Q, et al. A highly efficient magnetic chitosan “fluid” adsorbent with a high capacity and fast adsorption kinetics for dyeing wastewater purification[J]. Chemical Engineering Journal, 2018, 345: 556-565.
[63]吴帅, 侯太磊, 闫良国. 膨润土和磁性膨润土微球的制备及其对水中碱性染料的吸附性能[J]. 中国粉体技术, 2020, 26(3): 7-14.
[64]XU J, CAO Z, LIU X, et al. Insight into the adsorption-dechlorination-desorption of 2,4-dichlorophenol by functionalized Pd/Fe-Fe3O4@MWCNTs nanohybrids: interactions, kinetics, and mechanism[J]. Journal of Hazardous Materials, 2016, 317: 656-666.
[65]WANG J H, SHAO X Z, ZHANG Q, et al. Preparation of mesoporous magnetic Fe3O4, nanoparticle and its application for organic dyes removal[J]. Journal of Molecular Liquids, 2017, 248: 13-18.
[66]任学昌, 杜翠珍, 王雪姣, 等. TiO2/Al2O3/Fe3O4的低温水热法制备及其光催化和磁回收性能[J]. 工业水处理, 2015, 35(2): 45-49.
[67]CHOI K H, PARK S Y, PARK B J, et al. Recyclable Ag-coated Fe3O4@TiO2 for efficient photocatalytic oxidation of chlorophenol[J]. Surface and Coatings Technology, 2017, 320: 240-245.
[68]CAL E, QI J, PREEDY O, et al. Functionalised magnetic nanoparticles for uranium adsorption with ultra-high capacity and selectivity[J]. Journal of Materials Chemistry A, 2018, 6(7): 3063-3073.
E, QI J, PREEDY O, et al. Functionalised magnetic nanoparticles for uranium adsorption with ultra-high capacity and selectivity[J]. Journal of Materials Chemistry A, 2018, 6(7): 3063-3073.