介孔二氧化硅具有较大的比表面积、可调的粒径尺寸和孔隙结构、低密度、低毒性以及高机械稳定性等特点,因而备受关注[1]。介孔二氧化硅被广泛用作新型纳米催化载体[2-3],药物及生物酶载体[4-5]等。
生物酶是一种天然生物催化剂,具有专一的催化活性和良好的生物相容性,被广泛应用于催化、食品、生物医用等多个领域。以葡萄糖氧化酶(glucose oxidase,GOx)为例,它能催化葡萄糖产生D-葡萄糖酸和过氧化氢,不仅可以用来检测糖尿病、标记癌细胞生物[6],而且可广泛应用于制药和食品工业[7]。一般来说,游离酶是水溶性的,反应过程中很容易发生变性且回收困难,选择合适的载体固定酶则可在一定程度上避免酶的损失,提升酶的催化性能[8]。目前广泛应用的固定酶载体包括二氧化硅[9]、等离子体聚合物[10]、石墨炔[11]、Fe3O4-SiO2[12]等。介孔二氧化硅具有独特的物理化学性质,被广泛用作催化剂载体[13-14]。采用传统合成方法制备的介孔二氧化硅,孔径约为2~3 nm。由于生物酶具有较大的分子尺寸(>5 nm),因而很难进入介孔二氧化硅的孔道中,在一定程度上限制了载体的酶固定量。除此以外,介孔二氧化硅的孔道结构也会在一定程度上影响酶固定量。
鉴于此,本文中分别以十六烷基三甲基氯化铵(CTAC)和十六烷基三甲基溴化铵(CTAB)为表面活性剂,环己烷为油相试剂,采用双相合成法制备了粒径为50~100 nm,平均孔径为6~10 nm的大孔径的介孔二氧化硅纳米球(mesoporous silica nanospheres,MSNs),并对其形貌与结构进行了表征。同时,以制备的MSNs为载体,氨基化后,通过戊二醛交联实现了葡萄糖氧化酶的固定(GOx@MSNs),系统考察了表面活性剂对MSNs表面物理化学性质的影响,以及孔径和孔道结构对酶固定量的影响。
1 实验
1.1 试剂与仪器
试剂:正硅酸乙酯(TEOS,含量质量分数98%)、十六烷基三甲基氯化铵(CTAC,含量质量分数25%)、十六烷基三甲基溴化铵(CTAB)、3-氨丙基三乙氧基硅烷(APTES,含量质量分数99%)、戊二醛水溶液(GA,含量质量分数25%)、葡萄糖氧化酶来源于黑曲霉(GOx,Type X-S)(Sigma-Aldrich公司);三乙醇胺(TEOA,上海化学试剂厂);硝酸铵(NH4NO3,分析醇,上海振欣试剂厂);1-十八烷烯(C18H36,质量分数>90%,Aladdin公司);无水乙醇(C5H6O)、环己烷(C6H12)(均为分析纯,国药集团化学试剂有限公司);PierceTM BCA Protein Assay Kit和AmplexTM Red Glucose/Glucose Oxidase Assay Kit(赛默飞世尔科技公司)。
仪器:S-4800型扫描电子显微镜(日本日立公司);JEM-2100F型场发射透射电子显微镜(日本电子公司);Nicolet-6700型傅里叶变换红外光谱仪(赛默飞世尔科技公司);RU-200B/D/MAX-RB型转靶X射线衍射仪(日本理学);ASAP 2020M型全自动比较面积及孔隙度分析仪(美国麦克仪器公司);UV-2550型紫外-可见光分光光度计(日本岛津公司);OHB-1000型油浴锅(东京理化器械株式会社);FD-1A-50型冷冻干燥机(北京博医康实验仪器有限公司)。
1.2 方法
1.2.1 MSNs的制备
MSNs的制备参考文献中报道的方法[15]。以包含CTAB(24 mL,质量分数为25%)、TEA(0.18 g)和水(36 mL)的溶液为水相,在油浴锅中60 ℃搅拌1 h,磁棒的长度为3 cm,转速为250 r/min。缓慢加入TEOS(4 mL)和环己烷(16 mL)的混合物(油相),并在60 ℃下反应12 h。将反应溶液用乙醇洗涤3次,收集产物在60 ℃下用质量分数为0.6%的NH4NO3-乙醇溶液冷凝回流6 h,重复2次后,分别用水和乙醇洗涤。除去模板CTAB后,将得到的粉末在冷冻干燥机中冻干,得到MSN-1。
以CTAC为表面活性剂,采用相同的方法制备样品为MSN-2。
在MSN-2制备过程中,即在油水双相条件下反应12 h后,除去上层油相,并再次添加TEOS和环己烷的混合物,在60 ℃下反应12 h。将反应溶液用乙醇洗涤3次,收集产物在60 ℃下用质量分数为0.6%的NH4NO3-乙醇溶液冷凝回流6 h,重复2次后,分别用水和乙醇洗涤。除去模板CTAC后,将得到的粉末在冷冻干燥机中冻干,得到MSN-3。
1.2.2 氨基化MSNs(NH2-MSNs)制备
将20 mg的MSNs溶于10 mL的乙醇和1 mL的APTES中,在110 ℃下剧烈搅拌20 h。然后通过离心分离收集粉末,并用水和乙醇洗涤几次。最后,将粉末在冷冻干燥机中冻干,即可得到NH2-MSNs。
1.2.3 葡萄糖氧化酶固定
将NH2-MSNs超声分散于450 μL的磷酸缓冲液(PB,10 mmol/L,pH=6.5)中,超声处理10 min。然后向混合物中加入50 μL的GA水溶液,并在25 ℃振荡2 h。
将所得产物用PB缓冲液洗涤3次,并分散在GOx-PB缓冲液中(质量浓度为2 g/L)。将混合溶液在25 ℃振荡16 h,使其完全反应,然后用水洗涤3次得到样品(GOx@MSNs)。
1.2.4 葡萄糖氧化酶定量测试
Pierce BCA试剂盒利用Cu2+与蛋白质反应产生Cu+,BCA可与Cu2+产生比色反应,利用紫外-可见光分光光度计可准确检测蛋白质浓度,因此,可以以葡萄糖氧化酶为标准样品来分析GOx的浓度。纳米粒子的质量浓度为1.25 g/L。在此定义,GOx固定量为GL,固定密度为GLD,则有
GL=mGOx/msilica,
(1)
GLD=GL/SBET,
(2)
式中:mGOx为GOx的质量,mg;msilica为载体MSNs的质量,mg;SBET为载体的BET比表面积,m2/g。
在表1中详细列出材料的SBET、GL和GLD。
表1 MSNs的表面物理化学性质及对GOx的负载能力
Tab.1 Surficial physicochemical properties ofas-prepared MSNs and corresponding GOx loading capacity
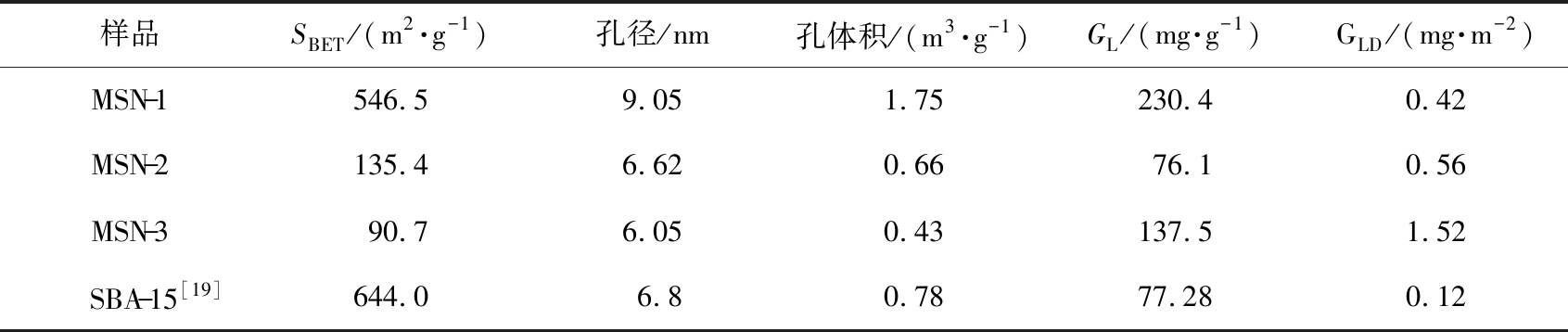
样品SBET/(m2·g-1)孔径/nm孔体积/(m3·g-1)GL/(mg·g-1)GLD/(mg·m-2)MSN-1546.59.051.75230.40.42MSN-2135.46.620.6676.10.56MSN-390.76.050.43137.51.52SBA-15[19]644.06.80.7877.280.12
1.2.5 葡萄糖氧化酶活性测试
AmplexTM Red葡萄糖-葡萄糖氧化酶检测试剂盒可用于分析葡萄糖氧化酶的活性。在测定中,葡萄糖氧化酶催化D-葡萄糖反应形成葡萄糖酸和过氧化氢。在存在辣根过氧化物酶(HRP)的情况下,过氧化氢与AmplexTM Red试剂以1 ∶1的化学计量比反应,生成红色荧光产物[16]。所有实验均根据检测试剂盒的用户操作指南进行。纳米粒子的质量浓度为0.012 g/L。
2 结果与讨
2.1 形貌结构表征
图1为不同反应条件下制备MSNs的SEM和TEM图像。从图中可以看出,合成的MSNs具有均匀的粒径分布。其中,MSN-1和MSN-2的粒径分别为(51.5±2.5)、(61.2±5.4) nm。结果表明,表面活性剂中阴离子的组成会影响MSNs的粒子尺寸。当阴离子半径增加时(Br-的大于Cl-的),MSNs的粒径会减小。当在MSN-2制备过程中重复加入TEOS与环己烷油相混合物,即可得到MSN-3。与MSN-2相比,MSN-3的粒径增大至(105.5±7.2) nm,说明可以通过循环加入反应物TEOS的方法实现MSNs粒径调控。

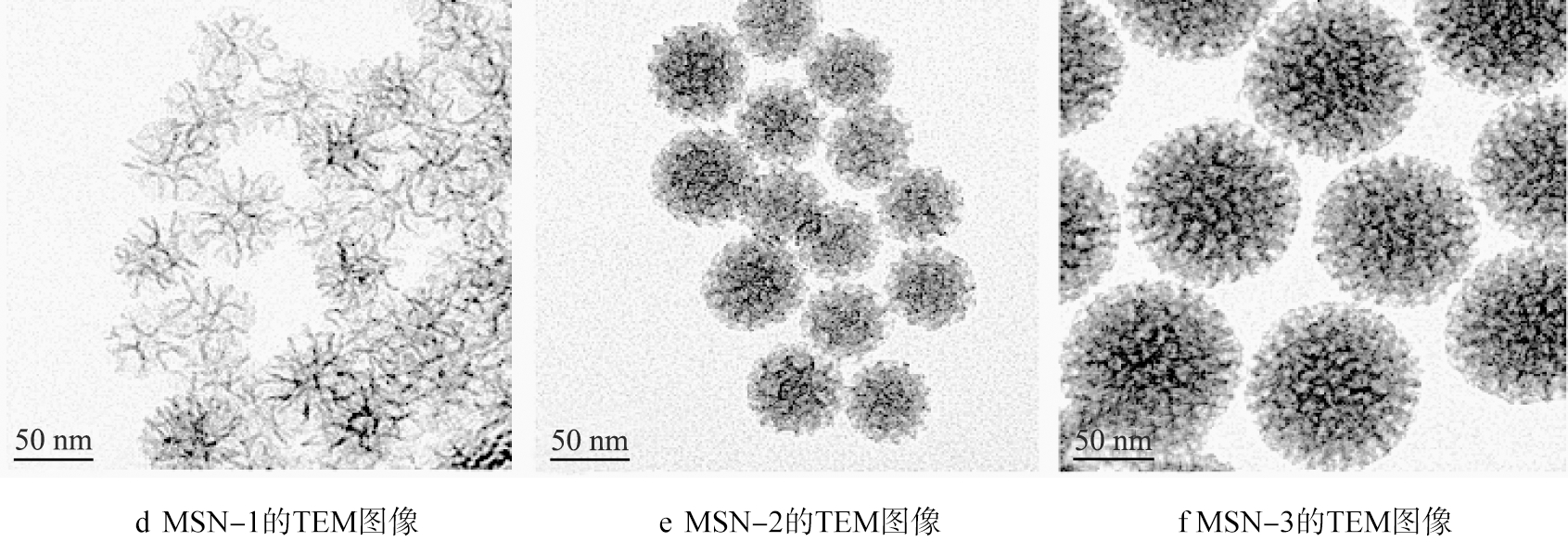
图1 MSNs的SEM和TEM图像 Fig.1 SEM and TEM images of as-prepared MSNs
从TEM图像中可以看出,采用不同表面活性剂制备的MSNs表现出截然不同的孔结构。其中,以CTAB为表面活性剂制备的MSN-1具有较薄的孔壁、较大的孔尺寸及树枝状通孔结构;而以CTAC为表面活性剂制备的MSN-2的孔结构表现为蛀洞状,且孔尺寸有所减小;同时随着再次加入TEOS和环己烷,得到的MSN-3的孔道相比MSN-2具有更好的贯通性。这可能是由于在MSN-3的制备过程中,SiO2倾向于在已经形成的孔道边缘进行异相成核与生长。
2.2 孔结构表征
制备的MSNs的孔结构通过小角XRD和N2吸附-脱附分析进行表征。图2a为MSNs的小角XRD图像。如图所示,所制备的MSNs均在2θ= 0.5 °~1.0 °范围内出现衍射峰,说明其具有较为均匀的孔道结构。其中,与MSN-2相比,MSN-3的衍射峰更明显,说明再次加入TEOS和环己烷进行二次反应,不仅可以增大纳米二氧化硅粒子的粒径,还可以在一定程度上提高孔结构的有序性。
图2b和图2c分别为MSNs的N2吸附-脱附等温线和孔径分布曲线。从图2b中观察到,3个样品均呈现出IV型等温线带有H1滞后环,表明它们的介孔性。其中,MSN-1具有较大的吸附量,且在相对压力在0.5~1.0间出现明显的吸附滞后现象,表明其具有一定的通孔结构;MSN-2和MSN-3主要为晶粒堆积形成的蛀洞状介孔结构;这与TEM表征结果一致。通过BET比表面积测试,MSN-1具有大的比表面积为546.5 m2/g,这是由于MSN-1中部分微孔的存在,可以通过N2吸附-脱附等温线在较低相对压力处吸附量的迅速增加来证实。与MSN-1相比,MSN-2和MSN-3均表现为介孔性,比表面积分别为135.4、90.7 m2/g。通过孔径分布曲线(图2c),可以看出,MSN-1、MSN-2、MSN-3等3个样品的孔径集中在6.0~10.0 nm,分别为9.05、6.62、6.05 nm。
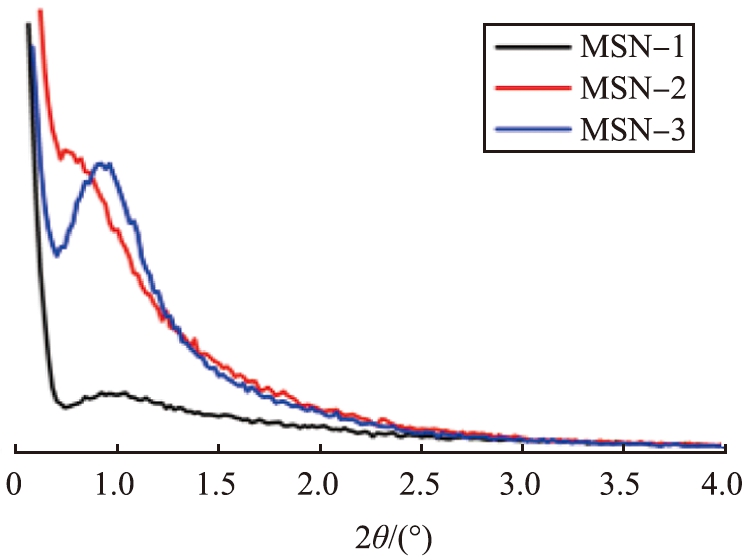
a 小角XRD图像
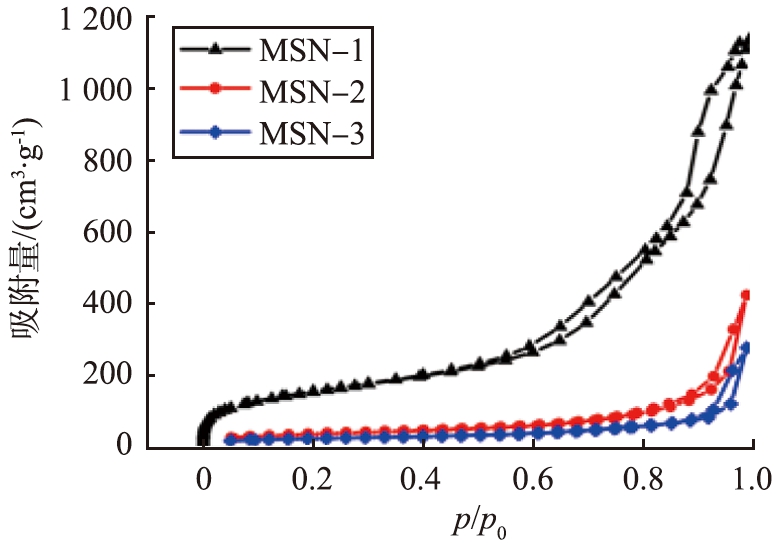
b 吸附-脱附等温曲线
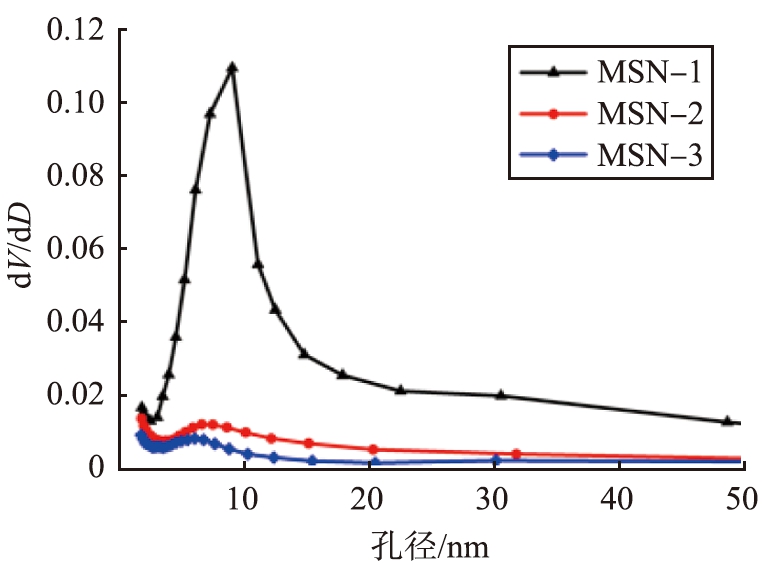
c 孔径分布曲线
图2 MSNs的表征 Fig.2 Characterization of MSNs
表1详细列出了制备MSNs的表面物理化学性质。结果表明,制备的MSNs的孔径都远大于传统方法制备的介孔SiO2[17-18]。这是因为采用双相合成方法形成油水乳液胶束具有较大的曲率半径,TEOS在乳液滴表面水解,形成较大的孔[15]。
2.3 固定酶表征及活性分析
以NH2-MSNs为载体,采用戊二醛交联技术进行GOx固定,其固定过程以MSN-3为例,并通过红外光谱进行表征。图3为氨基修饰样品(NH2-MSNs)和GOx固定后样品(GOx@MSNs)的红外光谱图。如图所示,1 101、803 cm-1处分别为Si—O—Si反对称伸缩振动和对称伸缩振动,表明载体的确为二氧化硅。2 958 cm-1处为—CH3的伸缩振动,2 926、2854 cm-1处分别为—CH2—的反对称和对称伸缩振动,1 635 cm-1为—NH2振动,证明APTES修饰成功,载体MSNs上带有—NH2基团,为后续酶连接做好准备。另外,在GOx@MSNs的红外谱图中,出现在1 654 cm-1处GOx的特征酰胺Ⅰ吸附带和1 545、1 493、1 458 cm-1处FAD上的芳环骨架则说明酶成功修饰到MSNs载体上[20]。酶固定并没有明显影响GOx的催化活性。
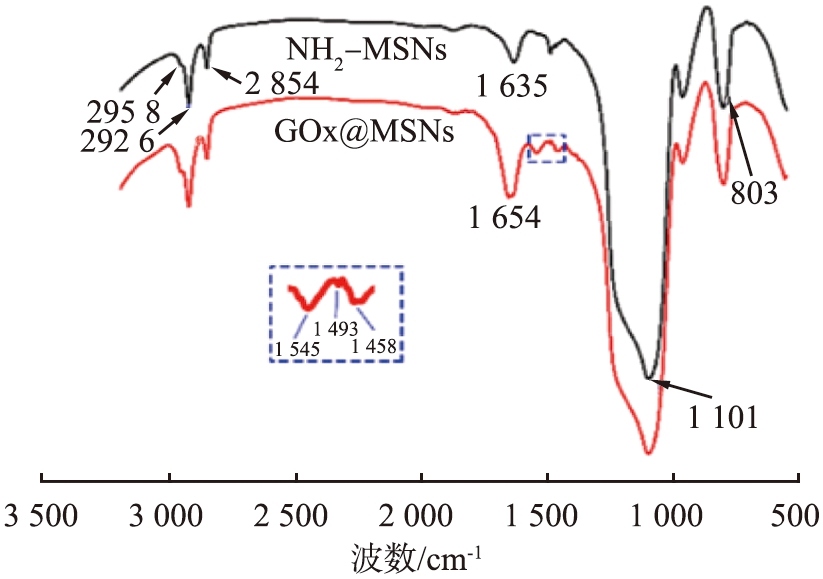
图3 NH2-MSNs和GOx@MSNs的红外光谱图
Fig.3 Infrared spectra of NH2-MSNs and GOx@MSNs
图4为采用葡萄糖氧化酶活性试剂盒检测的MSNs固定的GOx的活性。通过固定化酶催化葡萄糖氧化水解,在25 ℃下,测定H2O2的生成速率来表征。活性单位为U/L,意味着在pH=5.1,温度为30 ℃下,每1 L样品,每分钟将1.0 μmol β-d-葡萄糖氧化为d-葡萄糖酸内酯和H2O2的量。
根据Michaelis-Menten方程,酶的催化反应速率可由下式计算,
V=Vmaxc/(Km+c),
(3)
式中:Km为米氏常数,mmol/L;c为葡萄糖浓度,mmol/L;Vmax是最大反应速率,U/L。
图4a是通过Michaelis-Menten方程拟合得到的GOx@MSNs活性,可知,在葡萄糖浓度达200 mmol/L时,反应速率达到饱和,纳米粒子的催化活性不再增加。图4b是通过Hanes-Woolf方程拟合得到的GOx@MSNs活性,通过拟合可以得到Vm为14.14 U/L,而Km为60.24 mmol/L,处于药品规定的范围33~110 mmol/L内,说明酶固定并没有明显影响GOx的催化活性。
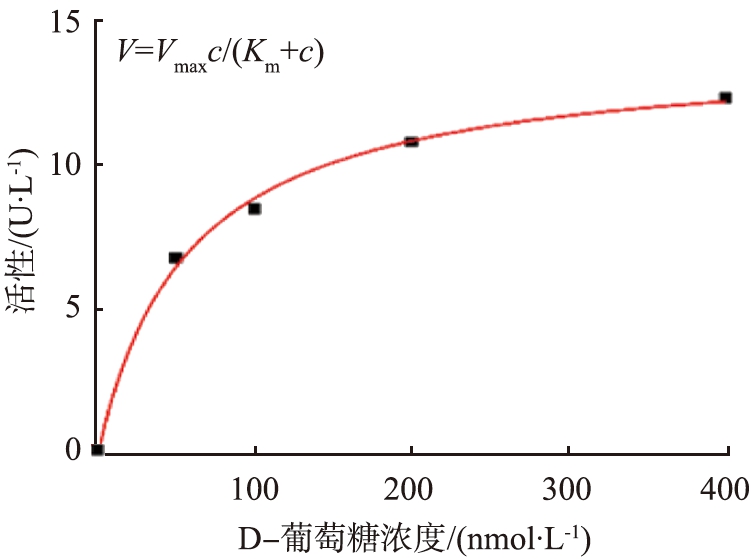
a Michaelis-Menten方程
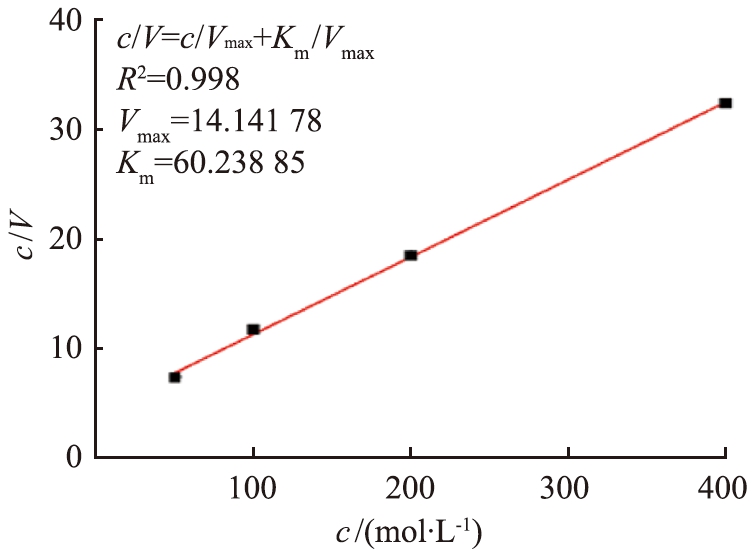
b Hanes-Woolf方程
图4 固定酶活性表征
Fig.4 Enzyme activity after immobilization
2.4 酶数量分析
载体上固定GOx的量通过蛋白试剂盒进行检测,以单位质量载体连接的酶量作为判断依据。 图5为连酶后不同载体的酶固定量图。如图所示,MSN-1、MSN-2和MSN-3的GL分别为230.4、76.1、137.5 mg/g,均大于文献报道的介孔材料SBA-15固定酶量(77.28 mg/g)[19]。这可能是因为,文献报道的SBA-15尺寸为微米级,生物酶进入孔道后易造成堵塞,导致孔道内部大量活性位点未被利用,孔道利用率较低,正如表1所示,SBA-15具有最小的GLD。相比于MSN-2和MSN-3,MSN-1虽然具有最大的GL,但是GLD较小,这是由于MSN-1较薄的孔壁中可能存在大量微孔(2.2中有相关说明)。这些微孔在酶固定过程中由于较小的尺寸未被利用,因而孔道利用率低。综合考虑载体样品的孔结构(详见表1)与GL,认为介孔二氧化硅作为载体用于生物酶固定的性能主要与2个因素有关:其一是介孔孔径。在制备样品中,MSN-1具有最大的孔径(9.05 nm),GOx能够进入孔道,为酶固定提供了更多的位点;其二是孔道贯通性。虽然MSN-2和MSN-3具有相似的孔径尺寸,但是单位质量MSN-3的固定酶量比MSN-2高了近1倍,这主要是由于MSN-3具有更好的孔道贯通性(如TEM图像所示),有利于GOx从载体表面进入孔道,提高了GL。
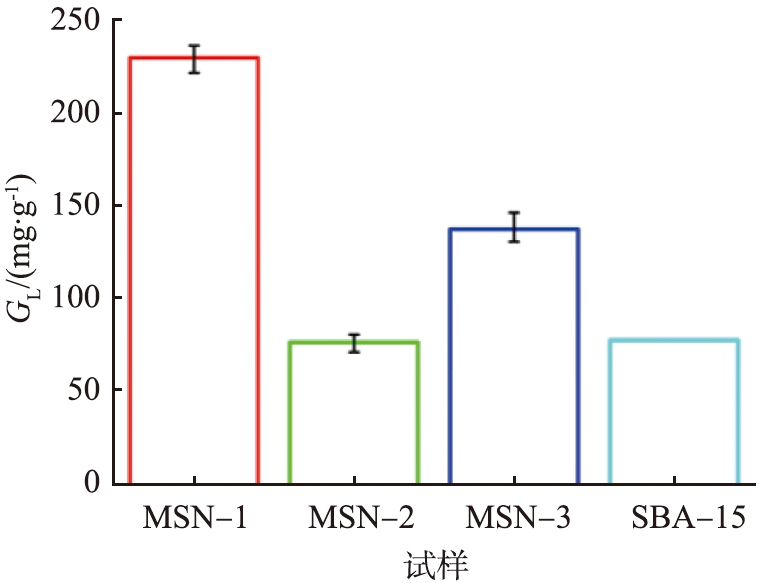
图5 连酶后不同载体的酶量
Fig.5 Enzyme amounts on different GOx@MSNs
3 结论
1)采用双相合成法,以十六烷基三甲基季铵盐为表面活性剂,环己烷为油相试剂,制备了具有较大孔径尺寸的介孔二氧化硅纳米球。
2)介孔二氧化硅纳米球的粒径可以通过循环加入反应物的油相溶液进行控制。
3)以CTAB为表面活性剂制备的样品MSN-1具有较小的粒径、较大的比表面积和孔径以及良好的孔道贯通性和最大的酶负载量(230.4 mg/g)。
4)以MSNs为载体,采用戊二醛交联技术固定葡萄糖氧化酶,其活性没有明显损失,且固定量与MSNs的孔径尺寸和孔道贯通性密切相关。孔径越大,孔道贯通性越好,越有利于酶的固定。
[1]WANG Y,DU X,LIU Z,et al.Dendritic fibrous nano-particles (DFNPs):rising stars of mesoporous materials[J].Journal of Materials Chemistry A,2019,7(10):5111-5152.
[2]SHEN D,CHEN L,YANG J,et al.Ultradispersed palladium nanoparticles in three-dimensional dendritic mesoporous silica nanospheres:toward active and stable heterogeneous catalysts[J].ACS Applied Materials &Interfaces,2015,7(31):17450-17459.
[3]TIAN J,YANG D,WEN J,et al.A stable rhodium single-site catalyst encapsulated within dendritic mesoporous nanochannels[J].Nanoscale,2018,10(3):1047-1055.
[4]HUO M,WANG L,CHEN Y,et al.Tumor-selective catalytic nanomedicine by nanocatalyst delivery[J].Nature Communications,2017,8(1):357.
[5]YANG B,CHEN Y,SHI J.Nanocatalytic medicine[J].Advanced Materials,2019,31(39):1901778(1-45).
[6]FU L-H,QI C,LIN J,et al.Catalytic chemistry of glucose oxidase in cancer diagnosis and treatment[J].Chemical Society Reviews,2018,47(17):6454-6472.
[7]GOLIKOVA E P,LAKINA N V,GREBENNIKOVA O V,et al.A study of biocatalysts based on glucose oxidase[J].Faraday Discussions,2017,202:303-314.
[8]YUSHKOVA E D,NAZAROVA E A,MATYUHINA A V,et al.Application of immobilized enzymes in food industry[J].Journal of Agricultural and Food Chemistry,2019,67(42):11553-11567.
[9]ZHU Y,JIANG Y,GAO J,et al.Immobilization of glucose oxidase in liposome-templated biomimetic silica particles[J].Chinese Journal of Catalysis,2013,34(4):741-750.
[10]MORSHED M N,BEHARY N,BOUAZIZI N,et al.Surface modification of polyester fabric using plasma-dendrimer for robust immobilization of glucose oxidase enzyme[J].Scientific Reports,2019,9(1):15730.
[11]LIU J,SHEN X,BAIMANOV D,et al.Immobilized ferrous ion and glucose oxidase on graphdiyne and its application on one-step glucose detection[J].ACS Applied Materials &Interfaces,2019,11(3):2647-2654.
[12]JAQUISH R,REILLY A K,LAWSON B P,et al.Immobilized glucose oxidase on magnetic silica and alumina:beyond magnetic separation[J].International Journal of Biological Macromolecules,2018,120:896-905.
[13]CARLSSON N,GUSTAFSSON H,THöRN C,et al.Enzymes immobilized in mesoporous silica:aphysical-chemical perspective[J].Advances in Colloid and Interface Science,2014,205:339-360.
[14]BRADY D,JORDAAN J.Advances in enzyme immobilisation[J].Biotechnology Letters,2009,31(11):1639.
[15]SHEN D,YANG J,LI X,et al.Biphase stratification approach to three-dimensional dendritic biodegradable mesoporous silica nanospheres[J].Nano Lett,2014,14(2):923-932.
[16]WANG N,MILLER C J,WANG P,et al.Quantitative determination of trace hydrogen peroxide in the presence of sulfide using the amplex red/horseradish peroxidase assay[J].Analytica Chimica Acta,2017,963:61-67.
[17]PAN L,HE Q,LIU J,et al.Nuclear-targeted drug delivery of TAT peptide-conjugated monodisperse mesoporous silica nanoparticles[J].Journal of the American Chemical Society,2012,134(13):5722-5725.
[18]KAO KC,MOU CY.Pore-expanded mesoporous silica nanoparticles with alkanes/ethanol as pore expanding agent[J].Microporous and Mesoporous Materials,2013,169:7-15.
[19]MAJUMDAR P,KHAN A Y,BANDYOPADHYAYA R.Diffusion,adsorption and reaction of glucose in glucose oxidase enzyme immobilized mesoporous silica (SBA-15) particles:experiments and modeling[J].Biochemical Engineering Journal,2016,105:489-496.
[20]翁诗甫.傅里叶变换红外光谱分析[M].3版.北京:化学工业出版社,2016.