随着化石能源的日益枯竭,核能在清洁能源结构中所占比例日益增加[1]。以碘、 铯、 镝为代表的核废料的处理成为了制约核电发展的重要的、 棘手的环节。
碘是高放射性和长周期放射性核废料中的主要放射源,其中共含有15种碘的同位素,对人体危害最大的是129I和131I。 129I的半衰期长达5.8×109 d,131I的比活度高,2者易被人体吸收后富集在甲状腺,对甲状腺造成持续损伤甚至引起癌变[2]。碘因挥发性强,在水中有一定的扩散能力,是较难处理的污染物。
气体处理主要有吸附法、氧化法、生物处理法、变压吸附与净化法、冷凝回收法等。其中,吸附法具有吸附容量大、无二次污染、稳定性好、再生能力强、价格低廉等优点,可被用于碘蒸气的处理上。
常见的碘蒸气吸附剂有活性炭[3]、金属-有机框架材料(MOFs)[4]和共价有机框架材料(COFs)[5]。活性炭在使用前需进行隔绝空气高温活化,同时存在实验重现性不高的缺点。MOFs与COFs的吸附量可观,但制备条件严苛,制备成本高昂,储存条件要求严格。
纳米金属氧化物是一种具有多孔结构而被广泛应用的吸附材料,如纳米氧化银[6]、 氧化亚铜[7]和氧化铋[8]等金属氧化物材料对于碘均具有良好的吸附能力。将纳米金属氧化物作为基底负载其他化合物而制得的金属氧化物吸附剂,可以有效地吸附和富集碘元素。
由于纳米氧化银、 纳米氧化亚铜和活性炭对碘吸附量都很大,而且都是常见易得的药品,本文中采用高温水热合成法制备掺杂含碳、 银、 铜的纳米金属氧化物复合材料(Ag-Cu-MOC); 分析银、 铜掺量对碘蒸气吸附量的影响,确定最佳的Ag、 Cu物质的量比; 对材料进行SEM、 EDS、 XRD、 XPS、 TG-DSC、 BET和FTIR的测试和表征,研究Ag-Cu-MOC对碘蒸汽的吸附性能和吸附机理;通过进行吸附-脱附再生实验,研究Ag-Cu-MOC的可重复性利用性;通过烧结实验研究吸附碘蒸气后材料的安全处理问题。通过研发工艺简单、 环境友好、 成本低廉、 吸附容量大的吸附材料Ag-Cu-MOC,实现放射性碘蒸气吸附材料的大规模工业应用。
1 材料制备
1.1 试剂和仪器
实验所用试剂如表1所示,全部试剂的纯度等级均为分析纯。实验仪器如表2所示。
表1 实验试剂
Tab.1 Experimental reagents

试剂名称生产厂家硝酸银(AgNO3)国药集团化学试剂有限公司硝酸铜(Cu(NO3)2·3H2O)国药集团化学试剂有限公司葡萄糖(C6H12O6)国药集团化学试剂有限公司氨水(NH3·H2O)国药集团化学试剂有限公司碘单质(I2)上海凛恩科技发展有限公司氧化硼(B2O3)成都艾科达试剂有限公司铁粉(Fe)天津市大茂化学试剂厂
表2 实验仪器
Tab.2 Experimental instrument

名称 型号 生产厂家 扫描电子显微镜FEI SCIOS美国赛默飞公司X射线衍射仪Shimadzu XRD-6000日本岛津公司热重分析仪Mettler Toledo TGA/DSC梅特勒-托利多公司X射线光电子能谱ESCALAB 250X美国赛默飞公司比表面积测试仪Micromeritics美国麦克仪器公司傅里叶变换红外光谱NicoletiS50美国赛默飞公司
1.2 制备机理
制备Ag-Cu-MOC的化学反应方程式[9-11]为
CH2OH(CH2OH)4CHO+2[Ag(NH3)2]OH→
CH2OH(CH2OH)4COONH4+H2O+2Ag+3NH3,
(1)
CH2OH(CH2OH)4CHO+2[Cu(NH3)4](OH)2→
CH2OH(CH2OH)4COONH4+H2O+2Cu+7NH3,
(2)
CH2OH(CH2OH)4CHO→6C+6H2O,
(3)
[Cu(NH3)4](OH)2→CuO+H2O+4NH3。
(4)
1.3 合成路线
Ag-Cu-MOC合成路线图如图1所示。
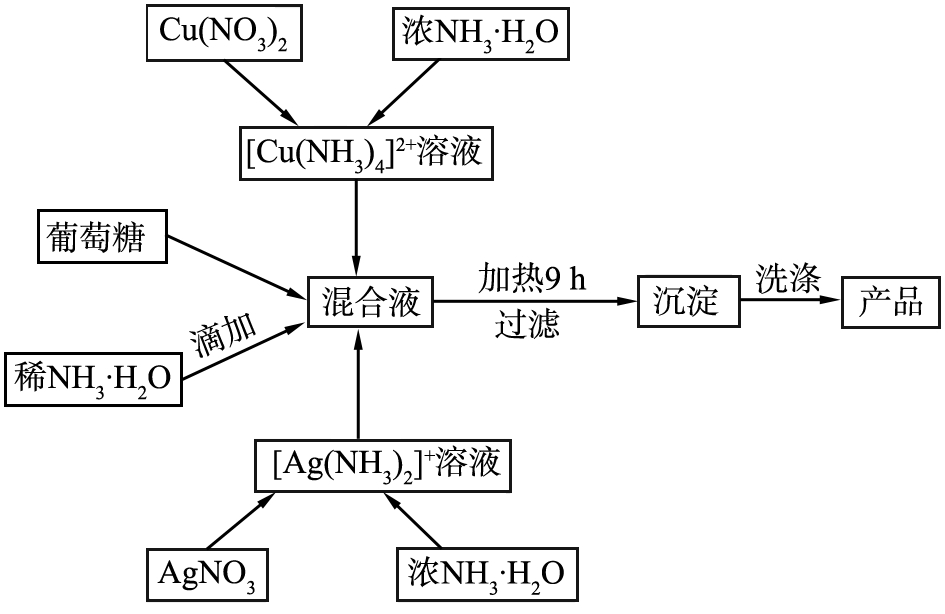
图1 Ag-Cu-MOC的合成路线图
Fig.1 Synthesis roadmap of Ag-Cu-MOC materials
分别量取一定量的AgNO3、 Cu(NO3)2溶解于去离子水中,并滴加浓氨水至溶液出现沉淀后又再次溶解,然后再向2种铵盐络合物溶液中滴加5滴浓氨水; 用上述溶液分别配置浓度为0.0 5 mol/L的[Cu(NH3)4]2+溶液和浓度为0.0 5 mol/L[Ag(NH3)2]+溶液。按n(Ag)∶n(Cu)为1∶1~1∶7的比例将银氨溶液和铜氨溶液混合,得15 mL混合溶液,再向其中滴加15 mL质量分数为5%的稀氨水溶液; 以360 r/min的转速,将该混合溶液磁力搅拌20 min,使其混合均匀; 向混合溶液中加入0.12 g葡萄糖。 以540 r/min的转速搅拌20 min,并在频率为54 000 Hz的超声波环境下放置20 min使溶质分散于溶液中; 再把所制备的溶液加入到高压反应釜里,在90 ℃条件下反应9 h; 待降至室温,取出反应釜,滤去上层清液得到沉淀物,分别用去离子水和无水甲醇清洗3次,并将所得沉淀物在60 ℃的条件下真空干燥2 h,得到Ag-Cu-MOC样品。
1.4 银、 铜掺量对吸附量的影响
图2为碘蒸气吸附装置示意图。将0.5 g的固态碘单质置于样品瓶中;将0.01 g的Ag-Cu-MOC置于石英坩埚中,再将坩埚置于样品瓶中;密封样品瓶后将其放入60 ℃的鼓风烘箱中,使固态碘单质升华为碘蒸气,Ag-Cu-MOC开始吸附;吸附完成之后待冷却至室温,取出Ag-Cu-MOC,静置后除去表面的碘单质。
Ag-Cu-MOC对碘蒸气的吸附量的计算公式为
(5)
式中:q为Ag-Cu-MOC的吸附量,mg/g; m0为石英坩埚的质量,g; m1为石英坩埚和吸附前Ag-Cu-MOC的总质量,g; m2为石英坩埚和吸附后的Ag-Cu-MOC总质量,g。
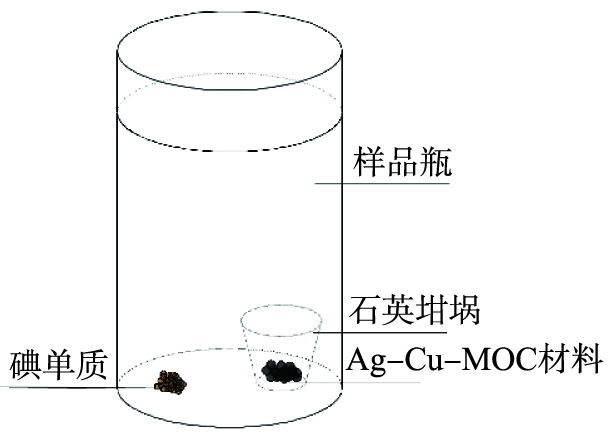
图2 碘蒸气吸附装置示意图
Fig.2 Schematic diagram of iodine vapor adsorption unit
银、 铜掺量(Ag、 Cu的物质的量的比值)对吸附量的影响如图3所示。由图3可看出,Ag-Cu-MOC对碘蒸气的吸附量随着n(Ag)∶n(Cu)的增大而增大;当n(Ag)∶n(Cu)=1∶6时,吸附量达到最大值1 735.5 mg/g。
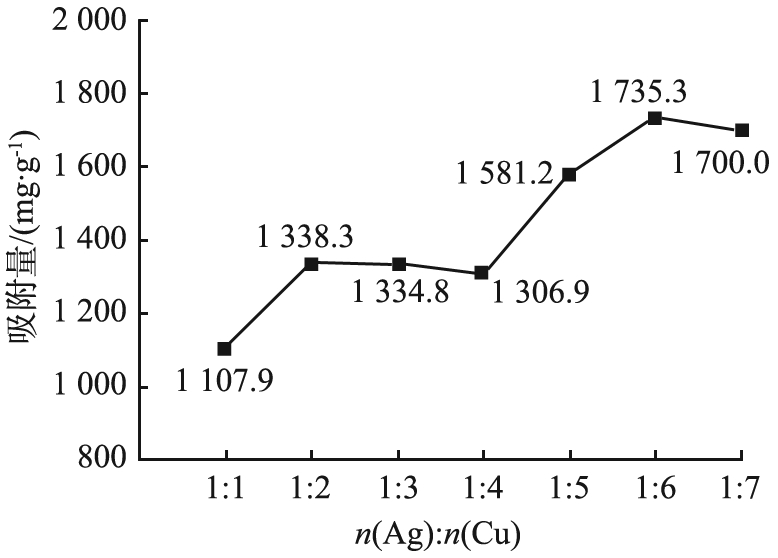
图3 银、 铜掺量对吸附量的影响
Fig.3 Influence of silver-copper doping amount on adsorption amount
1.5 吸附动力学研究
为了研究吸附容量随时间的变化趋势,分别采用准一级动力学吸附模型和准二级动力学吸附模型[12]进行拟合。准一级、准二级动力学的吸附模型为
ln(qe-qt)=ln qe-k1t,
(6)
(7)
式中: qe为吸附平衡时的碘的吸附总量,mg/g; qt为t时刻的碘的吸附容量,mg/g; k1为准一级动力学方程吸附速率常数,min-1; k2为准二级动力学方程吸附速率常数,g/mg·min。
将n(Ag) ∶n(Cu)=1∶6的Ag-Cu-MOC记为Ag-Cu-MOC-1 ∶6,Ag-Cu-MOC-1∶6的吸附动力学拟合曲线如图4所示。
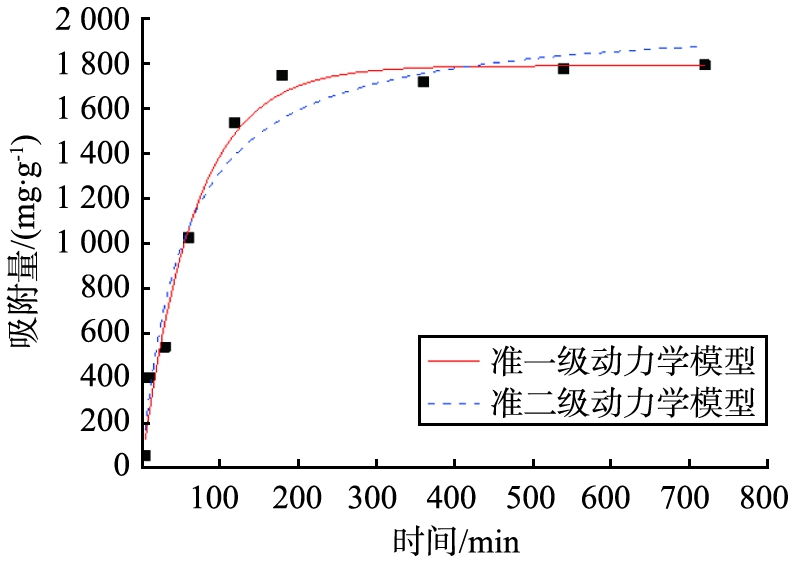
图4 Ag-Cu-MOC-1∶6的吸附动力学拟合曲线
Fig.4 Adsorption kinetics fitting
curve of Ag-Cu-MOC-1 ∶6
拟合曲线显示,Ag-Cu-MOC-1∶6的准一级动力学模型的相关系数平方R2为0.983 64,准二级动力学模型的R2为0.966 96,说明Ag-Cu-MOC-1∶6对碘蒸气的吸附作用更符合一级动力学模型。
2 材料的吸附性能
Ag-Cu-MOC-1∶6吸附碘蒸气之后记为I2@Ag-Cu-MOC-1∶6。对吸附碘蒸气之前、后的材料进行测试和表征,并根据吸附动力学探讨Ag-Cu-MOC的吸附机理。
2.1 SEM和EDS图像
图5为Ag-Cu-MOC-1∶6的SEM图像。由图5可知,Ag-Cu-MOC-1∶6为球状结构,球体颗粒直径大约为4 μm,颗粒之间的空隙较大,材料表面还分布着大小不均匀的片状物,因此,其良好的结构分散性有助于对碘蒸气的吸附。
图6为吸附碘蒸气后的I2@Ag-Cu-MOC-1∶6的SEM和EDS图像。

a 放大至10 μmb 放大至1 μm图5 Ag-Cu-MOC-1 ∶6的SEM图像Fig.5 SEM images of Ag-Cu-MOC-1 ∶6

a 放大至10 μmb 放大至1 μmc EDS图图6 I2@Ag-Cu-MOC-1 ∶6的SEM和EDS图像Fig.6 SEM and EDS images of I2@Ag-Cu-MOC-1 ∶6
由图6a、 6b可知,吸附碘蒸气后的材料结构未发生明显变化,但表面的颗粒直径减小为2 μm。由图6c可知,I、Cu、Ag这3种元素均匀地分布于材料表面,表明Ag-Cu-MOC-1∶6对碘蒸气有较好的吸附性能。
2.2 XRD图谱
图7为Ag-Cu-MOC-1∶6吸附碘蒸气前、 后的XRD图谱。 结合标准卡片进行对比验证后可知,Ag-Cu-MOC-1∶6中含有Ag(04-003-2941)、 CuO(97-004-3181)和Cu2O(97-003-1057) 3种物质。XRD图谱中,3种物质的衍射峰均宽度较窄、 强度较高,说明3种物质的结晶度好、 晶粒大。
2.3 XPS图谱和吸附机理
Ag-Cu-MOC-1∶6吸附碘蒸气前、后的XPS图谱如图8所示,图8a—8d分别为Cu、Ag、C、I这4种元素的拟合图谱。
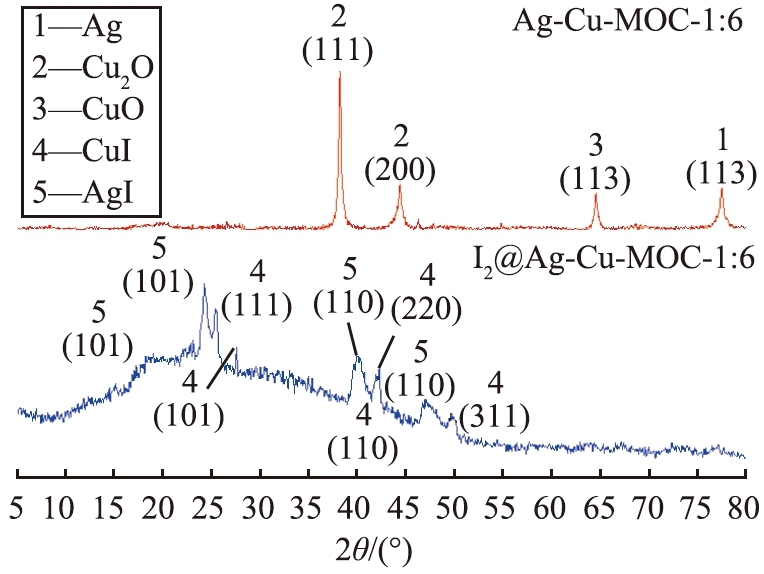
图7 吸附碘蒸气前、后的XRD图谱
Fig.7 XRD patterns before and after adsorption of iodine vapor
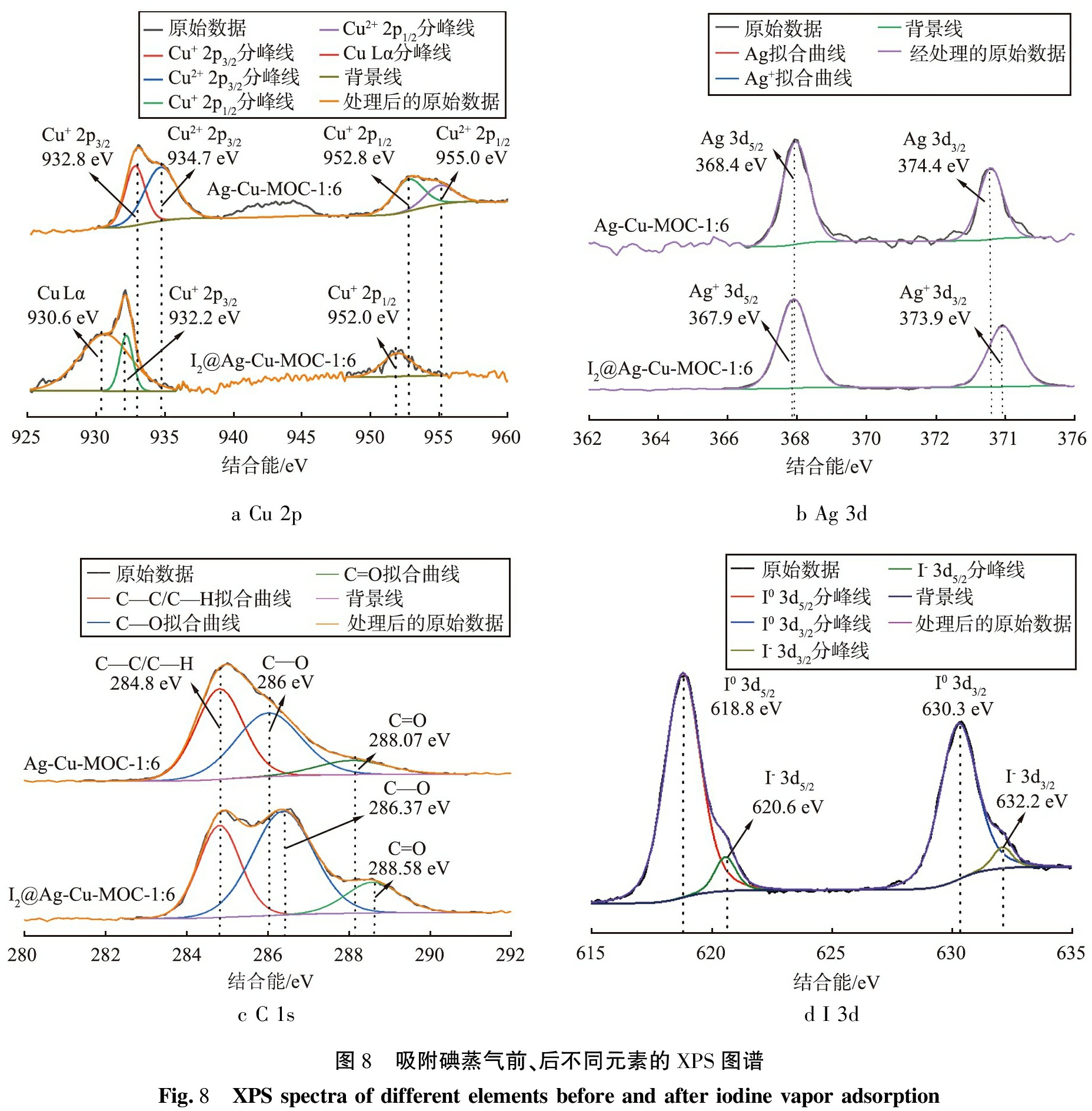
a Cu 2pb Ag 3dc C 1sd I 3d图8 吸附碘蒸气前、后不同元素的XPS图谱Fig.8 XPS spectra of different elements before and after iodine vapor adsorption
由图8a可以看出,在Ag-Cu-MOC-1∶6中,Cu+ 2p3/2、 Cu+ 2p1/2的结合能分别为932.8、 952.8 eV。 在I2@Ag-Cu-MOC-1∶6材料中,Cu2+ 2p3/2、 Cu2+ 2p1/2的结合能分别为934.7、 955.0 eV,分别对应材料中的Cu2O、 CuO,说明Cu2O参与了吸附反应[13-15]。
由图8b可知,Ag 3d5/2、 Ag 3d3/2的结合能分别为368.4、 374.4 eV,表明Ag-Cu-MOC-1∶6的表面有Ag单质,Ag+ 3d5/2、 Ag+ 3d3/2的结合能分别为367.9、 373.9 eV,这是AgI中Ag+的结合能[16-17]。
由图8c可知,Ag-Cu-MOC-1∶6的表面含有羧基,这是水热合成法的副产物,C元素来自原料中的葡萄糖。葡萄糖除生成羧基外,还作为碳源生成单质碳,但在XRD图谱中并没有发现活性炭的衍射特征峰,与3种金属及金属氧化物窄而高的衍射峰相对应的是下面杂乱而窄的小峰,可能是无定型碳。
由图8d可知,吸附碘蒸气后的材料表面为含有AgI(97-002-8230)、 CuI(97-003-0085)和无定型I2 3种物质。I0 3d5/2、 I0 3d3/2在618.8、 630.3 eV有2个独立峰,说明了I2@Ag-Cu-MOC-1∶6中存在碘单质[18]。 但在XRD图谱中发现的是较多弱而杂的峰,而非碘单质那样的明显窄而强的吸收峰,说明材料中的碘单质是以无定型碘的形态存在,侧面证明了吸附后静置以除去表面附着的碘单质这一步骤是成功的。 此外,I- 3d5/2、 I- 3d3/2的结合能分别位于620.6、 632.2 eV,这是AgI中I-的结合能[16]。
对比图8c、 8d可发现,C1s位于286.4、 288.6 eV处结合能分别迁移到了286.0、 288.0 eV,侧面印证了碳元素参与了碘蒸气的吸附反应[19]。对XPS中碘元素的结合能分析说明Ag-Cu-MOC-1∶6对碘蒸气的吸附同时存在物理吸附和化学吸附。
材料内部发生了Husdiecker-Borodin Halogenation反应,化学反应方程式[20]为
2Ag+I2→2AgI,
(8)
2R—COOH+I2→2R—I+CO2+HI,
(9)
Cu2O+2HI→CuI+H2O。
(10)
Ag-Cu-MOC-1∶6对碘蒸气的吸附机理示意图如图9所示。
2.4 TG-DSC热重曲线分析
Ag-Cu-MOC-1∶6的热重分析曲线如图10所示。
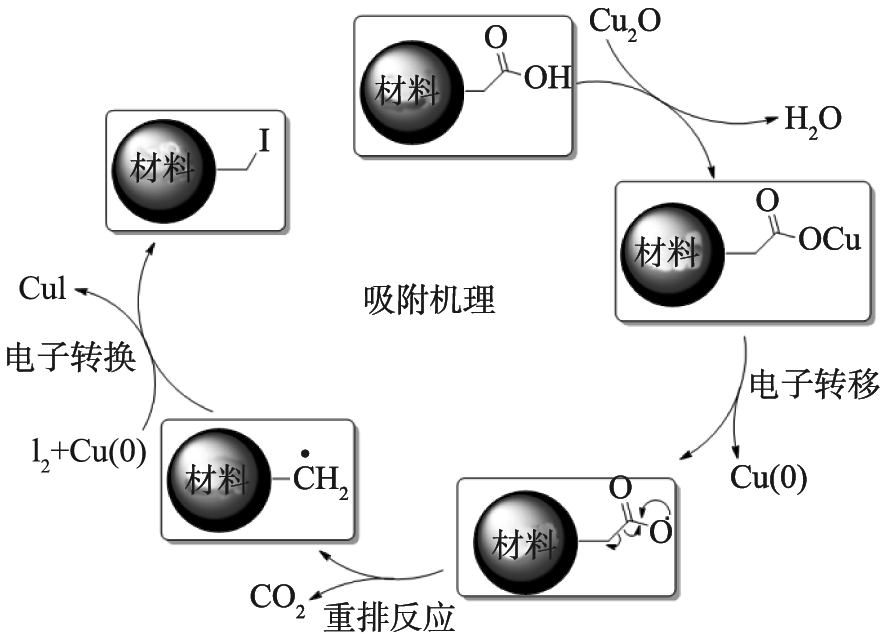
图9 Ag-Cu-MOC-1 ∶6对碘蒸气的吸附机理示意图
Fig.9 Schematic diagram of adsorption mechanism of Ag-Cu-MOC-1 ∶6 on iodine vapor
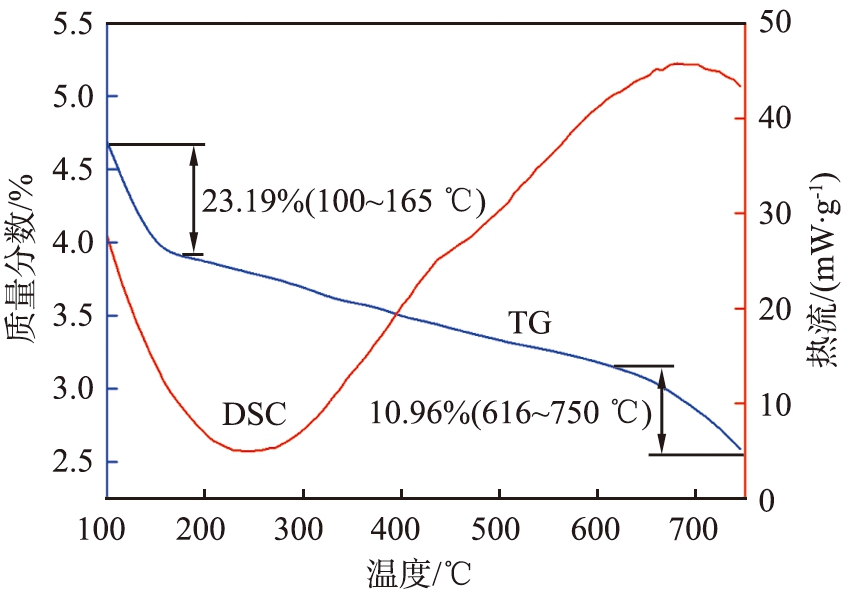
图10 Ag-Cu-MOC-1 ∶6的TG-DSC曲线
Fig.10 TG-DSC profile of Ag-Cu-MOC-1 ∶6
由图10可以看出,Ag-Cu-MOC-1∶6的质量分数随温度的升高而减小。 在整个过程中存在2个放热点,分别位于165、 616 ℃; 在100~165 ℃阶段,材料表面的碳在燃烧,羧基的分解发生在165 ℃之前; 在616~750 ℃阶段,材料内部的碳在燃烧; 在165~616℃之间,材料总质量的减少速度放缓,这是由于Cu2O发生了反应,生成了CuO,使质量略有增加; 温度升高到750 ℃时,材料总质量减少49.46%。 热分解反应方程式为
C+O2→CO2,
(11)
R—COOH→R—H+CO2,
(12)
2CuO→Cu2O+O2。
(13)
2.5 FTIR红外图谱分析
图11为吸附碘蒸气前、后的的FTIR图。
从图11可以看出,531、 618 cm-1分别属于CuO的Cu—O键和Cu2O的Cu—O键的吸收峰[21-22],2 975、 2 887 cm-1则分别为羧基上C![]() O和O—H的吸收峰。595、 1 426 cm-1分别属于CuI的Cu—I键和AgI的Ag—I键的吸收峰[17,23]。与吸附前相比,在I2@Ag-Cu-MOC-1∶6的红外吸收曲线中,羧基的羰基峰和羟基峰明显减弱,并产生了位于549 cm-1处C—I键的吸收峰[24],说明了吸附过程中羧基与碘单质发生了反应。
O和O—H的吸收峰。595、 1 426 cm-1分别属于CuI的Cu—I键和AgI的Ag—I键的吸收峰[17,23]。与吸附前相比,在I2@Ag-Cu-MOC-1∶6的红外吸收曲线中,羧基的羰基峰和羟基峰明显减弱,并产生了位于549 cm-1处C—I键的吸收峰[24],说明了吸附过程中羧基与碘单质发生了反应。
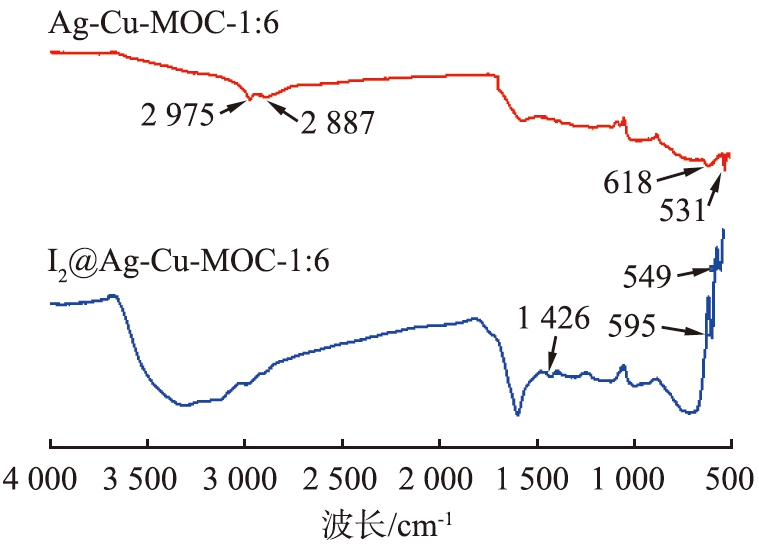
图11 吸附碘蒸气前、后的FTIR红外谱图
Fig.11 FTIR spectra before and after iodine vapor adsorption
2.6 BET分析
Ag-Cu-MOC-1∶6的BET测试结果如表3所示,可以判断Ag-Cu-MOC-1∶6为介孔材料。
表3 Ag-Cu-MOC-1 ∶6的BET测试结果
Tab.3 BET test results of Ag-Cu-MOC-1 ∶6

比表面积/(m2·g-1)孔径/nm比孔容/(cm3·g-1)25.361120.440.104
Ag-Cu-MOC-1∶6的BET曲线如图12所示。由图12a的孔隙宽度分布图可看出,Ag-Cu-MOC-1∶6的孔径随着空隙宽度的增大而增大。由图12b的孔径分布曲线可知,孔径为2.61 nm处有一个峰值,表明材料中同时存在部分微孔结构,为表面没有负载金属和金属氧化物的无序活性炭,可能由于含量较小未达到XRD表征的检测极限而未出现在图谱中。由图12c所示的N2的吸附-脱附等温线可知,Ag-Cu-MOC-1 ∶6属于BDDT分类中的Ⅱ型[25],N2体积与相对压强呈现出反S形状的曲线趋势,符合Langmuir吸附模型,表明材料能够吸附比自身孔径略小的单层分子;从滞留回环可知材料表面存在中孔,说明材料对碘分子具有一定的吸引能力,能有效辅助材料对碘分子的化学吸附和物理吸附,这一点可从Ag-Cu-MOC-1 ∶6对碘蒸气具有1 735.3 mg/g 的吸附容量得以证实[26]。
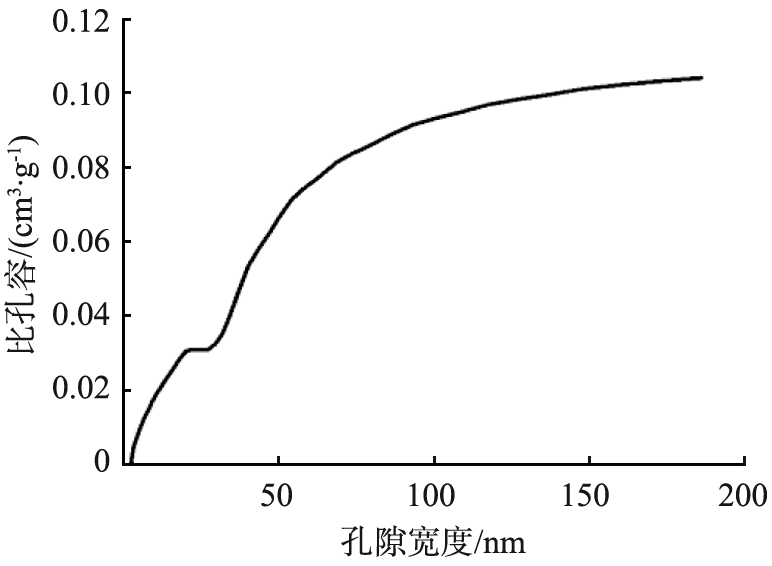
a 孔隙宽度分布图
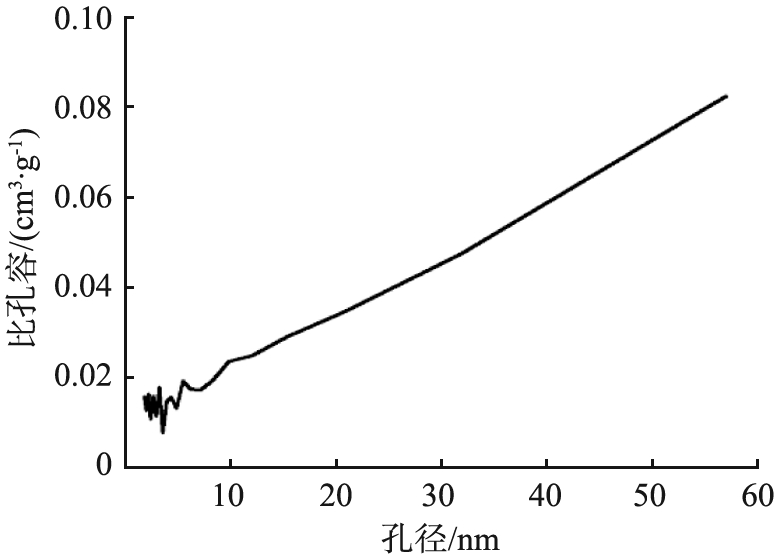
b 孔径分布曲线
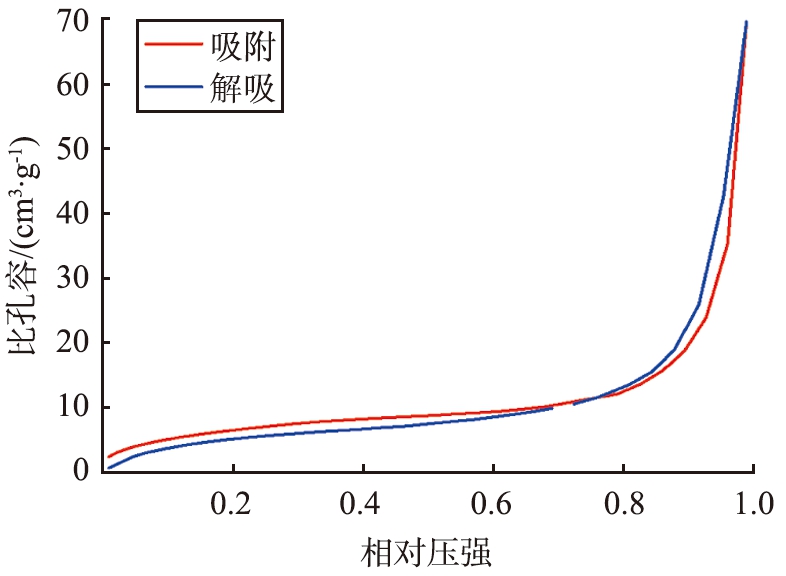
c N2的吸附-脱附等温线
图12 Ag-Cu-MOC-1 ∶6的BET曲线
Fig.12 BET curve of Ag-Cu-MOC-1 ∶6
3 材料的后处理
3.1 吸附-脱附实验
I2@Ag-Cu-MOC-1∶6可以通过无水乙醇脱附其中吸附的碘,从而实现循环使用。吸附-脱附实验流程图如图13所示。按照0.01 g的I2@Ag-Cu-MOC-1 ∶6添加10 mL无水乙醇的比例,加入相应体积的无水乙醇,在25 ℃温度条件下、以180 r/min的转速振荡24 h,滤去溶解有碘单质的无水乙醇溶液,并将脱附完的Ag-Cu-MOC-1∶6置于60 ℃下真空干燥。吸附-脱附实验重复3次,每1组时长为12 h,总时间约为36 h。如图13所示,经历第1次脱附液为深棕色,第2次为深黄色,第3次较为透明,说明已将碘单质(I2)全部脱附出来。

图13 吸附-脱附实验流程图
Fig.13 Flow chart of adsorption-desorption experiment
循环实验结果如图14所示。第1次循环吸附量为1 487.2 mg/g,第2次为1 264.9 mg/g,说明经过2次循环使用后,第2次碘的吸附量能达到原始吸附量的72.9%。
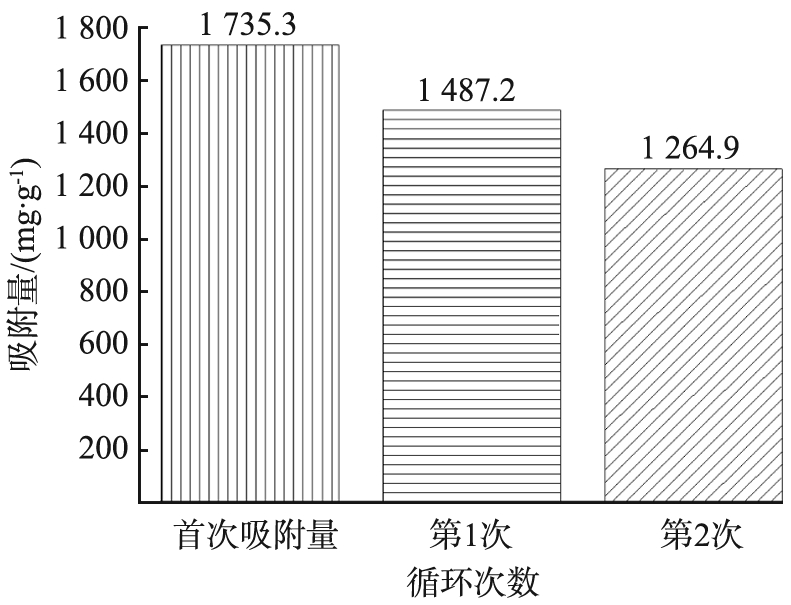
图14 循环实验结果
Fig.14 Cyclic experimental results
3.2 烧结实验
烧结实验[27]步骤为: 取出经3次吸附-脱附并干燥后的Ag-Cu-MOC-1∶6,加入铁粉和氧化硼,3者质量比为1∶2∶5,混合均匀后加热到500 ℃并保持温度4 h,铁粉可与在高温下被氧化生成的微量碘蒸气发生反应,烧结完成后得到黑色玻璃状物。烧结后材料的SEM和EDS图像如图15所示。
由图15a可知,材料表面覆盖了一层致密的玻璃状物质,碘被封闭于其中难以泄露。由图15b可知,材料表面3种元素主要为硼、 碳、 氧,碘元素原子数分数仅有0.54%,证明碘被成功地烧结于材料之中。

a SEM图像

b EDS图像
图15 烧结后材料的SEM和EDS图像
Fig.15 SEM and EDS images of sintered materials
4 结论
采用高温水热合成法制备了含碳、银、铜的纳米金属氧化物复合材料Ag-Cu-MOC;分析了银、铜掺量和时间对碘蒸气吸附量的影响,确定了获得最佳吸附量时银、 铜的物质的量的比值;对制备的材料进行了测试和表征,研究了Ag-Cu-MOC的吸附性能和吸附机理;通过吸附-脱附再生实验和烧结实验研究了吸附碘蒸气后Ag-Cu-MOC的后处理问题。结论如下:
1)当n(Ag) ∶n(Cu)=1∶6时,Ag-Cu-MOC对碘蒸气的吸附量达到最大值1 735.5 mg/g。吸附作用符合一级动力学模型。
2)Ag-Cu-MOC-1∶6为介孔材料,球体颗粒之间的空隙较大,良好的分散性结构有助于对碘蒸气的吸附。吸附过程中同时存在物理吸附和化学吸附,羧基与碘单质发生了反应。Ag-Cu-MOC-1∶6的含量随温度的升高而减小。
4)通过无水乙醇脱附Ag-Cu-MOC-1∶6中吸附的碘,可实现循环利用。经过2次循环使用后,第2次碘的吸附量能达到原始吸附量的72.9%。
5)在完成吸附作用后的Ag-Cu-MOC-1∶6中加入铁粉和氧化硼,完成烧结后得到黑色玻璃状物,碘被封闭于其中难以泄露,最大限度地减小了对环境的污染。
[1]JACOBSON M Z, DELUCCHI M A, BAUER Z A F, et al. 100% clean and renewable wind, water, and sunlight all-sector energy roadmaps for 139 countries of the world [J]. Joule, 2017, 1: 108-121.
[2]杨英. 切尔诺贝利核事故与甲状腺癌[J]. 中华放射医学与防护杂志, 2007, 27(4): 413-415.
[3]MIANOWSKI A, OWCZAREK M, MARECKA A. Surface area of activated carbon determined by the iodine adsorption number[J]. Energy Sources: Part A: Recovery Utilization and Environmental Effects[J]. 2007, 29(9): 839-850.
[4]BANERJEE D, CHEN X, LOBANOV S, et al. Iodine adsorption in metal organic frameworks in presence of humidity[J]. ACS Applied Materials and Interfaces, 2018, 10(13): 10622-10626.
[5]GAO Y, WANG C, WANG Y, et al. A 3D covalent organic framework with exceptionally high iodine capture capability[J]. Chemistry—A European Journal, 2017, 24(3): 585-589.
[6]HASSAN M A M, AGOOL I R, RAOOF L M. Silver oxide nanostructure prepared on porous silicon for optoelectronic application[J]. Applied Nanoscience, 2014, 4(4): 429-447.
[7]GHAMDI A A, HAZMI F, HARTOMY O A, et al. A novel synthesis and optical properties of cuprous oxide nano octahedrons via microwave hydrothermal route[J]. Journal of Sol-Fel Science and Technology, 2012, 63(1): 187-193.
[8]JING H, CHEN X, JIANG X. Controlled synthesis of bismuth oxide microtetrahedrons and cubes by precipitation in alcohol-water systems[J]. Micro and Nano Letters, 2012, 7(4): 357-359.
[9]刘艳娥, 马思琪, 尹荔松. 纳米银粒子的制备及其表征[J]. 世界有色金属, 2019, 21: 256-258.
[10]胡英. 氧化亚铜/微生物纤维素复合膜制备及其结构性能研究[D]. 南昌: 东华大学, 2019.
[11]GUO S D, BAO R, YANG P, et al. Morphology and carbon content of WC-6% Co nanosized composite powders prepared using glucose as carbon source[J]. Transactions of Nonferrous Metals Society of China, 2018, 28(4): 722-728.
[12]彭国文, 丁德馨, 胡南, 等. 化学修饰啤酒酵母菌对铀的吸附特性[J]. 化工学报, 2011, 62(11): 3201-3206.
[13]YU J, DAI G, HUANG B. Fabrication and characterization of visible-light-driven plasmonicphotocatalyst Ag-AgCl-TiO2 nanotube arrays[J]. The Journal of Physical Chemistry C, 2009, 113(37): 16394-16401.
[14]HOPE G A, WOODS R, PARKER G K, et al. A vibrational spectroscopy and XPS investigation of the interactionof hydroxamate reagents on copper oxide minerals[J]. Minerals Engineering, 2010, 23(11/12/13): 952-959.
[15]TARD C, PERRUCHAS S, MARON S, et al. Thermochromic luminescence of sol-gel films based on copper iodide clusters[J]. Chemistry of Materials, 2008, 20(22): 7010-7016.
[16]LU Y M, CHEN J Y, WEY T S. Nano cuprous oxides film prepared by magnetron sputtering[J]. Materials Research Society, 2004, 822(S3): 14.
[17]余芳. 高效吸附碘材料的制备及其吸附性能和机理研究[D]. 西宁: 青海师范大学, 2018.
[18]MOERS H, DILLARD J G, KLEWE-NEBENIUS H, et al. XPS study of iodine released in core melting experiments[J]. Surface and Interface Analysis, 1985, 7(1): 22-28.
[19]MANAKHOV A, KIRYUKHANTSEV-KORNEEV P, MICHL
 EK M, et al. Grafting of carboxyl groups using CO2/C2H4/Ar pulsed plasma: theoretical modeling and XPS derivatization [J].Applied Surface Science, 2018, 435: 1220-1227.
EK M, et al. Grafting of carboxyl groups using CO2/C2H4/Ar pulsed plasma: theoretical modeling and XPS derivatization [J].Applied Surface Science, 2018, 435: 1220-1227.
[20]向绍基, 李华, 孔小林, 等. 一种低碳数全氟烷基碘的制备方法:CN102464569A[P]. 2012-05-23.
[21]FAYAD A M, MARZOUK M A, EL-BATAL F H. Bioactivity behavior of Ag2O or CuO doped in glass systems of Na2O-CaF2-P2O5 and Na2O-CaO-P2O5 and their glass-ceramic derivatives assessed by FTIR, X-ray diffraction and SEM measurements[J]. SN Applied Sciences, 2019, 1(3): 203.
[22]ZHAO S, GAO Y, TAN J, et al. Facile synthesis and antibacterial applications of cuprous oxide/bovine serum albumin hierarchical nanocomposite particles[J]. SN Applied Sciences, 2019, 1(8): 917.
[23]TAVAKOLI F, SALAVATI-NIASARI M, GHANBARI D, et al. Application of glucose as a green capping agent and reductant to fabricate CuI micro/nanostructure[J]. Materials Research Bulletin, 2014, 49: 14-20.
[24]MO Q, LIU F, GAO J, et al. Fluorescent sensing of ascorbic acid based on iodine induced oxidative etching and aggregation of lysozyme-templated silver nanoclusters[J]. Analytica Chimica Acta, 2017, 1003: 49-55.
[25]李鹏. 应用等温吸附曲线研究页岩孔隙结构特征[D]. 成都: 成都理工大学, 2016.
[26]张煜昌. 3D-TiO2-Ag复合材料对水体中碘离子的吸附性能研究[D]. 天津: 天津大学, 2013.
[27]SAVA D F, GARINO T J, NENOFF T M. Iodine confinement into metal-organic frameworks (MOFs): low-temperature sintering glasses to form novel glass composite material (GCM) alternative waste forms[J]. Industrial and Engineering Chemistry Research, 2012, 51(2): 614-620.