核电站产生的放射性碘同位素包括15种,主要来源于重核裂变,其中129I的半衰期极长,扩散到自然环境中会造成永久性污染; 131I的比活度高,会对人体健康和环境造成严重损伤。 2011年日本福岛核电站事故后,在周围水体及空气中检测出了大量的129I和131I。 这些放射性碘能够通过食物链的作用不断的富集,最终进入人体,对健康造成严重危害,甚至诱发癌变[1-2],因此,研究制备对水体中放射性碘具有快速、 高效吸附作用的吸附剂显得尤为重要。
层状双金属氢氧化物(layered double hydroxides,LDHs)又称水滑石材料,由阳离子层板及层板间阴离子组成,由于其层间阴离子具有可交换性,因此经常被用于处理水体中的阴离子污染物。 LDHs经煅烧生成焙烧态层状双金属氢氧化物(CLDH)具有记忆效应,当材料被投加到含有阴离子的溶液中时,阴离子能够涌入材料层板间,从而达到吸附效果[3]。
为了进一步提升水滑石材料对I-的吸附容量及吸附速率,本文中利用银基材料对LDH进行改性,以改善其对I-的吸附效果。Ag和Cu2+能够发生化学反应生成Ag+和Cu+,2种离子都能够和I-反应生成沉淀,从而去除溶液中的I-[4],因此以铜基LDH材料为载体制备银基水滑石吸附剂,并对其进行煅烧,利用CLDH材料的“记忆效应”以及Ag+和Cu+对I-吸附的协同作用,使得材料对I-的吸附效果进一步优化。同时考察了pH值及溶液中干扰离子对该吸附过程的影响,并提出了Ag-CLDH吸附I-的机理。
1 实验
1.1 主要试剂
三水硝酸铜(Cu(NO3)2·3H2O)、九水硝酸铝(Al(NO3)3·9H2O)、无水碳酸钠(Na2CO3)(均为分析纯,成都市科隆化学品有限公司);六水硝酸镁(Mg(NO3)2·6H2O,分析纯,上海沪试实验室器材股份有限公司);硝酸银(AgNO3,分析纯,国药集团化学试剂有限公司);碘化钠(NaI,分析纯,阿拉丁试剂有限公司)。
1.2 方法
1.2.1 样品制备
1)LDH制备
称取2.39 g的Na2CO3,溶解于75 mL去离子水中,配成浓度为0.3 mol/L的Na2CO3溶液;另称取3.85 g的Mg(NO3)2·6H2O、1.82 g的Cu(NO3)2·3H2O、2.81 g的Al(NO3)3·9H2O溶解于另外的75 mL去离子水中,充分溶解后,将其逐滴加入到Na2CO3溶液中并持续搅拌0.5 h,同时调节pH值至9.5,在65 ℃条件下反应24 h,离心后干燥制得合成产,记为Cu-Mg-Al-LDH(LDH)。
2)Ag2O-LDH材料的制备
取一定量的AgNO3溶解于21 mL去离子水中,随后加入0.5 g的LDH样品,利用NH3·H2O调节pH值至9.5,在50 ℃条件下搅拌10 h。反应完成后,离心收集样品,分别用去离子水及乙醇洗涤3次,置于真空烘箱中干燥,制得样品Ag2O-LDH。
3)Ag-CLDH材料的制备
取一定质量的Ag2O-LDH,在400 ℃下煅烧3 h,制得样品Ag-CLDH。
1.2.2 样品表征
采用FEI Quanta 250F场发射环境扫描电子显微镜(SEM,美国FEI公司)对样品的微观形貌进行测试,测试前将样品喷金处理;利用Bruker-AXS D8 Advance型X射线衍射仪(XRD,德国Bruker公司)对样品的物相组成进行测试,扫描角度范围2θ=10 °~70 °; 通过NICOLETIS10型傅里叶红外光谱仪(美国Thermo公司)对样品进行结构分析,样品测试前需压片处理;利用PHI QUANTERA II型X射线光电子能谱仪(XPS,日本Ulvac-Phi公司)对材料的元素组成及价态进行分析,样品测试前需压片处理。
1.2.3 吸附实验
取1 mL待测溶液于比色皿中,测其波长位于227 nm处的吸光度,根据标准曲线求得溶液中I-的质量浓度。 Ag-CLDH对I-的吸附平衡容量qe(g/kg)为:
qe=(ρ0-ρe)V/m,
(1)
式中:ρ0为I-初始质量浓度,mg/L;ρe为I-平衡质量浓度,mg/L;V为I-溶液体积,L;m为吸附剂质量,g。
在298 K条件下配置5份20 mL、I-质量浓度为240 mg/L的溶液,利用盐酸和氨水调节pH值分别为3、 5、 7、 9、 11,分别加入0.02 g Ag-CLDH吸附6 h,通过分光光度法算出该材料在不同pH条件下对I-的吸附效率及吸附容量。
在298 K条件下配置4份20 mL、I-质量浓度为240 mg/L的溶液,其中1份作为空白对照,其余3份分别含有与I-相同质量浓度的![]() 分别加入0.02 g Ag-CLDH吸附6 h,利用分光光度法计算该材料在存在不同干扰离子的条件下对I-的吸附效率及吸附容量。
分别加入0.02 g Ag-CLDH吸附6 h,利用分光光度法计算该材料在存在不同干扰离子的条件下对I-的吸附效率及吸附容量。
2 结果与讨论
2.1 样品的微观形貌与结构表征
Ag2O-LDH和Ag-CLDH的扫描电镜(SEM)图像如图1所示。从图中可以看出,煅烧前后2种样品的微观形貌变化不大,均呈现为纳米片结构,并保持了很好的LDH层状结构。

a Ag2O-LDH

b Ag-CLDH
图1 煅烧前后样品的SEM图像
Fig.1 SEM images of samples before and after calcined
为了进一步了解样品的元素组成,对Ag-CLDH进行能谱(EDS)测试,测试发现各元素Mg、 Al、 Cu、 Ag的质量分数分别为38.29%、 31.85%、 25.71%、 4.15%,表明银成功地负载在材料中。
为了掌握对样品的晶体结构变化,对材料进行了XRD测试,结果见图2。
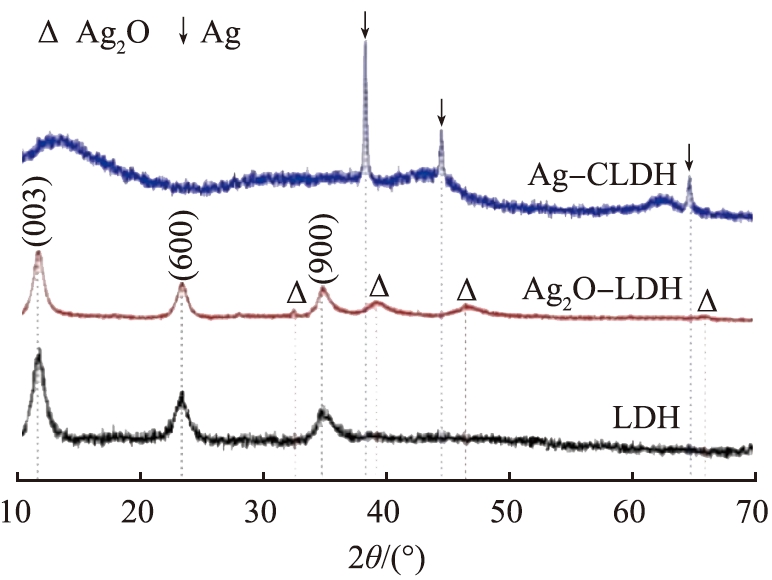
图2 LDH及其Ag改性材料的XRD图谱
Fig.2 XRD patterns of LDH and its Ag-modified materials
由图可知,Ag2O-LDH在低角度保持了较强的衍射峰,而在高角度处图像平缓,呈现出LDH材料的典型层状结构[5],其在2θ为11.6 °、 22.3 °、 34.9 °处的衍射峰分别对应LDH的(003)、 (006)、 (009)晶面,表明负载银并没有改变LDH本身的结构。 2θ为32.5 °、 39.1 °、 46.4 °、 65.9 °处的衍射峰为Ag2O的特征峰(JCPDS 42-0874),表明材料中的银以Ag2O的形式存在,成功制得了Ag2O-LDH中间体材料。对该材料进行煅烧,LDH的特征峰消失,表明样品层板上的金属阳离子由氢氧化物相转变为氧化物相,LDH结构被破坏,但样品层板保持完好;同时在2θ为38.3 °、 44.4 °、 64.7 °处观测到单质银的特征衍射峰(JCPDS 04-0783),分别对应Ag的(111)、 (200)、 (220)晶面,且Ag2O的特征峰消失,表明Ag2O在高温下分解,并以单质银的形式负载在材料中。XRD测试结果表明本研究成功制得Ag-CLDH材料。
为了解各样品的基团变化情况,对LDH、 Ag2O-LDH和Ag-CLDH 3种材料进行红外测试,FT-IR图谱见图3。
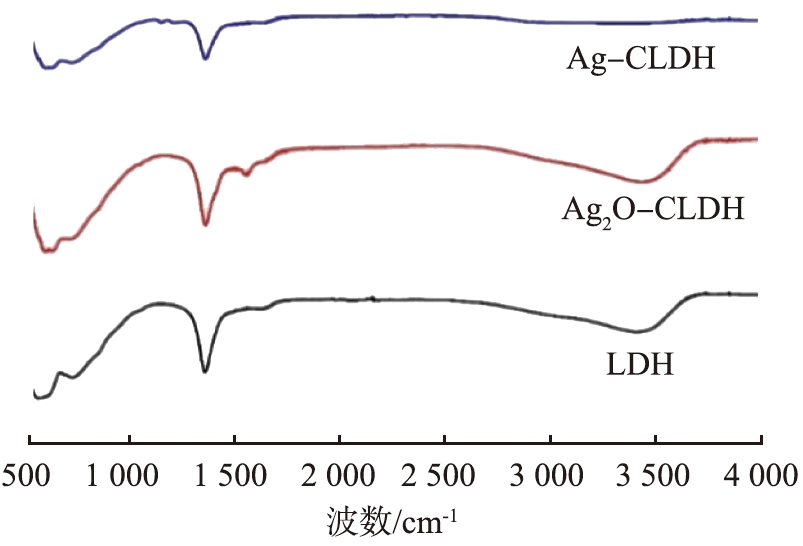
图3 LDH及Ag改性材料的FT-IR图谱
Fig.3 FT-IR spectra of LDH and Ag-modified materials
LDH和Ag2O-LDH在3 400 cm-1处附近出现的较宽的吸收峰是由于层板间的羟基及水分子的O—H拉伸引起的,而Ag-CLDH的图谱则不存在该吸收峰,表明煅烧使得样品失去了层间羟基及水分子。LDH在1 630 cm-1附近的吸收峰是由于水分子的H—O—H振动引起的,1 360 cm-1处的吸收峰则可归因于层板间碳酸盐的不对称拉伸[6-7],Ag2O-LDH的图谱与LDH形状及强度几乎相同,表明Ag2O的负载并未破坏LDH的结构。Ag-CLDH在1 360、 1 630 cm-1处的吸收峰减弱,表明材料失去了大部分的层间离子及层间水。525~1 000 cm-1内的谱带则归因于金属氢键或金属氧键[7]。 结合该FT-IR及前文XRD结果可知,银的负载并未破坏LDH及CLDH的结构,表明本研究成功制备了Ag-CLDH材料。
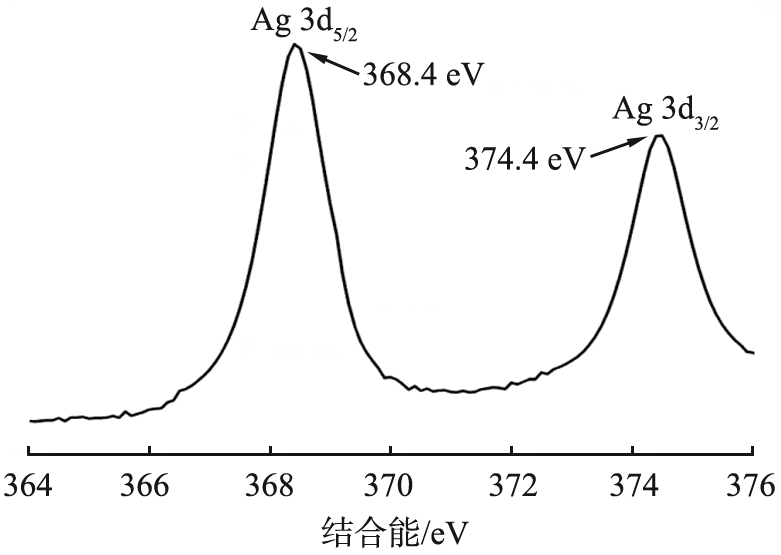
为了研究对样品中的元素组成和价态,对Ag-CLDH进行了XPS分析,分析结果如图4所示。
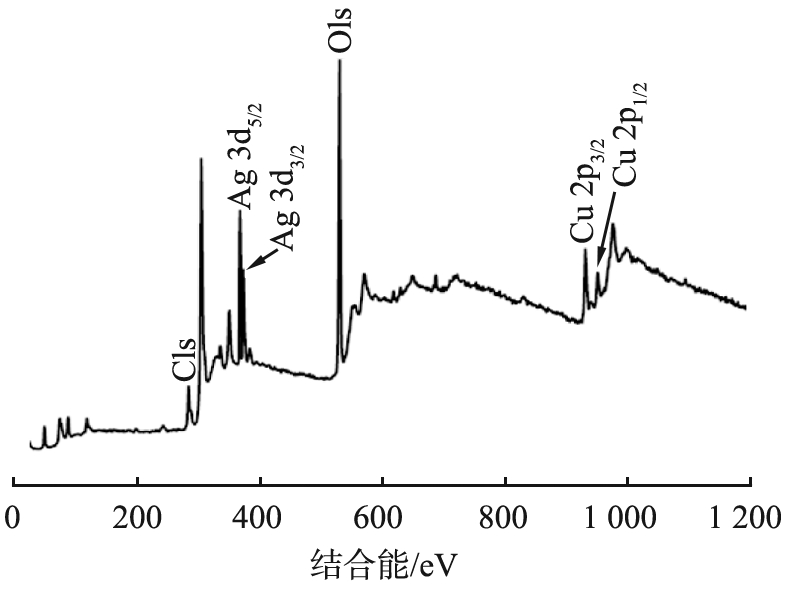
a 全谱扫描图
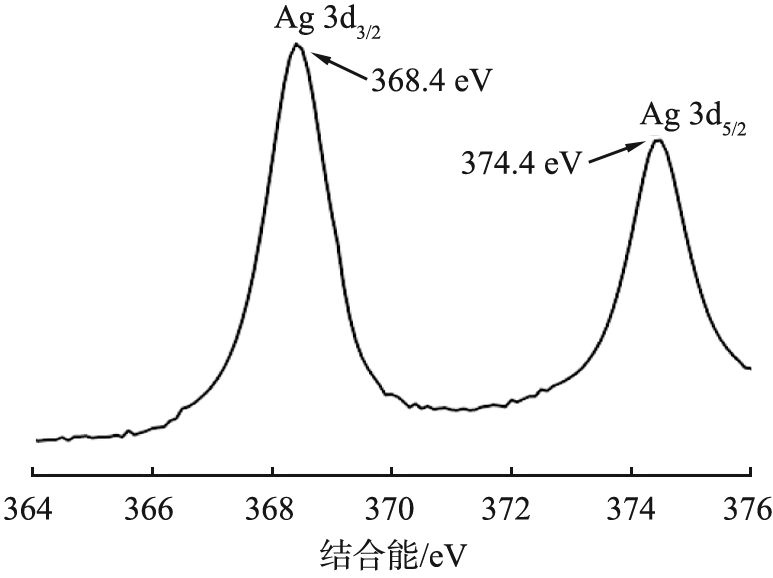
b Ag 3d
c Cu 2p
图4 Ag-CLDH的XPS谱图
Fig.4 XPS spectra of Ag-CLDH
图4a是Ag-CLDH的XPS全谱图,其中存在Ag的谱峰。图4b是样品中Ag 3d的谱图,结合能为368.4、 374.4 eV处的峰分别对应单质Ag的Ag 3d5/2和Ag 3d3/2的特征峰[8-9],表明Ag已经以单质的形式成功负载在材料中。图4c是样品Cu 2p的XPS谱图,934.4 eV的主峰可以分为结合能为934.2、 935.6 eV的峰,对应于Cu 2p3/2的特征峰,954.4 eV的主峰则对应于Cu 2p1/2的特征峰[10-11],以上结果表明样品中存在Cu2+。同时940~945、 962~966 eV之间的卫星峰是Cu2+的另一个XPS特征光谱[12],说明铜以2价阳离子的形式存在于样品中。
2.2 溶液参数对吸附性能的影响
2.2.1 pH值对Ag-CLDH吸附I-的影响
考察了在不同pH值条件下Ag-CLDH对I-的吸附效率及吸附容量,结果如图5所示。从图中可发现,不同的pH值对Ag-CLDH的影响不大。当溶液呈中性时,材料对I-的吸附容量为166.47 g/kg,吸附效率为69.36%。而较低的pH值会抑制Ag-CLDH对I-的吸附,这是由于在酸性条件下LDH结构发生溶解,无法通过“记忆效应”吸附I-,因此造成了材料对I-的吸附效率有所下降。而当溶液的pH值较高时,吸附剂维持了对I-较高的去除效率及吸附容量,主要是由于此时样品中的Cu2O会被氧化为Cu(OH)2,而Cu(OH)2不稳定,会被分解为CuO,样品中的Ag会和CuO及Cu(OH)2反应生成Ag2O[13],Ag2O容易与I-反应生成AgI,提升了材料的吸附效率,以上过程反应见式1—3。溶液中的OH-会涌入层板间,占据I-的空间,阻碍了样品对I-的吸附,此时样品的吸附容量与中性时较为接近,维持在165 g/kg左右。从上述实验结果可知,Ag-CLDH能在pH值为3~11的范围内对I-都能维持良好的吸附效果。
Cu2O+2OH-+H2O![]() 2Cu(OH)2+2e-,
2Cu(OH)2+2e-,
(1)
Cu(OH)2+Ag+2I-![]() CuI+AgI+2OH-,
CuI+AgI+2OH-,
(2)
CuO+H2O+Ag+2I-![]() CuI+AgI+2OH-。
CuI+AgI+2OH-。
(3)
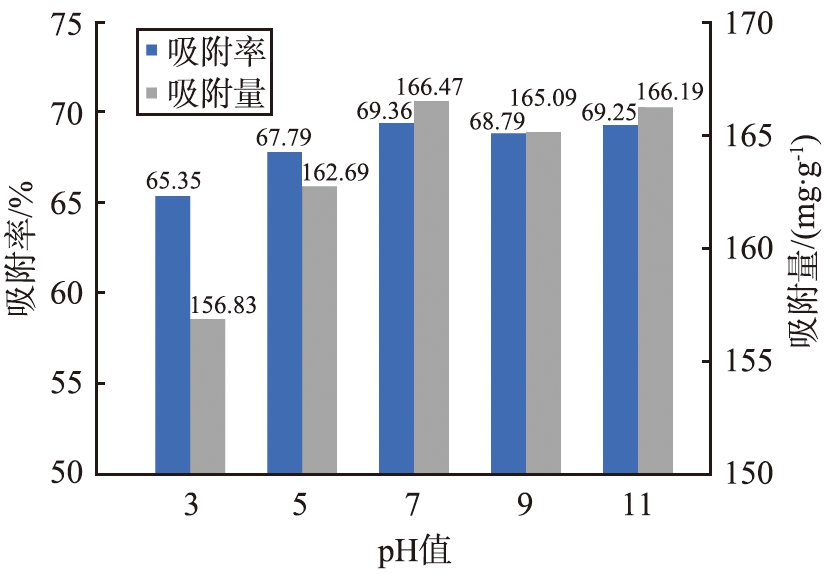
图5 pH值对Ag-CLDH吸附I-的影响
Fig.5 Influence of pH value on Ag-CLDH adsorption of I-
2.2.2 干扰离子对Ag-CLDH吸附I-的影响
考察了有干扰离子存在的情况下,Ag-CLDH对I-的吸附性能,结果如图6所示。
从图中可知,当溶液中存在![]() 和
和![]() 时,Ag-CLDH对I-的吸附容量分别从163.44 g/kg变为158.74、 137.64、 147.53 g/kg。该结果表明,溶液中的Cl-对材料吸附I-会产生略微的抑制作用,虽然Cl-能够和Ag+反应生成AgCl沉淀,影响材料对I-的吸附效率;但是,由于Ag+和I-反应的吉布斯自由能小于Ag+和Cl-反应,因此Cl-的存在对Ag-CLDH吸附I-影响较小[14]。当溶液中存在
时,Ag-CLDH对I-的吸附容量分别从163.44 g/kg变为158.74、 137.64、 147.53 g/kg。该结果表明,溶液中的Cl-对材料吸附I-会产生略微的抑制作用,虽然Cl-能够和Ag+反应生成AgCl沉淀,影响材料对I-的吸附效率;但是,由于Ag+和I-反应的吉布斯自由能小于Ag+和Cl-反应,因此Cl-的存在对Ag-CLDH吸附I-影响较小[14]。当溶液中存在![]() 和
和![]() 时,会对材料吸附I-产生一定的抑制效果,这一结果可以归因于吸附剂在捕获I-过程中生成络合物[15],从而对去除I-产生了影响。尽管溶液中存在其他阴离子时会对吸附过程产生一定的影响,但是总体上看,Ag-CLDH对I-依然能够保持较高的去除效率,表明该材料对I-的吸附有较高的选择性,能够用于复杂水体中I-的去除。
时,会对材料吸附I-产生一定的抑制效果,这一结果可以归因于吸附剂在捕获I-过程中生成络合物[15],从而对去除I-产生了影响。尽管溶液中存在其他阴离子时会对吸附过程产生一定的影响,但是总体上看,Ag-CLDH对I-依然能够保持较高的去除效率,表明该材料对I-的吸附有较高的选择性,能够用于复杂水体中I-的去除。
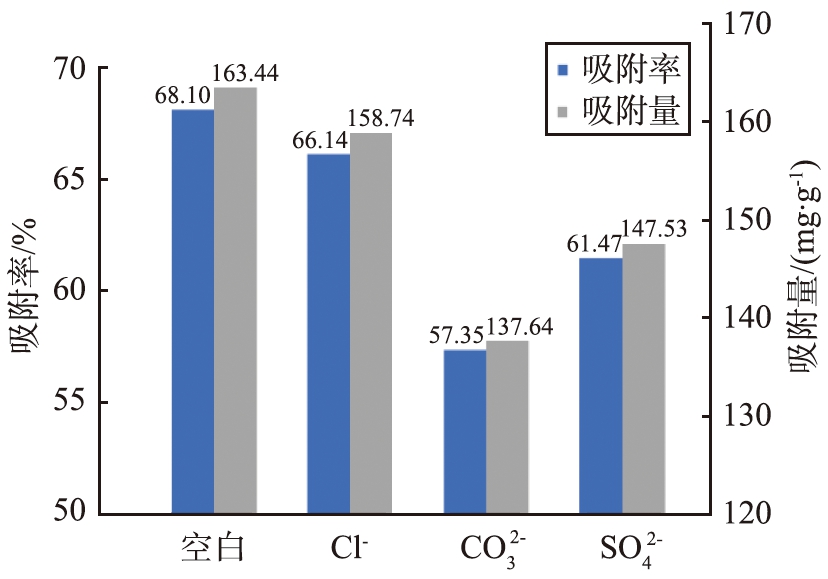
图6 干扰离子对Ag-CLDH吸附I-的影响
Fig.6 Influence of interfering ions on Ag-CLDH adsorption of I-
2.3 吸附机理分析
为了探究Ag-CLDH对I-的吸附机理,首先对吸附I-前后的材料进行了XRD测试,结果见图7。
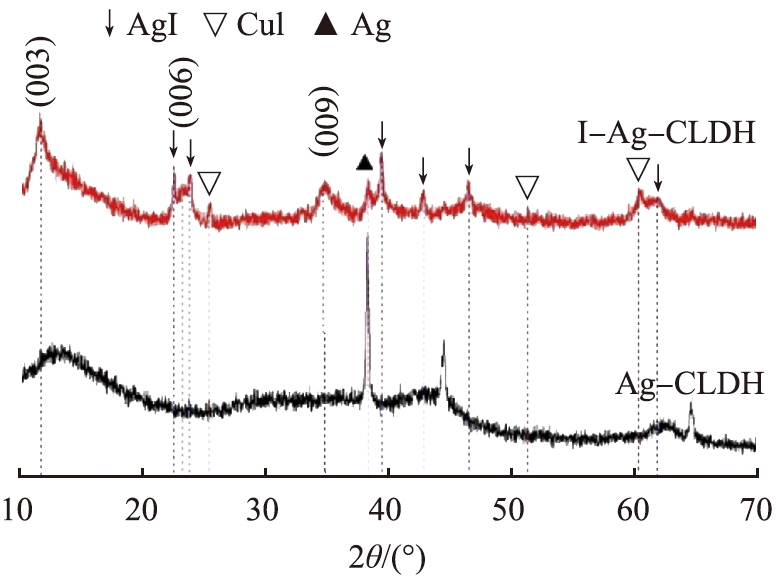
图7 Ag-CLDH吸附I-前后的XRD图
Fig.7 XRD pattern of Ag-CLDH beforeand after adsorption of I-
对图7分析可知,Ag-CLDH在吸附I-后,出现了LDH的衍射峰,在2θ为11.8 °、 23.4 °、 34.6 °处的衍射峰分别对应着LDH的(003)、 (006)、 (009)晶面,表明在吸附过程中I-进入了Ag-CLDH的层板间,使其恢复了LDH的层状结构,即Ag-CLDH能够通过“记忆效应”吸附部分I-。 与Ag-CLDH相比,I-Ag-CLDH图谱中Ag的特征峰强度减弱或消失,而在2θ为22.6 °、 23.8 °、 39.4 °、 42.8 °、 46.5 °、 61.9 °处观测到AgI的特征峰(JCPDS 09-0374),同时还在2θ为25.5 °、 51.4 °和60.5 °处出现了CuI的衍射峰(JCPDS 06-0623)。该结果表明Ag-CLDH中的Cu和Ag都参与了对I-的吸附过程。
为了进一步探究Ag-CLDH对溶液中I-的吸附过程,以及吸附I-后的表面元素的种类与价态,对I-Ag-CLDH进行了XPS表征测试分析,测试结果如图8所示。
图8a是I-Ag-CLDH的XPS全谱图,可以发现材料中含有碘元素,表明材料成功从溶液中吸附了I-。
图8b是I-Ag-CLDH的Ag 3d XPS图,368.1、 374.1 eV的主峰可以分为结合能分别为367.2和368.1、 373.2和374.1 eV的峰。其中367.2和373.2 eV分别是Ag+的Ag 3d5/2和Ag 3d3/2的特征峰,368.1和374.1 eV则是单质Ag的Ag 3d5/2和Ag 3d3/2特征峰[8-9],表明单质Ag在吸附过程中形成了Ag+。
图8c是材料的Cu 2p XPS图,932.8、 952.7 eV处的峰可分别分为结合能为932.5、 933.5、 935.1、 952.5、 954.8 eV的特征峰,932.5、 952.5 eV分别属于Cu+的Cu 2p3/2和Cu 2p1/2特征峰[10-11],与吸附I-前相比,I-Ag-CLDH中有Cu+的存在,根据XRD结果推测Cu+以CuI的形式存在。 933.5、 935.1、 952.5 eV的峰属于Cu2+的Cu 2p3/2和Cu 2p1/2[10-11],同时943、 962 eV的卫星峰也属于Cu2+[12]。一方面是由于样品中存在CuO,另一方面也表明Ag-CLDH吸附I-后通过“记忆效应”恢复了LDH的层状结构,Cu以Cu2+的形式构成了LDH的层板。图8d为I 3d XPS图,619.2 eV的主峰可以分为618.5、 619、 619.7 eV的特征峰,其中619 eV和特征峰属于AgI的I 3d峰,619.7、 630.7 eV处的峰则属于CuI的I 3d特征峰[16],表明Ag-CLDH吸附I-后的主要产物为AgI和CuI,与XRD测试结果一致。618.5 eV处的峰则属于I-的I 3d5/2,表明吸附剂成功通过“记忆效应”将I-吸附在层板间。根据测试结果推断,可能的反应方程式如下所示:
2Ag+2CuO![]() Ag2O+Cu2O,
Ag2O+Cu2O,
(4)
Ag2O+2I-+H2O![]() 2AgI+2OH-,
2AgI+2OH-,
(5)
Cu2O+2I-+H2O![]() 2CuI+2OH-。
2CuI+2OH-。
(6)
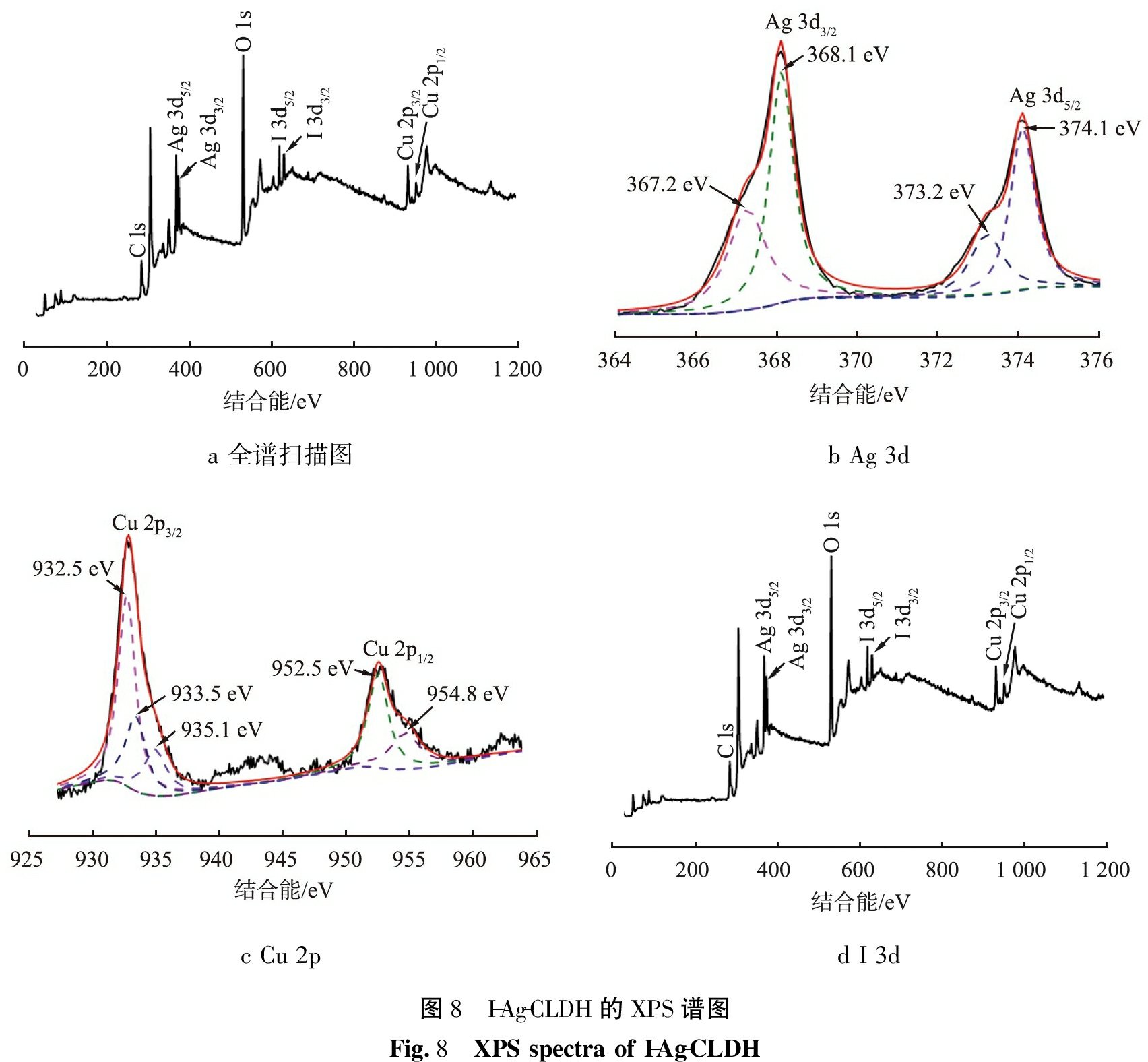
a 全谱扫描图b Ag 3dc Cu 2pd I 3d图8 I-Ag-CLDH的XPS谱图Fig.8 XPS spectra of I-Ag-CLDH
3 结论
1)采用浸渍法合成了Ag2O-LDH中间体材料,再对其进行煅烧制得了对碘离子吸附性能优异的Ag-CLDH吸附材料。
2)在溶液pH为3~11的范围内,Ag-CLDH对I-都表现出良好的吸附效果。
3)溶液中的干扰性阴离子会对Ag-CLDH吸附I-产生抑制,但影响不大,表明该材料能够用于复杂水体中I-的吸附。
4)由于Ag-CLDH材料拥有结构“记忆效应”,能够将I-有效地吸附在层板之间,同时,材料中单质Ag能够与其中的CuO反应生成Ag+和Cu+,随后与I-反应生成AgI及CuI,从而达到捕获I-的目的,使得吸附剂对I-的吸附性能进一步提升。
[1]高灿, 张慧芳, 刘海宁, 等. 溴、碘离子吸附研究进展[J]. 环境化学,2014, 33(11):1907-1911.
[2]WANG C, WANG Y, SONG X, et al. A 3D covalent organic framework with exceptionally high iodine capture capability[J]. Chemistry-A European Journal, 2017, 24(3): 585-589.
[3]WILLIAMS G R, O’HARE D J. Towards understanding, control andapplication of layered double hydroxide chemistry[J]. J Mater Chem, 2006, 16:3065-3074.
[4]MAO P, LIU Y, LIU X, et al. Bimetallic AgCu/Cu2O hybrid for the synergetic adsorption of iodide from solution[J]. Chemosphere, 2017, 180: 317-325.
[5]THOMAS G S, RADHA A V, KAMATH P V, et al. Thermally induced polytype transformations among the layered double hydroxides(LDHs) of Mg and Zn with Al[J]. The Journal of Physical Chemistry B, 2006, 110(25): 12365-12371.
[6]GUO Y, ZHU Z, QIU Y, et al. Synthesis of mesoporous Cu/Mg/Fe layered double hydroxide and its adsorption performance for arsenate in aqueous solutions[J]. Journal of Environmental Sciences, 2013, 25(5): 944-953.
[7]JI H, WU W, LI F, et al. Enhanced adsorption of bromate from aqueous solutions on ordered mesoporous Mg-Al layered double hydroxides (LDHs)[J]. Journal of Hazardous Materials, 2017, 334: 212-222.
[8]STRYDOM C A, VAN STADEN J F, STRYDOM H J. An XPS investigation of silver bromide-coated ion-selective electrodes[J]. Electroanalysis, 1991, 3(8): 815-821.
[9]CHEN F, YANG Q, NIU C, et al. Enhanced visible light photocatalytic activity and mechanism of ZnSn(OH)6 nanocubes modified with AgI nanoparticles[J]. Catalysis Communications, 2016, 73: 1-6.
[10]AI Z, ZHANG L, LEE S, et al. Interfacial hydrothermal synthesis of Cu@Cu2O core-shell microspheres with enhanced visible-light-driven photocatalytic activity[J]. The Journal of Physical Chemistry C, 2009, 113(49): 20896-20902.
[11]PEDERSEN D B, WANG S, LIANG S H. Charge-transfer-driven diffusion processes in Cu@Cu-oxide core-shell nanoparticles: oxidation of 3.0±0.3 nm diameter copper nanoparticles [J]. The Journal of Physical Chemistry C, 2008, 112(24): 8819-8826.
[12]WU C, YIN M, O’BRIEN S, et al. Quantitative analysis of copper oxide nanoparticle composition and structure by X-ray photoelectron spectroscopy[J]. Chemistry of Materials, 2006, 18(25): 6054-6058.
[13]ZHANG Z, SONG R, YU Z, et al. Crystal-plane effect of Cu2O templates on compositions, structures and catalytic performance of Ag/Cu2O nanocomposites[J]. Crystengcomm, 2019, 21(12): 2002-2008.
[14]YANG D, LIU H, LIU L, et al. Silver oxide nanocrystals anchored on titanate nanotubes and nanofibers: promising candidates for entrapment of radioactive iodine anions[J]. Nanoscale, 2013, 5(22): 11011-11018.
[15]TANG Y, GUAN X, WANG J, et al. Fluoride adsorption onto granular ferric hydroxide: effects of ionic strength, pH, surface loading, and major co-existing anions[J]. Journal of Hazardous Materials, 2009, 171(1/2/3): 774-779.
[16]CHOI J, REDDY D A, ISLAM M J, et al.Green synthesis of the reduced graphene oxide-CuI quasi-shell-core nanocomposite: A highly efficient and stable solar-light-induced catalyst for organic dye degradation in water[J]. Applied Surface Science, 2015, 358: 159-167.