随着我国经济的快速发展,污水排放量也在随之急剧增加,尤其是工业生产活动排放的废水给环境造成了巨大破坏,因此,水环境污染治理与修复是我国当前环境保护的重要工作之一。环保专家指出,水污染治理生物技术与关键设备将排在首位,新材料是未来水处理支柱型产业[1]。目前,天然及其改性矿物材料[2]、碳材料[3]、农林固体废物[4]、纳米材料[5]等已广泛应用于实际废水处理工程和应用基础研究中,这些新型功能材料将在水污染防治中发挥越来越大的作用。
膨润土是一种层状硅酸盐黏土矿物,也称为斑脱岩、皂土或膨土岩,主要由蒙脱石矿物组成,是硅、铝、铁和镁的氧化物[2]。膨润土具有孔隙率高、吸附性好以及阳离子交换能力强等特点。
天然膨润土易吸水膨胀,难以从水中去除,且难以均匀分散,不易实现固液分离,从而形成二次污染,因而,应从膨润土的特性出发,有针对性地对其进行修饰,最终制备得到环境友好且具有优异吸附性能的复合材料[6-15]。 本课题组采用表面活性剂、聚合阳离子等改性剂制备了有机插层、无机柱撑以及复合改性膨润土,研究了对水中有机污染物、磷酸盐和重金属的去除作用,取得了良好的效果[9-13]。
膨润土及其改性产物仍然是粉体材料,应用于水处理中仍需复杂的工艺进行回收,因此,将粉体材料制备为颗粒状或赋予磁性是解决这一问题的有效途径[16-19]。鉴于此,本文中以商品膨润土为原料,通过海藻酸钙的交联作用,将其与含铁磁性纳米粒子相结合,制备易于磁分离的磁性膨润土微球,并制备海藻酸钙交联的膨润土微球做为比较,以印染废水中常见的碱性染料为代表性污染物,研究膨润土及其磁性微球的吸附性能。
1 实验
1.1 原料与试剂
膨润土(医药级,山东省寿光中联精细蒙脱石有限公司);四氧化三铁(Fe3O4,分析纯,天津市大茂化学试剂厂);氯化钙(分析纯,天津市科密欧化学试剂有限公司);海藻酸钠(分析纯,上海麦克林生化科技有限公司);碱性品蓝或碱性品红(工业品,天津市染料化学二厂)。
1.2 微球制备
将2.0 g的海藻酸钠,0.15 g的Fe3O4和3.0 g的膨润土粉末加入到100 mL去离子水中,水浴超声6 h,以获得均匀的分散液。将分散液通过BT100-2J蠕动泵(保定兰格恒流泵有限公司)缓慢滴加到质量分数为3%的CaCl2溶液中,形成磁性膨润土微球。 将微球在溶液中浸泡24 h后,去离子水洗涤3次后磁铁收集,在温度为60 ℃的条件下,真空干燥24 h,最终得到磁性膨润土微球。
利用同样的方法,但在合成步骤中不添加Fe3O4,合成膨润土微球。
1.3 样品表征测试
采用德国Bruker公司的D8 Advance型X-射线衍射仪(XRD,2θ=4 °~70 °,v=0.03(°)/s)对磁性膨润土微球和膨润土微球进行物相探究;使用德国Bruker公司的Vertex 70型红外光谱仪(FTIR)对样品的表面官能团进行分析,光谱范围为400~4 000 cm-1;使用日本Hitachi公司的S4800型扫描电镜(SEM)观察材料的微观形貌和元素分布。
1.4 吸附实验
在50 mL离心管中,加入一定量的磁性膨润土微球或膨润土微球吸附剂、20 mL碱性品蓝或碱性品红溶液,置于恒温振荡箱内进行吸附实验(T=298 K;v=200 r/min)。反应结束后,使用0.45 μm针头过滤器对混合液过滤后,用紫外分光度法测定上清液中染料的剩余质量浓度。吸附率R和吸附量qe计算公式为
(1)
(2)
式中: ρ0为碱性品蓝或碱性品红的初始质量浓度,mg/L;ρe为染料吸附后的质量浓度,mg/L;m为吸附剂的质量,g;V为溶液体积,L。
根据预实验结果,碱性品蓝和碱性品红溶液的质量浓度分别设为500、100 mg/L;在吸附剂用量影响实验中,在20 mL染料溶液中添加不同量的吸附剂(0.01~0.15 g),振荡240 min;在溶液初始pH值影响实验中,用体积分数为5%的HCl或0.1 mol/L的NaOH溶液调节染料溶液pH为2~12,然后加入不同质量的吸附剂(对碱性品蓝的微球用量为0.08 g,对碱性品红的微球用量为0.10 g),振荡直至吸附平衡;为研究吸附时间的影响,在染料溶液中加入一定量的吸附剂,振荡时间为10~600 min;在吸附等温线实验中,在质量浓度为10~400 mg/L的碱性品红或100~1 000 mg/L的碱性品蓝中加入一定量的吸附剂,振荡至反应达到平衡。
2 结果与讨论
2.1 结构表征
图1和图2分别为膨润土微球和磁性膨润土微球表征图。如图所示,商品膨润土为白色粉末状,粒径分布在0.2~ 1 μm[20]。利用海藻酸钠与CaCl2生成海藻酸钙的反应过程中的交联作用,将Fe3O4-膨润土和膨润土制备成微球。相机拍摄的膨润土微球为淡黄色,磁性膨润土微球呈现黑色,二者直径均约为1 mm左右,整体成不规则球体。在SEM图像中,二者表面略微粗糙,且在磁性膨润土微球的表面有球状的Fe3O4存在。同时,通过EDS的元素分布图说明,Si、Al和Ca元素在磁性膨润土微球和膨润土微球的表面均匀分布。相比膨润土微球,磁性膨润土微球的元素分布图中有铁元素的分布,其分布密集处呈现圆形,这与Fe3O4的形貌相对应。
图3为2种微球的XRD与FTIR谱图。钙基膨润土的(001)晶面衍射峰通常出现在2θ为6 °左右的位置[2,9,13]。 如图3a所示,磁性膨润土微球和膨润土微球的(001)晶面衍射峰出现在2θ=5.95 °,说明膨润土的层间阳离子主要为Ca2+。通过对比磁性膨润土微球和膨润土微球的XRD衍射峰,发现磁性膨润土微球在2θ=30.5 °、35.7 °、43.5 °、57.2 °和62.9 °处的特征衍射峰与Fe3O4的(220)、(311)、(400)、(511)和(440)晶面相对应[16-17],说明膨润土与Fe3O4成功复合。除此之外,在2θ=19.8 °、21.0 °、22.1 °和26.9 °处出现了海藻酸钙的特征峰,因此,本研究中是利用海藻酸钙生成过程中的交联作用,将Fe3O4-膨润土或膨润土与海藻酸钙复合在一起,从而形成微球。
如图3b所示,磁性膨润土微球和膨润土微球的FTIR谱图在1 604、3 366 cm-1处的吸收峰归属于水分子中O—H基团。 在1 004 cm-1处表现出典型的(Si, Ca)—OH拉伸振动峰。 在1 420 cm-1处强烈的振动峰归属于海藻酸钙的羧基基团。 相比膨润土微球,磁性膨润土微球在696.2 cm-1处附近的出现了Fe—O的吸收峰,说明Fe3O4与膨润土成功地进行了复合,同时也证明了XRD图谱中所得到的结论。
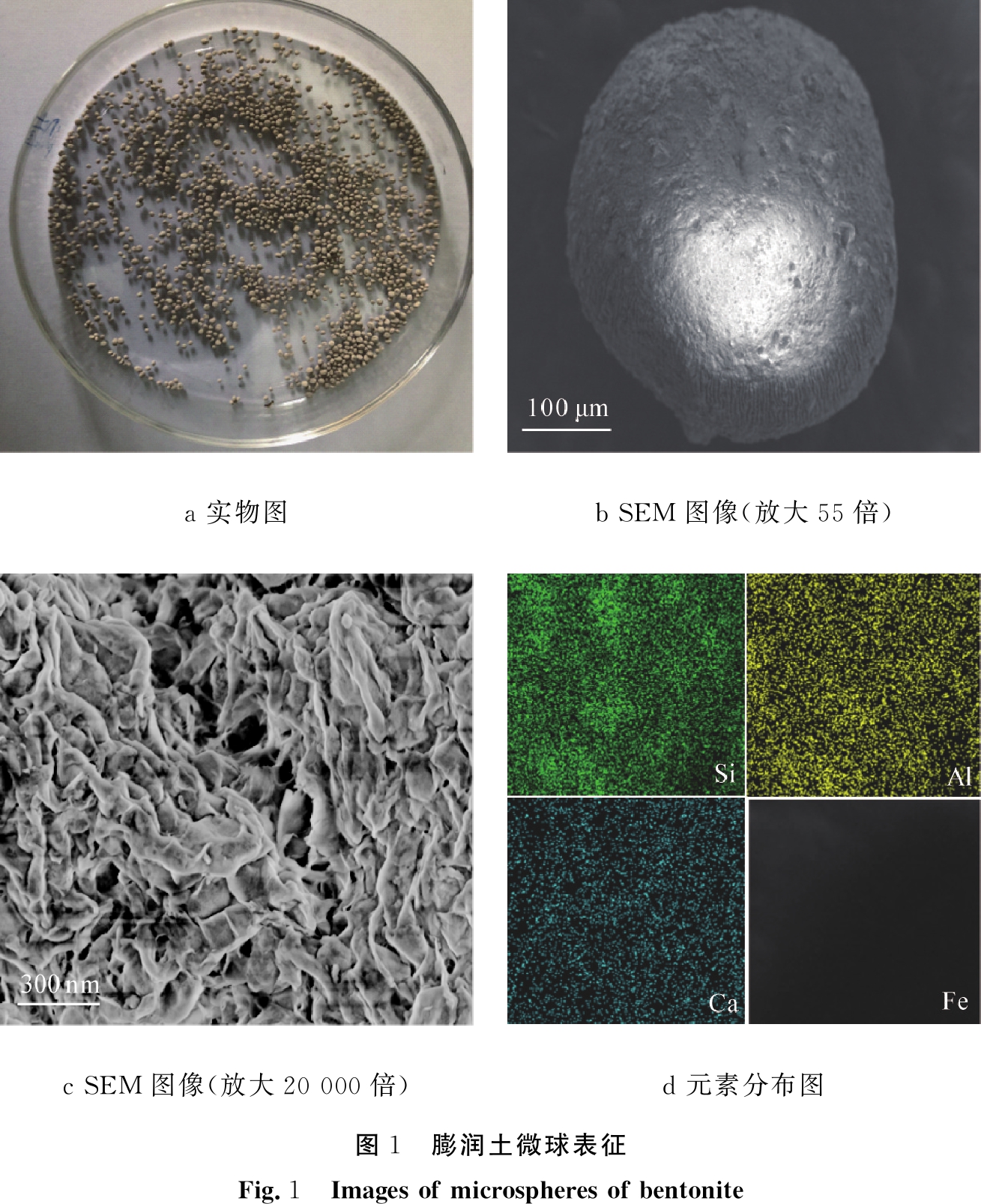
a 实物图b SEM图像(放大55倍)c SEM图像(放大20 000倍)d 元素分布图图1 膨润土微球表征Fig.1 Images of microspheres of bentonite
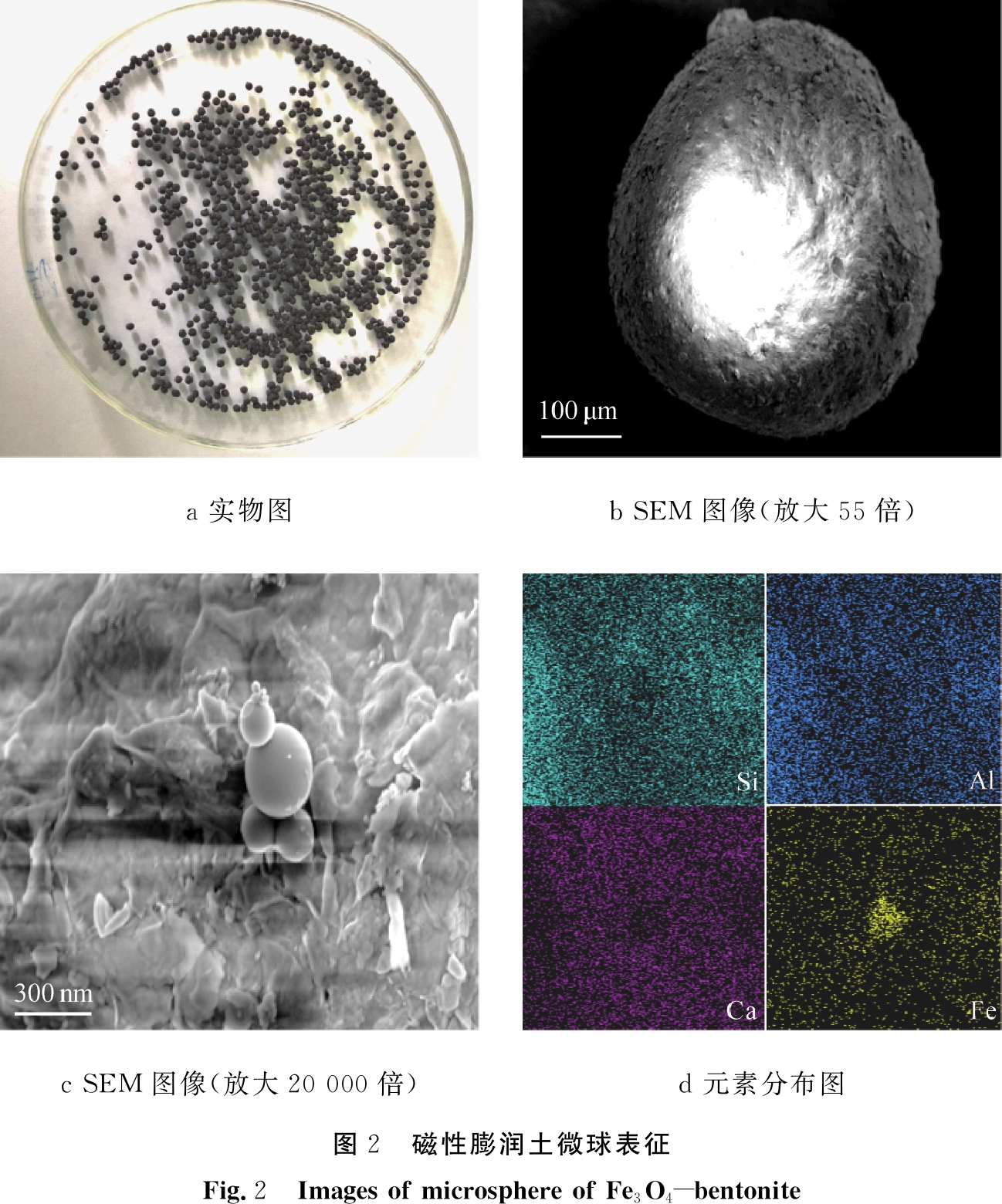
a 实物图b SEM图像(放大55倍)c SEM图像(放大20 000倍)d 元素分布图图2 磁性膨润土微球表征Fig.2 Images of microsphere of Fe3O4-bentonite
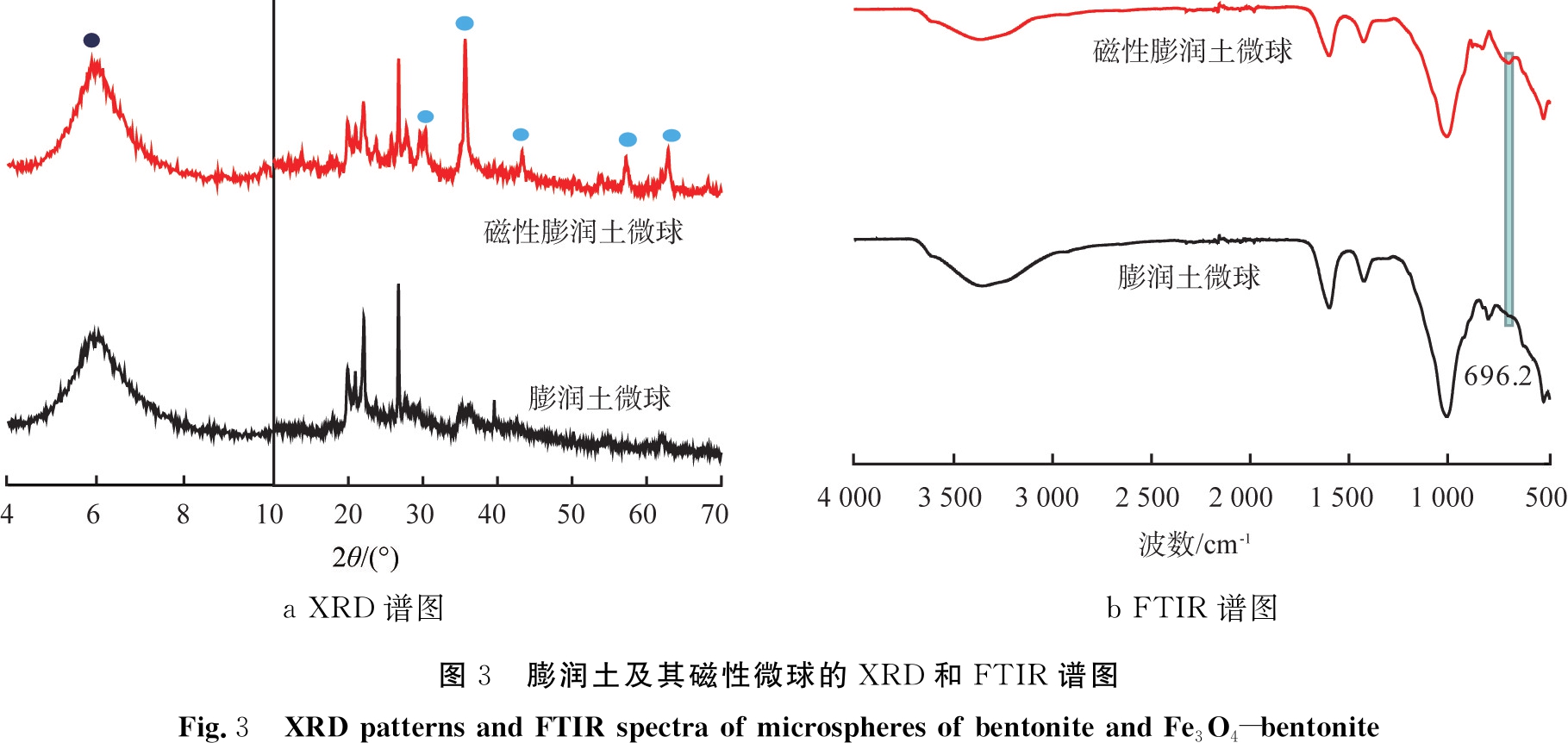
a XRD谱图b FTIR谱图图3 膨润土及其磁性微球的XRD和FTIR谱图Fig.3 XRD patterns and FTIR spectra of microspheres of bentonite and Fe3O4-bentonite
2.2 碱性染料吸附条件优化
图4表示吸附剂用量、溶液初始pH值和吸附时间对膨润土及其磁性微球吸附碱性品蓝和碱性品红的影响。
由图4a可知,膨润土微球和磁性膨润土微球对碱性品蓝的吸附率随着用量增加逐渐增大。当微球用量达到0.08 g以后,去除率达到90%以上,之后基本维持不变,说明吸附过程达到平衡,因此选取磁性膨润土的用量为0.08 g。在去除碱性品红的吸附剂用量影响实验中,当微球用量达到0.10 g以后,吸附率达到82%,并且去除率不再增大,考虑到后续实验可操作性,选取微球用量为0.10 g。
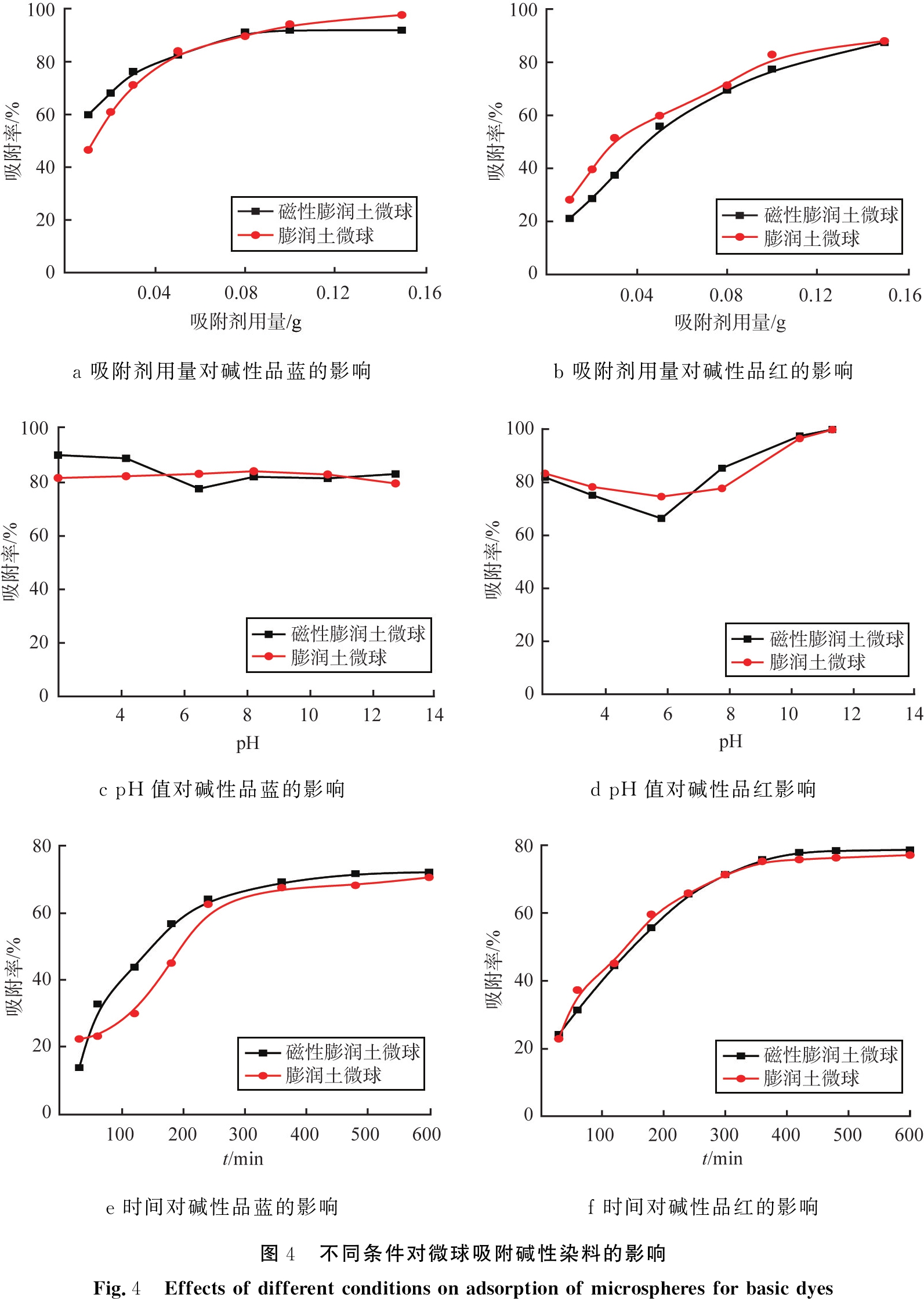
a 吸附剂用量对碱性品蓝的影响b 吸附剂用量对碱性品红的影响c pH值对碱性品蓝的影响d pH值对碱性品红影响e 时间对碱性品蓝的影响f 时间对碱性品红的影响图4 不同条件对微球吸附碱性染料的影响Fig.4 Effects of different conditions on adsorption of microspheres for basic dyes
通过图4a和4b发现,相比于膨润土微球,膨润土磁性微球虽然添加了Fe3O4粒子,但对碱性品蓝和碱性品红的吸附效果基本不变,说明Fe3O4的加入未影响微球的吸附性能,但赋予了微球的磁性,从而使其更容易从混合体系中通过外加磁场而被快速分离出来。
如图4c和4d所示,pH值的变化对微球吸附碱性品蓝的影响较小,去除率保持在80%以上。初始溶液的pH值对碱性品红的去除有明显的影响,当pH为6左右时,微球对碱性品红的吸附能力处于最低值,然后随着pH值的增加而增加,最终的吸附率接近100%。考虑到实际废水pH为6~9,在后续的实验中未调整溶液的pH值。
如图4e和4f所示,随着时间的增加,膨润土微球和膨润土磁性微球对2种碱性染料的吸附量显著增加,随后趋于平衡,其中2种吸附剂对碱性品蓝和碱性品红的吸附平衡时间均为360 min。
2.3 动力学研究
吸附动力学是对吸附过程分析的重要分析手段。在此,采用拟一级和拟二级动力学方程对实验数据进行了动力学分析,计算公式为
(3)
![]()
(4)
式中: t为吸附剂与污染物的反应时间,min;qe和qt分别为反应平衡时和t时的去除量,mg/g;k1和k2分别为拟一级和拟二级动力学方程速率常数,min-1, g/(mg·min)。
表1和图5分别为动力学模型的计算参数和拟合图。从表1中相关系数(R2)可知,膨润土及其磁性微球对2种碱性染料的去除与拟二级动力学方程(R2>0.96)拟合较好,说明吸附过程主要是化学吸附控制。
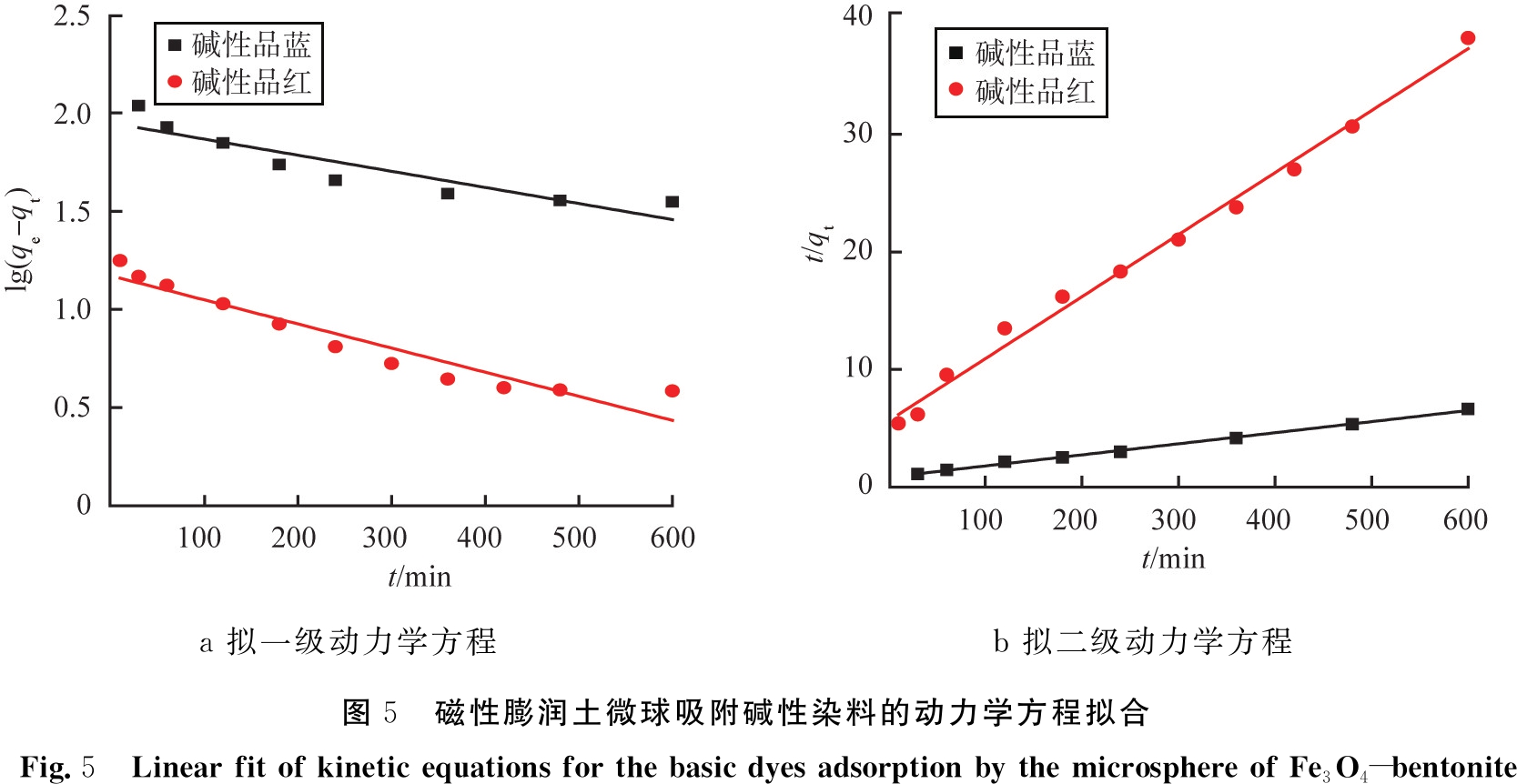
a 拟一级动力学方程b 拟二级动力学方程图5 磁性膨润土微球吸附碱性染料的动力学方程拟合Fig.5 Linear fit of kinetic equations for the basic dyes adsorption by the microsphere of Fe3O4-bentonite
2.4 等温线
在优化的实验条件下进行膨润土微球和膨润土磁性微球去除2种碱性染料的吸附等温线,并用Freundlich和Langmuir等温线模型拟合实验数据。方程式为
(5)
qe=qmKLρe/(1+KLρe),
(6)
式中: qe和qm分别表示吸附剂的平衡吸附量和最大吸附量,mg/g;ρe为吸附平衡时染料的质量浓度,mg/L;KL和KF分别为Langmuir和Freundlich方程常数,L/mg、(mg/g) (L/mg)n。
表1 微球吸附碱性染料的动力学方程参数
Tab.1 Adsorption kinetic constants of microspheres for basic dyes
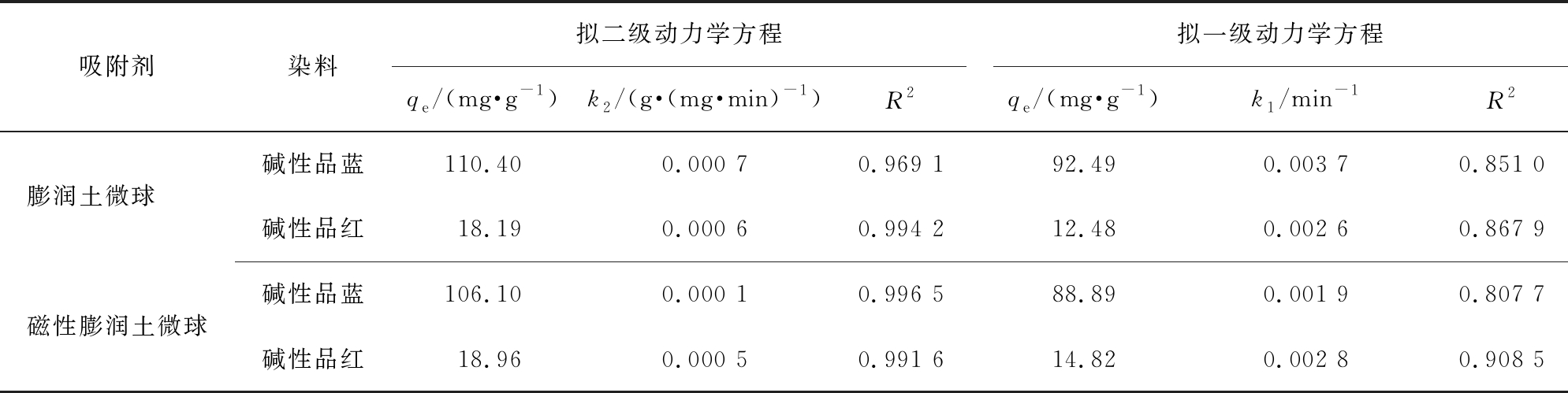
吸附剂染料拟二级动力学方程qe/(mg·g-1)k2/(g·(mg·min)-1)R2拟一级动力学方程qe/(mg·g-1)k1/min-1R2膨润土微球 碱性品蓝110.400.000 70.969 192.490.003 70.851 0碱性品红18.190.000 60.994 212.480.002 60.867 9磁性膨润土微球碱性品蓝106.100.000 10.996 588.890.001 90.807 7碱性品红18.960.000 50.991 614.820.002 80.908 5
图6和表2分别表示等温线拟合图及其相关参数。从R2值可以看出,Freundlich和Langmuir方程均较好地拟合了膨润土微球以及膨润土磁性微球吸附碱性品蓝和碱性品红的数据。 从表2可以看出,膨润土微球和磁性膨润土微球对碱性品蓝和碱性品红的最大吸附量分别为185.7、63.46,163.4、70.30 mg/g,2种微球对2种碱性染料的吸附量相差较小,这进一步说明说明Fe3O4的加入未影响微球的吸附性能,仅赋予了材料的磁性。
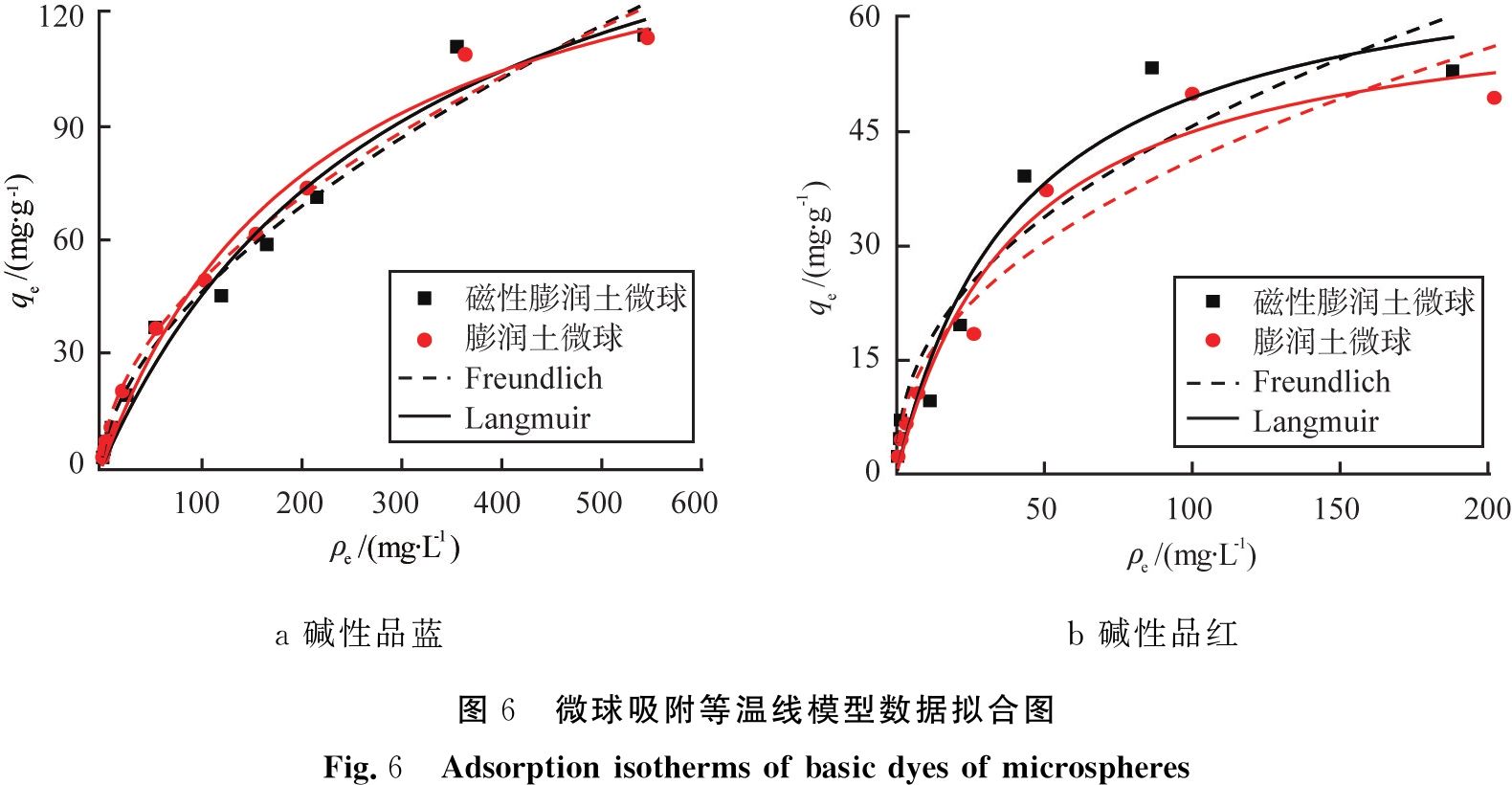
a 碱性品蓝b 碱性品红图6 微球吸附等温线模型数据拟合图Fig.6 Adsorption isotherms of basic dyes of microspheres
表2 微球吸附碱性染料的等温线模型参数
Tab.2 Adsorption isotherm constants of microspheres for basic dyes
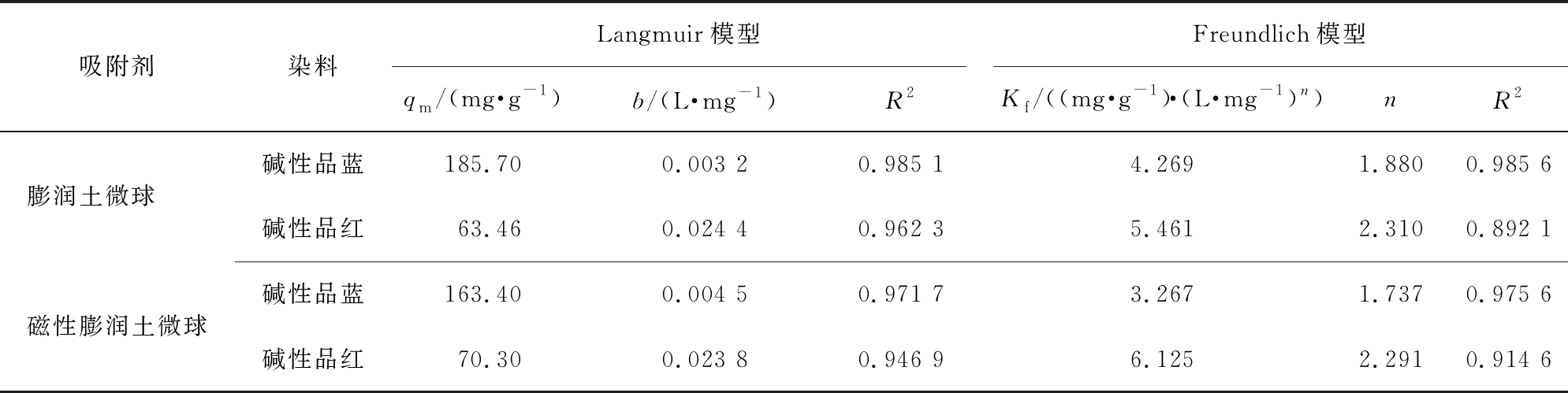
吸附剂染料Langmuir模型qm/(mg·g-1)b/(L·mg-1)R2Freundlich模型Kf/((mg· g-1)·(L·mg-1)n)nR2膨润土微球 碱性品蓝185.700.003 20.985 14.2691.8800.985 6碱性品红63.460.024 40.962 35.4612.3100.892 1磁性膨润土微球碱性品蓝163.400.004 50.971 73.2671.7370.975 6碱性品红70.300.023 80.946 96.1252.2910.914 6
3 结论
1)利用海藻酸钙、膨润土、Fe3O4制备了膨润土微球和磁性膨润土微球,XRD、FTIR和SEM表征结果说明材料复合成功并可实现沉降分离和磁分离,能够解决粉末膨润土难以固液分离的问题。
2)通过静态吸附实验对磁性膨润土微球吸附2种碱性染料的实验条件进行优化,对碱性品蓝和碱性品红的最佳吸附剂用量分别为0.08、0.10 g,不需要调节染料溶液pH值,反应进行360 min时达到吸附平衡。
3)膨润土微球和磁性膨润土微球对碱性品蓝和碱性品红的吸附过程均符合拟二级动力学模型,说明吸附过程为化学吸附。
4)2种微球吸附碱性品蓝和品红的过程符合Freundlich和Langmuir等温线模型,根据Langmuir方程的计算结果,膨润土微球对吸附碱性品蓝和碱性品红的最大吸附量分别为185.7、63.46 mg/g,磁性膨润土微球的分别为163.4、70.30 mg/g。
[1]中国环保产业协会. 6位顶级专家全面解析环保技术前沿[J]. 中国环保产业,2018(6): 10-12.
[2]朱利中,陈宝梁. 有机膨润土及其在污染控制中的应用[M]. 北京: 科学出版社, 2006.
[3]YANG X D, WAN Y S, ZHEGN Y L, et al. Surface functional groups of carbon-based adsorbents and their roles in the removal of heavy metals from aqueous solutions: a critical review[J]. Chemical Engineering Journal, 2019, 366: 608-621.
[4]任滨侨,欧阳凤菊,宋晓晓. 农林废弃物处理重金属废水的研究进展[J]. 化学工程师, 2017, 31(8): 54-56.
[5]WU Y H, PANG H W, LIU Y, et al. Environmental remediation of heavy metal ions by novel-nanomaterials: a review[J]. Environmental Pollution, 2019, 246: 608-620.
[6]ALEXANDER J A, ZAINI M A A, SURAJUDEEN A, et al. Surface modification of low-cost bentonite adsorbents: a review[J]. Particulate Science and Technology, 2019, 37(5): 538-549.
[7]LI Y, TIAN G Y, DONG G Y, et al. Research progress on the raw and modified montmorillonites as adsorbents for mycotoxins: a review[J]. Applied Clay Science, 2018, 163: 299-311.
[8]PANDEY S. A comprehensive review on recent developments in bentonite-based materials used as adsorbents for wastewater treatment[J]. Journal of Molecular Liquids, 2017, 241: 1091-1113.
[9]YAN L G, XU Y Y, YU H Q, et al. Adsorption of phosphate from aqueous solution by hydroxy-aluminum, hydroxy-iron and hydroxy-iron-aluminum pillared bentonites[J]. Journal of Hazardous Materials, 2010, 179(1/2/3): 244-250.
[10]YAN L G, QIN L L, YU H Q, et al. Adsorption of acid dyes from aqueous solution by CTMAB modified bentonite: kinetic and isotherm modeling[J]. Journal of Molecular Liquids, 2015, 211: 1074-1081.
[11]XIN X D, SI W, YAO Z X, et al. Adsorption of benzoic acid from aqueous solution by three kinds of modified bentonites[J]. Journal of Colloid and Interface Science, 2011, 359(2): 499-504.
[12]YAN L G, SHAN X Q, WEN B, et al. Adsorption of cadmium onto Al13-pillared acid-activated montmorillonite[J]. Journal of Hazardous Materials, 2008, 156(1/2/3): 499-508.
[13]于海琴,闫良国,辛晓东,等. CTMAB和PDMDAAC有机改性膨润土的制备及其表征[J]. 光谱学与光谱分析, 2011, 31(5): 1393-1397.
[14]刘香玉,孙娟,赵朝成,等. CTAB改性膨润土制备及其对海洋溢油的吸附性能[J]. 环境工程学报, 2019, 13(1): 68-78.
[15]李彬,赵明星,代雨勃,等. 膨润土尾矿复合陶粒制备与Cr(VI)吸附性能[J]. 矿物学报, 2019, 39(2): 211-218.
[16]YAN L G, LI S, YU H Q, et al. Facile solvothermal synthesis of Fe3O4/bentonite for efficient removal of heavy metals from aqueous solution[J]. Powder Technology, 2016, 301: 632-640.
[17]LIAN L L, CAO X L, WU Y Q, et al. A green synthesis of magnetic bentonite material and its application for removal of microcystin-LR in water[J]. Apply Surface Science, 2014, 289: 245-251.
[18]KHARISSOVA O V, DIAS H V R, KHARISOV B I. Magnetic adsorbents based on micro-and nano-structured materials[J]. RSC Advances, 2015, 5: 6695-6719.
[19]FUNES A, DE VICENTE J, CRUZ-PIZARRO L, et al. Magnetic microparticles as a new tool for lake restoration: a microcosm experiment for evaluating the impact on phosphorus fluxes and sedimentary phosphorus pools[J]. Water Research, 2016, 89: 366-374.
[20]许晨红,王卫军,金叶玲,等. 溶剂对膨润土微纳米化的影响研究[J]. 非金属矿, 2013,36(1): 5-7.