氧化镁(MgO)为面心立方的离子化合物,镁离子和氧离子之间通过高强度离子键而结合。 由于其具有很多优异性能,可应用于各种工业和技术领域。 比如,由于其可耐受离子轰击和高能射线辐射,因此可作为等离子显示器件中的介质层保护材料[1];因为其可抑制钙钛矿电池中二氧化钛致密层的复合损耗,所以可用于太阳能电池中[2];因为其在水化过程中产生体积膨胀,所以可用作混凝土膨胀剂[3];因为纳米MgO的比表面积大,能够降低陶瓷烧结温度,所以可用于制造高致密度的细晶陶瓷[4];此外还可作为催化剂[5]、吸附剂[6-7]、抗菌剂[8]等。对MgO制备工艺的研究至关重要。
本文中通过液相合成工艺中的直接沉淀法制备氢氧化镁(Mg(OH)2)前驱体,再通过煅烧工艺制备纳米MgO;通过调整实验参数,以期得到品质良好的立方形貌纳米MgO。
1 实验
1.1 试剂及仪器
试剂: 氯化镁(MgCl2)、 氢氧化钠(NaOH)、 无水乙醇、 乙二醇等,均为分析纯,去离子水则为实验室自制。
仪器:集热式恒温加热磁力搅拌器(DF-101S)、数控超声波(KQ-250DB)、真空水泵、马弗炉。
1.2 样品制备
分别称取物质的量浓度分别为0.4、 0.5、 0.6、 0.7 mol/L的MgCl2放入500 mL的三口圆底烧瓶中,用量筒称取100 mL无水乙醇倒入圆底烧瓶中,搅拌使其完全溶解后,加入镁盐质量分数为30%的有机分散剂乙二醇,搅拌20 min进行混合均匀;再用烧杯分别称取2.5、 5、 10、 12.5 g的NaOH,加入50 mL去离子水溶解后,倒入250 mL容量瓶中,再加入50 mL无水乙醇,用无水乙醇和去离子水的混合液(其中水与乙醇的体积比为1∶1)定容到刻度线,配制物质的量浓度分别为0.25、 0.5、 1.0、 1.25 mol/L的NaOH溶液,振荡均匀。 搅拌下将NaOH溶液缓慢滴加到MgCl2溶液中,滴加完毕后继续搅拌30 min,静止陈化2 h,在离心机上进行分离,再用无水乙醇洗涤,真空干燥后得到白色Mg(OH)2前驱体。
设置热处理程序,煅烧Mg(OH)2前驱体,得到白色立方纳米MgO固体。
1.3 样品性能与表征
采用德国Bruker公司X射线衍射仪(XRD)进行结构表征;采用日本Hitachi公司场发射扫描电子显微镜(SEM)对样品形貌、粒径大小进行分析;采用德国Netzsch公司差热热重分析仪对样品进行失质量分析。
2 结果与讨论
2.1 Mg(OH)2前驱体形貌研究
2.1.1 Mg(OH)2前驱体的形貌表征
图1为Mg(OH)2前驱体的XRD图谱和SEM图像,以此考察其物相和形貌。 如图1a所示,Mg(OH)2前驱体的衍射峰位置与XRD数据库Mg(OH)2的标准图谱(JCPDS:44-1482)一致,分别对应(101)、(102)、(110)、(111)、(103)、(112)晶面衍射峰,属六方晶系,说明产物为Mg(OH)2[9];衍射峰峰形尖锐,峰宽很窄,表明产物结晶良好。图1b为Mg(OH)2前驱体的SEM图像,样品呈现疏松的片状薄层,晶粒尺寸在500 nm左右。
a XRD图谱

b SEM图像
图1 Mg(OH)2前驱体的XRD图谱及SEM图像
Fig.1 XRD patterns and SEM image of precursor of Mg(OH)2
2.1.2 沉淀剂浓度的影响
合适的反应物(沉淀剂及镁盐)浓度对产物的形貌有重要影响。根据晶体成核和生长的规律,晶粒生长存在成核和晶粒生长2个阶段。如果反应物浓度过低,难以为产物提供足够的原料,而当反应物浓度过高,晶体的成核速率大于晶体的生长速率,加入反应物的瞬间就产生大量晶核,这样的晶核来不及长大,具有很高的表面自由能,容易发生团聚[10],所以确定合适的反应物的浓度非常重要。
不同NaOH浓度下制备Mg(OH)2前驱体的SEM图像如图2所示。实验中沉淀剂NaOH的浓度分别为0.25、0.5、1.0、1.25 mol/L。当NaOH的浓度较低时,Mg(OH)2前驱体的形貌为片状;当NaOH的浓度增加到1.0 mol/L时,Mg(OH)2的形貌由片状转变为棒状,继续增加碱液的浓度,形貌仍维持棒状,但是粒子间聚合力增大,分散性变差[11]。由此确定NaOH的最优浓度为0.5 mol/L。

a 0.25 mol/Lb 0.5 mol/Lc 1.0 mol/Ld 1.25 mol/L图2 不同NaOH浓度下制备的Mg(OH)2的SEM图像Fig.2 SEM images of Mg(OH)2 prepared with different concentrations of NaOH
2.1.3 镁盐初始浓度的影响
不同镁盐初始浓度下Mg(OH)2前驱体的SEM图像如图3所示。实验中镁盐的浓度分别为0.4、0.5、0.6、0.7 mol/L。随着镁盐初始浓度的增加,粒径逐渐变大,晶粒间的界限模糊。这是由于当Mg2+初始浓度较大时,溶液过饱和度大,晶核形成速率大于其生长速率,易得到小颗粒沉淀,但成核密度过大时,晶核易团聚,导致晶粒间的界限模糊[12],因而镁盐初始浓度选择为0.4 mol/L。
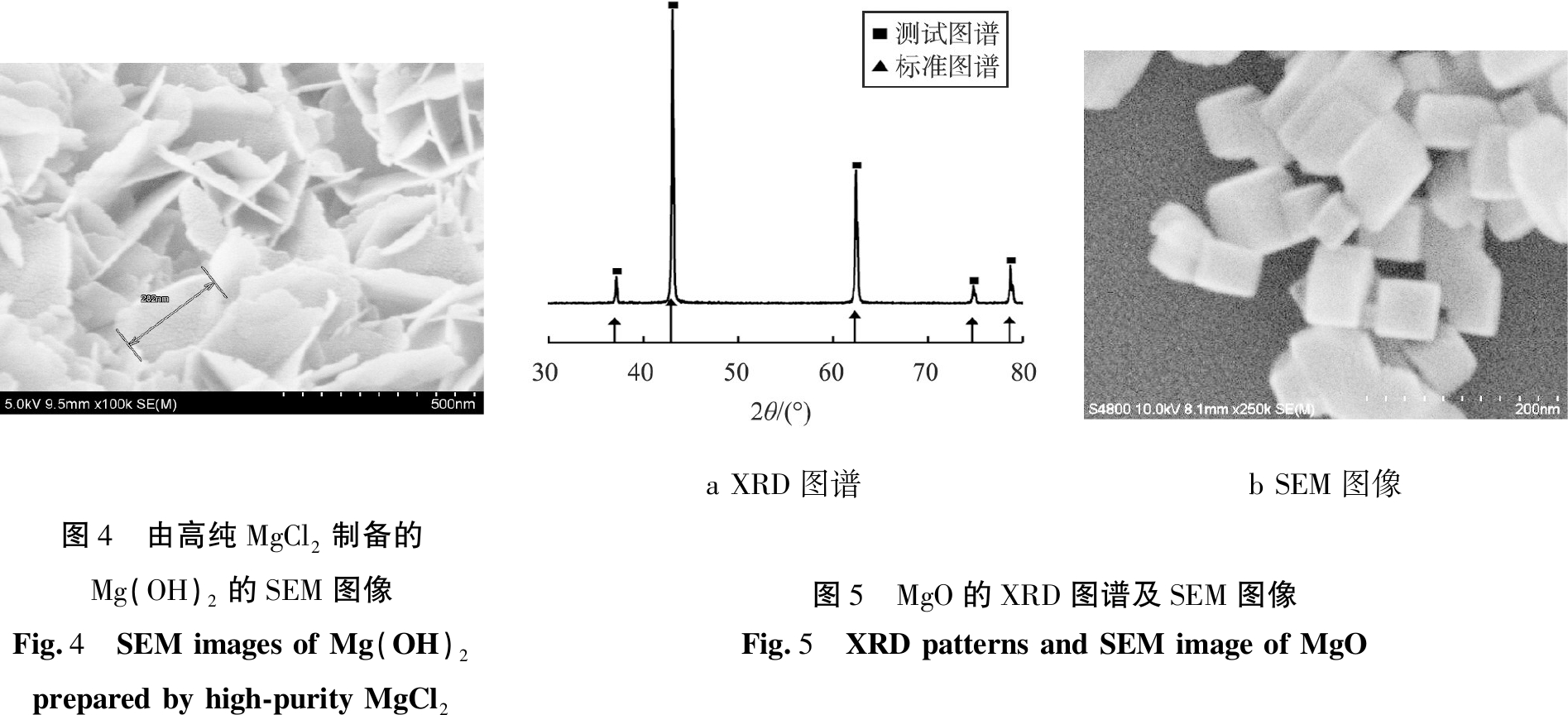
另外,若以高纯无水MgCl2(>99.5%)为原料,可得到高纯Mg(OH)2,其扫描电镜图像如图4所示。 该粉体细腻疏松,呈现分散均匀的花瓣状薄片组合,这可能是由于样品纯度的提高有利于结晶度的提升(前面用到的MgCl2纯度为分析纯)。
2.2 MgO形貌研究
2.2.1 MgO形貌表征
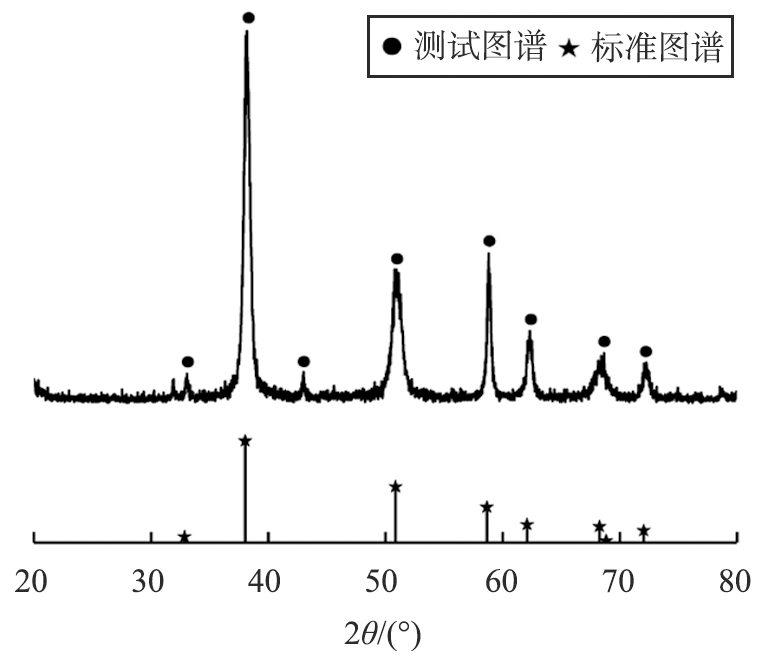
MgO的XRD图谱和SEM图像如图5所示。 从图5a可知,所得的MgO为立方相结构,在2θ为 36.937、42.917、62.304、74.691、78.630 °处出现了(111)、(200)、(220)、(311)、(222)晶面衍射峰,衍射峰尖锐,结晶性良好,沿(200)晶面择优生长[13],无其他杂峰存在。
从图5b可知,MgO为立方晶粒,其晶粒主要分布在50~100 nm范围内,纳米颗粒的分散性有待改善。这是由于纳米颗粒化学活性高,表面效应强烈,容易发生聚集而达到稳定状态,从而导致分散性变差[10-14]。在Mg(OH)2前驱体制备过程中加入了一定量的乙醇和乙二醇来缓解团聚现象,后续研究可以尝试使用其他分散剂,如PEG、 SDS、 OP-10等进一步改善颗粒的分散性。

a 0.4 mol/Lb 0.5 mol/Lc 0.6 mol/Ld 0.7 mol/L图3 不同MgCl2浓度下制备的Mg(OH)2的SEM图像Fig.3 SEM images of Mg(OH)2 prepared with different concentrations of MgCl2
a XRD图谱b SEM图像图4 由高纯MgCl2制备的Mg(OH)2的SEM图像Fig.4 SEM images of Mg(OH)2 prepared by high-purity MgCl2图5 MgO的XRD图谱及SEM图像Fig.5 XRD patterns and SEM image of MgO
2.2.2 Mg(OH)2煅烧过程分析
Mg(OH)2差热热重分析曲线如图6所示。 从热重曲线(TG)上可以看出,样品的失质量过程共分为3个阶段,分别发生在176~335、 335~452、 452~500 ℃处。
第1阶段的吸热峰峰值位于200 ℃,失质量分数为20.8%,这主要是由于样品表面吸附水份挥发所致;第2个阶段的吸热峰位于355 ℃,失质量分数为6.26%,这主要归因于样品中残留大分子有机物发生分解反应所致;第3阶段吸热峰位于474 ℃,样品的失质量分数为38.82%,这主要是由于Mg(OH)2发生分解反应所致。
从差热曲线(DTA)上可看到,在900~1 300 ℃间存在一个大的吸热峰,峰值位于1 156 ℃,此温度范围内只有热量的变化,没有质量的变化,说明此时吸热主要由晶粒表面的缺陷调整和晶粒的生长引起[14]。控制此阶段的热处理过程,可对材料的晶粒大小、晶型等进行调整。
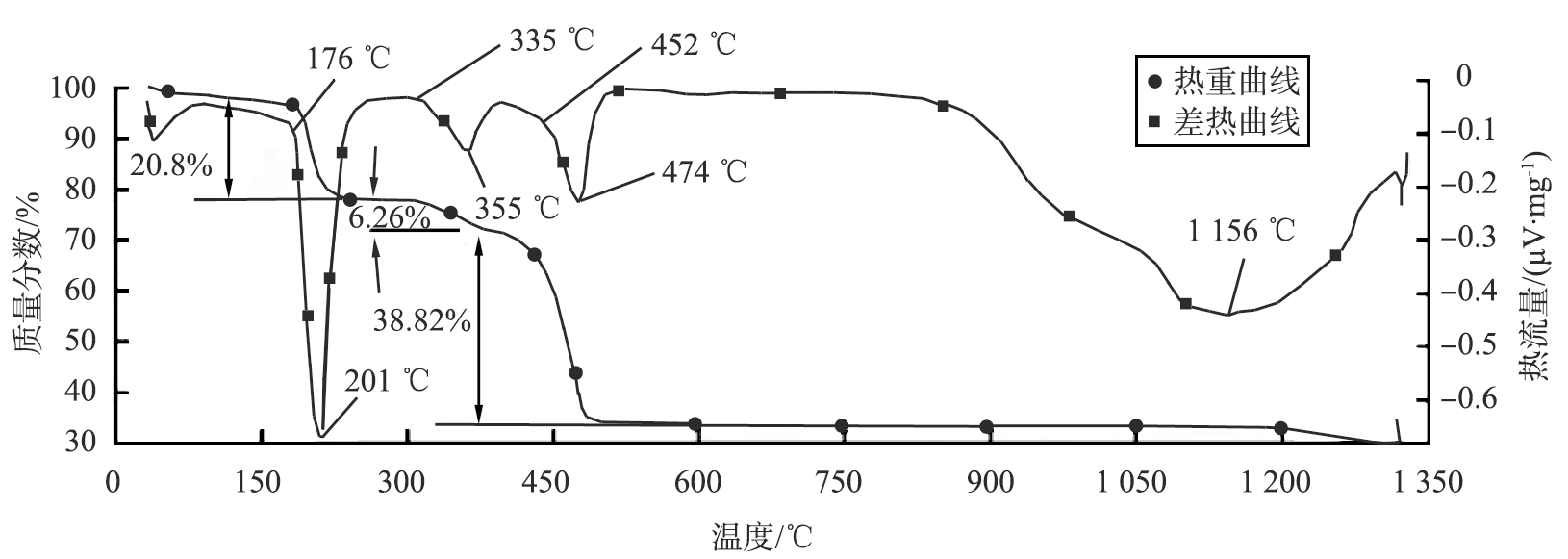
图6 Mg(OH)2的差热热重分析曲线
Fig.6 TG-DTA curves of Mg(OH)2
2.2.3 煅烧温度对MgO形貌的影响
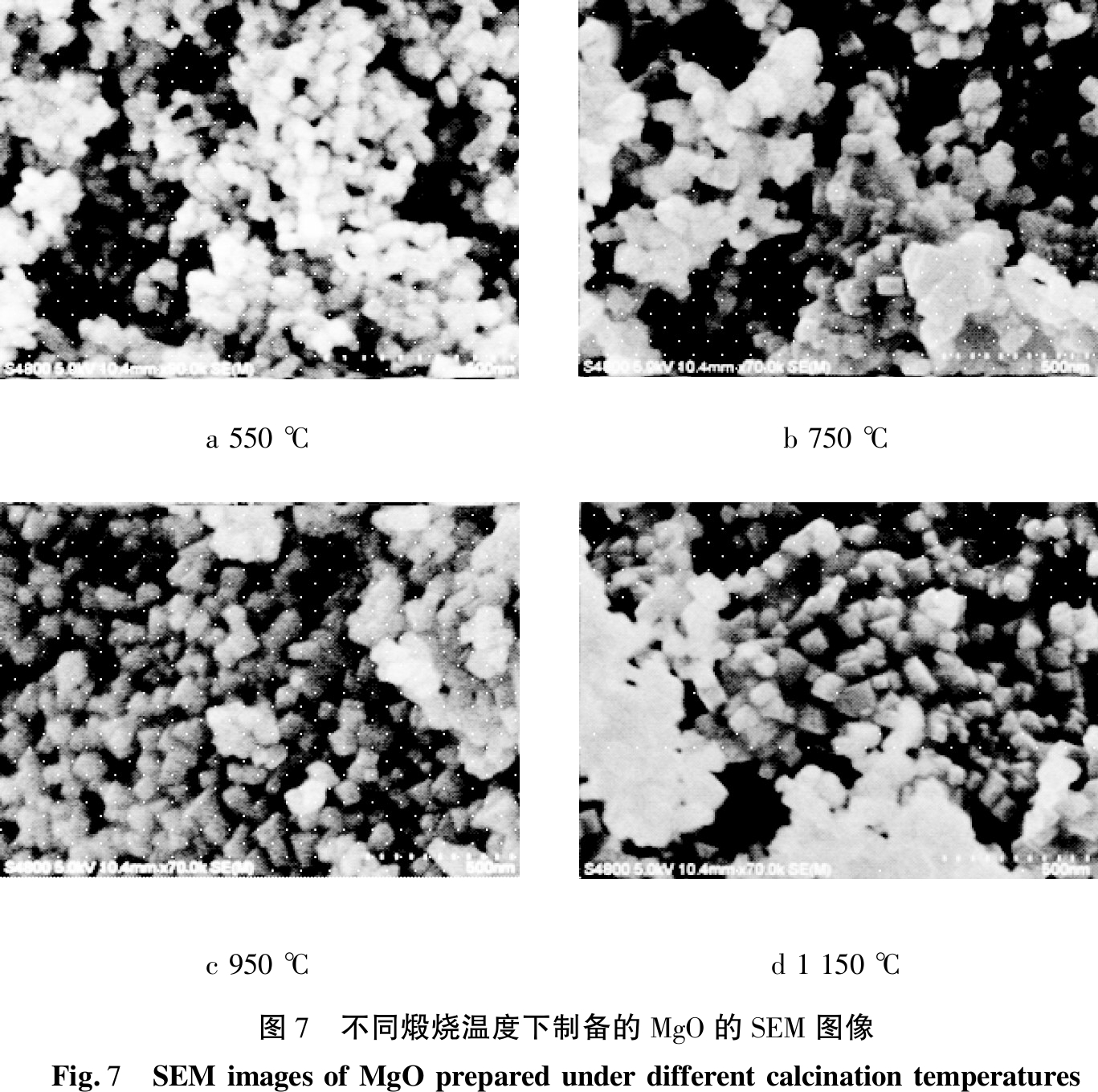
图7为不同煅烧温度下MgO的SEM图像,可研究不同煅烧温度对MgO形貌和粒度的影响。可以看到,煅烧后均形成立方纳米MgO,且晶粒粒度均匀;同时,随着煅烧温度的升高,晶粒界面产生迁移,粒径有增大的趋势,但是并不明显[15]。结合热分析结果,将煅烧温度控制在1 150 ℃。
2.2.4 煅烧时间对MgO形貌的影响
图8为在煅烧温度1 150 ℃条件下不同保温时间时纳米MgO的SEM图像。通过对比SEM图像可以发现,随着保温时间的增加,MgO微晶不断生长,粒径有所增大,晶体结构也更加完整[16]。
a 550 ℃b 750 ℃c 950 ℃d 1 150 ℃图7 不同煅烧温度下制备的MgO的SEM图像Fig.7 SEM images of MgO prepared under different calcination temperatures

a 1 h

b 2 h

c 3 h
图8 不同保温时间时制备的MgO的SEM图像
Fig.8 SEM images of MgO prepared with different holding time
3 结论
采用制备成本较低、易于放大的液相合成工艺中的直接沉淀法,通过对配方和反应条件的控制,实现了立方纳米MgO的Mg(OH)2前驱体合成。结合高温烧结后处理程序的设定,得到了粒径范围分布较窄的、结晶良好的立方MgO微晶。制备方法简单、易操作,重复性强,可实现工业化生产。
[1]LEE G S, LEE J Y, CHEON Y B, et al. Influence of hydrogen-doped MgO thin films on the discharge characteristics in plasma display panels[J]. Thin Solid Films, 2011, 519(10): 3037-3042.
[2]HAN G S, CHUNG H S, KIM B J, et al. Retarding charge recombination in perovskite solar cells using ultrathin MgO-coated TiO2 nanoparticulate films[J]. Journal of Materials Chemistry A, 2015, 3(17): 9160-9164.
[3]徐菊. 新型氧化镁膨胀剂对混凝土性能的影响研究[D]. 北京:北京建筑大学,2018.
[4]张永芬. 纳米氧化镁粉体的制备及其烧结特性与催化性能研究[D]. 秦皇岛:燕山大学,2014.
[5]FERNANDES G P, YADAV G D. Selective glycerolysis of urea to glycerol carbonate using combustion synthesized magnesium oxide as catalyst[J]. Catalysis Today, 2018, 309: 153-160.
[6]YANG S, HUANG P, PENG L, et al. Hierarchical flowerlike magnesium oxide hollow spheres with extremely high surface area for adsorption and catalysis[J]. Journal of Materials Chemistry A, 2016, 4(2): 400-406.
[7]王素平, 李祥高, 王世荣, 等. 高活性氧化镁的制备及其对铅离子吸附性能[J]. 化学工业与工程, 2017, 34(5): 1-10.
[8]王俊怡. 纳米复合氧化镁合成及其抗菌性能与结晶动力学研究[D]. 深圳:深圳大学,2016.
[9]宋雪雪, 李丽娟, 姬连敏, 等. 纳米及微米级六角片状氢氧化镁的制备[J]. 盐湖研究, 2018, 26(2): 66-74.
[10]赵盼盼. 氢氧化镁结晶过程研究[D]. 上海:华东理工大学,2012.
[11]范天博, 王怀士, 张研, 等. 高温体系合成六方片状氢氧化镁晶体生长机理的研究[J]. 人工晶体学报, 2014, 43(9): 2276-2280.
[12]朱华兵. 热解-水合制备氢氧化镁阻燃剂关键技术研究[D]. 天津:天津科技大学,2016.
[13]BADR-MOHAMMADI M, MOBASHEPOUR I, RAD E M, et al. Synthesis of cubic MgO nanostructure by an easy hydrothermal-calcinations method[J]. Journal of Ceramic Processing Research, 2014, 15(2): 88-92.
[14]朱一民, 王小宇, 韩跃新. 纳米氧化镁合成过程中颗粒粒度及形状控制研究[J]. 中国粉体技术, 2011, 17(1): 1-5.
[15]高慧芳, 段慧娟, 陈星晖, 等. 立方体纳米氧化镁的可控合成及其粒度影响因素的探究[J]. 应用化工, 2018, 47(8): 1671-1674.
[16]王素平. 高活性氧化镁的制备与吸附性能的研究[D]. 天津:天津大学,2015.