水溶性差限制了很多药物化合物的开发和应用。 有关数据统计表明,约有40%以上的具有药理活性的化合物难溶于水[1],使得这部分药物难以用于临床。为了解决水溶性差这个问题,已开发了多种方法来提高药物的表观溶解度。传统上,药物和合成化学家更喜欢将弱酸或弱碱化合形成盐,但是,只有20%~30%的新分子容易形成盐,因此,其余的70%~80%的新分子必须找到另一种途径来提高溶解性[2]。
纳米技术应用日益广泛,纳米化产品在医疗、 食品和药品中都占有一定的份额[3]。 采用纳米技术能改变药物理化性质,为改善难溶性成分溶解度、 提高生物利用度提供了新途径[4]。 故此,本文中综述了纳米晶体技术在药物难溶性成分的相关研究进展,总结了传统和新型的纳米晶体药物的制备方法,以期为相关研究提供一定的借鉴。
1 纳米晶体药物的涵盖范围
纳米晶体药物也称纳米混悬剂,或称纳米晶体混悬液,是指药物通过聚合物或者表面活性剂稳定后,而形成的亚微米胶体分散体[5],即利用某些高分子聚合物、表面活性剂或者二者联用作为稳定剂,将微米级药物经物理加工,粒径减小到纳米级,并可依靠立体保护或者电荷保护来维持药物稳定性[6],可用于口服、静注、肺部、经皮和眼部等给药途径制剂[7]。
超细粉体,又称为超微粉体,通常是指粒径在10 μm以下的粉体,根据粒径分纳米粉体、 亚微米粉体、 微米粉体3类。当固形物质粉碎至纳米尺寸时,该粉体理化性质发生巨大变化[8]。广义上讲,纳米晶体应属于超细粉体的范畴,有文献中将制得的纳米晶体药物也称为超微粉体[9],但在制备过程中如未加稳定剂的纳米级超微粉体[10]、纳米颗粒[11]应不属于纳米晶体药物的范畴。
2 纳米晶体药物的作用机制
2.1 减小粒径
纳米晶体技术可使药物粒径由微米级减小到纳米级,药物颗粒理化性质发生极大改变,使药物具有不同于其他普通制剂的特殊理化性质[12]。如难溶于水的药物制成纳米晶体后,粒径减小,溶解度、口服生物利用度均得到提高[13]。
2.2 生物粘附
生物粘附可以通过增加作用位点与具有黏膜的纳米晶体药物的接触点和接触时间,进而可以增加药物的吸收,可以使纳米晶体药物的生物利用度大大提高[14]。只考虑纳米晶体的固有性质,接触点数量的增加可能导致生物粘附[15],又或者,纳米晶体的表面可以用合适的聚合物或阳离子表面活性剂进行修饰,根据粘着理论(如电子理论、吸附理论、捕获理论和扩散理论)显示出粘着[16-19]。由于纳米晶体药物黏膜对口腔黏膜或者胃肠道黏膜等的粘附作用,药物可以准确地在吸收部位释放,获得更高的浓度梯度和更长的保留时间[20],让药物充分的发挥其功效。Jacobs等将布帕喹酮配制成一种粘附纳米微囊,即结合粘附给药系统的特性与纳米微囊结合,得到的纳米晶体药物提高了生物利用度[21]。
2.3 靶向给药
纳米晶体的靶向给药属于新的研发热点,对药物纳米晶体进行粒径控制或表面修饰,可以使纳米晶体定向分布于某些特定组织部位,如到达脑、肿瘤、肝、脾等部位发挥靶向作用[22]。如单核巨噬细胞吞噬导致的被动靶向制剂,即静脉注射纳米晶体,血浆中的调理素蛋白极易吸附纳米晶体,调理素蛋白进而被单核巨噬细胞识别、吞噬,从血液中清除。Hao等[23]制备的两性霉素B纳米晶体,Han等[24]制备的羟基喜树碱纳米晶体, 均具有明显肝、脾靶向性能;配体介导的主动靶向制剂,即配体吸附到纳米晶体药物表面,进而识别体内特异性受体,借助受体介导的吞噬作用,将纳米晶体药物传送到特定组织部位。Talekar等[25]制备了磷脂酰肌醇-3激酶抑制剂纳米晶体,生物利用度明显提高。环境响应的靶向制剂属于物理化学靶向,如Fuhrmann等[26]制备的多西他赛纳米晶体,Shafiu Kamba等[27]制备的pH响应型纳米晶体;载脂蛋白apolipoprotein E介导的脑靶向制剂,如Liu等[28]制备了黄芩苷纳米晶体。
3 纳米晶体药物的制备技术
3.1 Top-down技术
Top-down技术的原理是:通过机械力将粒径较大的药物颗粒减小为纳米尺寸的颗粒[29],该技术属于粉体粉碎的范畴。 20世纪70年代中期,超细粉体技术作为一门新兴学科流行发展起来[30],目前超细粉的制备主要采用机械粉碎,优点是操作简便、 产量大、 成本低,粉体活性极大提高[31]。 在超细粉体中,纳米粉体的粒径为0.001~0.1 μm,比表面积大,活性好[30]。
Top-down技术由于其易于控制颗粒大小、易于商业化和快速加工等特点,在已上市的纳米晶体药物中广泛应用。该技术的缺点是需要大量循环才能获得所需粒径,并且药物粒子在一段时间内会因团聚而导致物理稳定性较差[32]。Top-down技术的分类、特点及代表药物见表1。
3.2 Bottom-up技术
Bottom-up技术的原理是:通过控制药物颗粒沉淀或结晶使颗粒迅速减小,从饱和溶液中析出[58]。该技术关键要控制结晶结构,避免晶体超出纳米范围。Bottom-up技术方法操作简单,易于处理和工业化大生产,缺点是难以规模化,重复性差,需用有机溶剂,可能造成环境污染且残留的有机溶剂可产生毒性,所以该技术中的溶剂残留量需加以检验。Bottom-up技术的分类、特点及代表药物见表2。
表1 Top-down技术研究
Tab.1 Top-down technology research

分类优点局限性代表药物介质研磨法 过程简单,在实验室可进行,可使用低能量或高能量,搅拌球磨机可采用不连续或连续方式运行 研磨介质污染,分散质量批次间变化,加工时间长,微生物问题风险,粒度分布范围宽 槲皮素[33]、白藜芦醇[34]、布洛芬[35]、苯妥英[36]、萘普生[37]、阿瑞匹坦[38]、非诺贝特[39]、醋酸甲地孕酮[40]、阿瑞匹坦[41]高压均质法 粒度可通过调节生产压力和加工周期数来控制,颗粒大小均匀,周期短,人为误差小,工艺重现性好,易于放大生产,可以保证无菌生产,与湿法研磨相比,不易产生工艺杂质 高压会引起晶体结构的变化,在某些情况下会增加非晶态数量,结晶度的批次变化,以及部分非晶态纳米悬浮液的稳定性问题 杨梅素[42]、金丝桃苷[43]、黄芩苷[44]、柚皮素[45]、冬凌草甲素[46]、灵芝三萜[47]、姜黄素[48]、洛伐他汀[49]、葛根素[50]、去氢骆驼蓬碱[51]、穿心莲内酯[52]、紫杉醇-白桦脂酸[53]、紫杉醇[54-55]、齐墩果酸[56]、胡椒碱-阿霉素复合物[57]
表2 Bottom-up技术研究
Tab.2 Bottom-up technology research
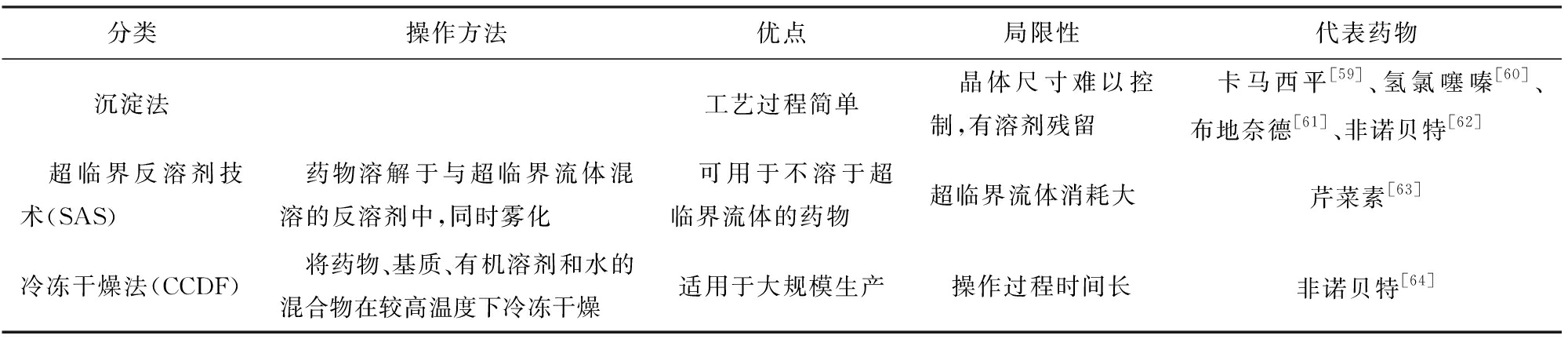
分类操作方法优点局限性代表药物沉淀法工艺过程简单 晶体尺寸难以控制,有溶剂残留 卡马西平[59]、氢氯噻嗪[60]、布地奈德[61]、非诺贝特[62] 超临界反溶剂技术(SAS) 药物溶解于与超临界流体混溶的反溶剂中,同时雾化 可用于不溶于超临界流体的药物超临界流体消耗大芹菜素[63]冷冻干燥法(CCDF) 将药物、基质、有机溶剂和水的混合物在较高温度下冷冻干燥适用于大规模生产操作过程时间长非诺贝特[64]
3.3 新型技术
制备纳米晶体药物时,单一技术难以达到粒径均匀、稳定性好,多种技术联用可补足其缺点使制剂安全有效。联用Top-down和Bottom-up技术,可消除缺陷并充分利用各技术的长处,更好地控制纳米晶体药物的粒径大小,并加快生产速度,但联用技术的经济性和加工过程的复杂性有时也会限制该技术的使用。
除了Top-down和Bottom-up技术联用外,近年来又出现了共晶联合Bottom-up技术制备纳米晶体。药物共晶是药物活性成分和共晶配体按照一定的比例,通过氢键或其他共价键等分子间作用力形成的一种新晶型[65],能够改变一些药物的性质,比如溶解度、溶出速度、熔点、密度等理化性质的有效途径。在药剂学中应用药物共晶最大的价值即不需要改变药物分子共价结构,便可修饰药物理化性质[66-67],在药物共晶的基础上,进一步联用Bottom-up技术制备纳米共晶,其溶解度较相应共晶有进一步提高[68]。
激光破碎技术,是近几年出现的新破碎技术。该方法在激光烧蚀过程中,固体靶受到辐照,被喷射出的物质在周围的液体中形成纳米颗粒,在激光破碎过程中,微粒子的搅拌悬浮液被辐照成纳米粒子[40]。新型技术的分类、特点及代表药物见表3。
表3 新型技术研究
Tab.3 new technology research

分类优点局限性代表药物 冷冻干燥-高压均质法、喷雾干燥—高压均质法 避免堵塞问题,并减少处理时间,可以在知识产权方面提供一定的操作自由探头超声-高压均质法 纳米晶体粒径小,分布范围窄,形态与再分散性良好沉淀-高压均质法 多分散系数理想且粒径较小,稳定性良好 预处理步骤可能会增加流程的复杂性并增加大量成本 黄芩苷[44]、氢化可的松[69]、格列本脲[70]黄芩苷[71] 人参皂苷Rg3[72]、伊曲康唑[73]、黄芩素[74]、槲皮素[75]、波棱瓜子[76]、熊去氧胆酸[77]
续表

分类优点局限性代表药物介质研磨-高压均质法 减少高压均质的压力,提高均质效率,稳定性好麦角溴烟酯[78]介质研磨-喷雾干燥法 设备简单,制备工艺稳定,混悬液固化过程耗时少,所得纳米晶体流动性较好,易于工业生产柚皮素[79]反溶剂沉淀-超声法 操作简单,重现性好,适于实验室少量制备 盐酸吡格列酮超微粉体[9]、缬沙坦[60]、蟾毒灵[80]、尼群地平[81]、紫杉醇[82]沉淀-冻干-高压均质法均质次数少克拉霉素[83]高速剪切-高压均质法 减少高压均质的压力, 提高均质效率芦丁[84]、黄芩苷[85] 共晶技术联合Bottom-up技术 改善物化性质,增加溶解度和生物利用度杨梅素-脯氨酸共晶[68]激光破碎技术晶体粒径减小晶体部分损失醋酸甲地孕酮[40]
4 应用形式
4.1 单一药物
目前上市和研究最多的是单一纳米晶体药物,见表1—3中单一药物。
4.2 复方药物配伍
4.2.1 复方药物纳米晶体
蒋爱等[53]制备了紫杉醇-白桦脂酸混合纳米混悬剂,其中的紫杉醇和白桦脂酸均以无定形形式存在,分散性与稳定性良好,制备成纳米冻干粉后,紫杉醇水中溶解度提高约90倍,白桦脂酸的溶解度提高约100倍,在2 h内2种药物累积溶出率显著提高,均达到95%。刁依娜等[57]采用合成化合物的方法得到胡椒碱-阿霉素复合物,并将其制备成纳米混悬液冻干制剂,所得制剂抑制所选肿瘤细胞株生长,并且抑制效果好于阿霉素单一用药。
4.2.2 纳米晶体药物联合用药
缬沙坦和氢氯噻嗪均是水难溶性药物,在高血压等心血管疾病上均有较好的临床应用,二者联用疗效明显,副作用少,但其水难溶性使得这2种药物的生物利用度较低。陈嘉敏[60]将这2种药物分别制备成纳米结晶后,制备成复方缬沙坦氢氯噻嗪,以提高这2种药物的溶解度以及在水和pH=6.8的磷酸缓冲液中的溶出速度,从而提高药物的相对生物利用度。
5 讨论
纳米晶体的制备技术已经取得了很大的进展,有十余种药物已经上市[86]。Top-down技术是制备技术的主流方法,上市品种大多采用该方法制备。Bottom-up技术进展稍缓,新型技术作为传统技术的有效补充发展迅速。新技术的应用拓展了纳米晶体药物的发展空间。
联合用药可以发挥药物的协同作用,降低用药剂量、减少毒性,扩大治疗范围等。将药物共晶技术和纳米晶体药物制备技术联合用于多组分难溶性药物的研发,将多种药物制备成混合纳米混悬剂可开发老药的新价值,有望为复方新药的研发提供帮助,也可进一步推动中药多组分难溶性成分在药学领域的发展,但还需更多的研究来支撑。
药物晶型的改变可能对药物的药效学和安全性产生影响,针对纳米晶体制备过程中的晶型转变问题有必要深入研究[87]。 相比于载体纳米递药系统,纳米晶体高载药能力使其成为研究难溶性药物靶向制剂的热点,但是,纳米晶体靶向给药制剂、 靶向递药速率、 靶向机制等方面仍需要进一步的研究。 未来,可以将上述问题作为借鉴进行深入的研究,以期为纳米晶体技术在药物难溶性成分中的应用开拓方向。
[1]郑爱萍,石靖.纳米晶体药物研究进展[J].国际药学研究杂志,2012,39(3):177-183.
[2]JERMAIN S V, BROUGH C. Amorphous solid dispersions and nanocrystal technologies for poorly water-soluble drug delivery: an update[J]. International Journal of Pharmaceutics, 2018, 535(1/2): 379-392.
[3]JUNGHANN J U.Nanocrystal technology, drug delivery and clinical applications[J].International Journal of Nanomedicine,2008,3(3):295-309.
[4]刘阳,谢锦,许俊男,等.药物固体纳米晶体稳定性关键影响因素的研究进展[J].中国医药工业杂志,2018,49(8):1073-1082.
[5]KARADAG A, OZCELIK B, HUANG Q.Quercetin nanosuspensions produced by high-pressure homogenization[J].Journal of Agricultural & Food Chemistry,2014, 62(8):1852-1859.
[6]SHEGOKAR R, MULLER R H.Nanocrystals: industrially feasible multifunctional formulation technology for poorly soluble actives[J].International Journal of Pharmaceutics,2010,399(1/2):129-139.
[7]马静,王晓青,李翔,等.药物纳米晶体混悬液的给药途径的研究进展[J].中国药学杂志,2012,47(24):1965-1970.
[8]冯文超,张雯雯,冀雅文,等.超细粉体表征方法及应用进展[J].化学工程师,2014,28(3):33-35.
[9]于世华,王洁,陈萍,等.表面活性剂辅助抗溶剂法制备缬沙坦超微粉体[J].化工技术与开发,2014,43(12):20-21,47.
[10]刘治刚,孙丽娜,王建刚,等.超声波辅助抗溶剂法制备盐酸吡格列酮超微粉体[J].中国粉体技术,2015,21(3):29-32.
[11]陈博,黄永鹏,钟辉,等.高压均质法制备枸橼酸喷托维林纳米颗粒[J].中国粉体技术,2016,22(2):18-21.
[12]张熹,金方.纳米结晶在难溶性药物口服给药中的应用[J].中国医药工业杂志,2009, 40(11): 851-855.
[13]殷海翔,徐元龙,王永禄,等.药物纳米结晶的研究进展[J].中国医药工业杂志,2013,44(6):625-629.
[14]GAO L,LIU G Y,MA J L,et al.Application of drug nanocrystal technologies on oral drug delivery of poorly soluble drugs[J].Pharmaceutical Research,2013,30(2):307-324.
[15]SHETE G, JAIN H, PUNJ D, et al.Stabilizers used in nanocrystal based drug delivery systems[J]. Excip Food Chem ,2014,5(4):184-209.
[16]MOSCHWITZER J.Spray coated pellets as carrier system for mucoadhesive drug nanocrystals[J].European Journal of Pharmaceutics and Biopharmaceutics, 2006, 62(3): 282-287.
[17]DUCHENE D, PONCHEL G.Bioadhesion of solid oral dosage forms,why and how[J].European Journal of Pharmaceutics and Biopharmaceutics, 1997, 44(1): 15-23.
[18]DODOU D, BREEDVEID P, WIERINGA P A. Mucoadhesives in the gastrointestinal tract: revisiting the literature for novel applications[J]. European Journal of Pharmaceutics and Biopharmaceutics, 2005, 60(1): 1-16.
[19]SMART J D. The basics and underlying mechanisms of mucoadhesion[J]. Advanced Drug Delivery Reviews, 2005, 57(11): 1556-1568.
[20]LI X M, GU L, XU Y L, et al. Preparation of fenofibrate nanosuspension and study of its pharmacokinetic behavior in rats[J]. Drug Development and Industrial Pharmacy, 2009, 35(7): 827-833.
[21]JACOBS C,KAYSER O.Production and characterisation of mucoadhesive nanosuspensions for the formulation of bupravaquone[J]. International Journal of Pharmaceutics, 2001, 214(1/2): 3-7.
[22]马月琴, 张增珠, 李刚, 等. 纳米晶体技术及其靶向递药应用研究进展[J]. 中国医院药学杂志, 2018, 38(9): 1014-1017.
[23]HAO L L, WANG X Y, ZHANG D R, et al. Studies on the preparation, characterization and pharmacokinetics of Amoitone B nanocrystals[J]. International Journal of Pharmaceutics, 2012, 433(1/2): 157-164.
[24]HAN M H, LIU X L, GUO Y F, et al. Preparation, characterization, biodistribution and antitumor efficacy of hydroxycamptothecin nanosuspensions[J]. International Journal of Pharmaceutics, 2013, 455(1/2): 85-92.
[25]TALEKAR M, GANTA S, AMIJI M, et al. Development of PIK-75 nanosuspension formulation with enhanced delivery efficiency and cytotoxicity for targeted anti-cancer therapy[J]. International Journal of Pharmaceutics, 2013, 450(1/2): 278-289.
[26]FUHRMANN K, POLOMSKA A, AEBERLI C, et al. Modular design of redox-responsive stabilizers for nanocrystals[J]. ACS nano, 2013, 7(9): 8243-8250.
[27]SHAFIU K A, ISMAIL M, TENGKU I T. A pH-sensitive, biobased calcium carbonate aragonite nanocrystal as a novel anticancer delivery system[J].BioMed Research International, 2013, 2013: 587451-587460.
[28]LIU Y, MA Y Q, XU J N, et al. Apolipoproteins adsorption and brain-targeting evaluation of baicalin nanocrystals modified by combination of Tween80 and TPGS[J].Colloids and Surfaces. B: Biointerfaces,2017,160:619-627.
[29]RAVAL A J, PATEL M M. Preparation and characterization of nanoparticles for solubility and dissolution rate enhancement of meloxicam[J]. International Research Journal of Pharmaceuticals, 2011, 1(2): 42-49.
[30]缐海. 超细粉体及超细粉碎技术简述[J]. 新疆有色金属, 2013, 36(S1): 103-104.
[31]申盛伟, 汪洋, 朱兵兵, 等. 超细粉体制备技术研究进展[J]. 环境工程, 2014, 32(9): 102-105, 124.
[32]SINHA B, MULLER R H. Bottom-up approaches for preparing drug nanocrystals: formulations and factors affecting particle size[J]. International Journal of Pharmaceutics, 2013, 453(1): 126-141.
[33]刘肖, 刘娟, 庞建云, 等. 微型化介质研磨法制备槲皮素纳米混悬剂[J]. 中国中药杂志, 2017, 42(15): 2984-2988.
[34]LIU T, YAO G L, LIU X T, et al. Preparation nanocrystals of poorly soluble plant compounds using an ultra-small-scale approach[J].AAPS Pharm Sci Tech, 2017, 18(7): 2610-2617.
[35]MALAMATARI M, SOMAVARAPU S, KACHRIMANISK, et al. Preparation of respirable nanoparticle agglomerates of the low melting and ductile drug ibuprofen: impact offormulation parameters[J]. Powder Technol, 2017, 38: 123-134.
[36]NIWA T, DANJO K.Design of self-dispersible dry nano-suspension through wet milling and spray freeze-drying for poorly water-soluble drugs[J].European Journal of Pharmaceutical Sciences, 2013, 50(3/4): 272-281.
[37]KUMAR S, SHEN J, ZOLNIK B, et al. Optimization and dissolution performance of spray-dried naproxen nano-crystals[J]. International Journal of Pharmaceutics, 2015, 486(1/2): 159-166.
[38]TOZIPOULOU F, MALAMATARI M, NIKOLAKAKIS I. Production of aprepitant nanocrystals by wet media milling and subsequent solidification[J]. International Journal of Pharmaceutics, 2017, 533(2): 324-334.
[39]ZUO B, SUN Y, LI H, et al. Preparation and in vitro/in vivo evaluation of fenofibrate nanocrystals[J]. International journal of pharmaceutics, 2013, 455(1/2): 267-275.
[40]SYLVESTRE J P, TANG M C, FURTOS A, et al. Nanonization of megestrol acetate by laser fragmentation in aqueous milieu[J]. Journal of Controlled Release, 2011, 149(3): 273-280.
[41]TOZIOPOULOU F,MALAMATARI M,NIKOLAKAKIS I.Production of aprepitant nanocrystals by wet media milling and subsequent solidification[J].International Journal of Pharmaceutics, 2017, 533(2): 324-334.
[42]HONG C,DANG Y,LIN G,et al.Effects of stabilizing agents on the development of myricetin nanosuspension and its characterization: an in vitro and in vivo evaluation[J].International Journal of Pharmaceutics,2014,477(1/2):251-260.
[43]SHEN B,WU N,SHEN C,et al.Hyperoside nanocrystals for HBV treatment: process optimization, in vitro and in vivo evaluation[J].Drug Development and Industrial Pharmacy,2016,42(11):1772-1781.
[44]YUE P F,LI Y,WAN J,et al.Process optimization and evaluation of novel baicalin solid nanocrystals[J].International Journal of Nanomedicine,2013,8:2961-2973.
[45]何小龙,宋红萍.柚皮素纳米晶体的制备及体外性质研究[J].中国医院药学杂志,2016,36(4):289-293.
[46]GAO L,ZHANG D R,CHEN M H,et al.Preparation and characterization of an oridonin nanosuspension for solubility and dissolution velocity enhancement[J].Drug Development and Industrial Pharmacy,2007,33(12):1332-1339.
[47]沈成英,申宝德,徐平华,等.灵芝三萜纳米混悬凝胶剂的制备及其体外透皮研究[J]. 中草药,2014,45(19):2770-2775.
[48]张彩云,袁慧玲,易加明,等.姜黄素纳米混悬剂的制备及体外释放研究[J].中国药学杂志,2014,49(21):1917-1922.
[49]ZHANG X,GUAN J,NI R,et al.Preparation and solidification of redispersible nanosuspensions[J].Journal of Pharmaceutical Sciences, 2014, 103(7): 2166-2176.
[50]YI Y N,TU L X,HU K L,et al.The construction of puerarin nanocrystals and its pharmacokinetic and in vivo-in vitro correlation (IVIVC) studies on beagle dog[J].Colloids and Surfaces B: Biointerfaces,2015,133:164-170.
[51]YUE P F, WANG C H, DAN J X, et al. The importance of solidification stress on the redispersibility of solid nanocrystals loaded with harmine[J]. International Journal of Pharmaceutics, 2015, 480(1/2): 107-115.
[52]XU J N,MA Y Q,XIE Y B,et al.Design and evaluation of novel solid self-nanodispersion delivery system for andrographolide[J].AAPS Pharm Sci Tech,2017,18(5):1572-1584.
[53]蒋爱,李国源,王鑫,等.星点设计-效应面法优化紫杉醇-白桦脂酸混合纳米混悬剂[J].中草药,2019(4):852-859.
[54]陈敏,赵亮,郑爱萍,等.紫杉醇纳米晶混悬液的制备及表征[J].中国现代应用药学,2016,33(9):1097-1102.
[55]PATEL K,PATIL A,MEHTA M,et al.Oral delivery of paclitaxel nanocrystal (PNC) with a dual Pgp-CYP3A4 inhibitor: preparation, characterization and antitumor activity[J].International Journal of Pharmaceutics,2014,472(1/2):214-223.
[56]陈亚军.齐墩果酸纳米悬浮液研究[D].湖北:华中科技大学 生命科学与技术学院,2005.
[57]刁依娜,蒋学华,邓璐霞,等.胡椒碱-阿霉素复合物合成及抗肿瘤研究[J].西部医学,2015,27(1):117-120.
[58]岳鹏飞,王勇,万晶,等.固体纳米晶体给药系统构建方法的研究进展[J].药学学报, 2012(9):1120-1127.
[59]DOUROUMIS D.Stable carbamazepine colloidal systems using the cosolvent technique[J].European Journal of Pharmaceutical Sciences,2007,30(5):367-374.
[60]陈嘉敏.氢氯噻嗪缬沙坦纳米结晶制备与药动学评价[D].广东:广东药科大学 中药学院,2016.
[61]丁云娜,康彬,王健.雾化吸入用布地奈德纳米混悬液的制备及体外评价[J].中国医药工业杂志,2017,48(8):1131-1137.
[62]ZHANG H,MENG Y,WANG X Q,et al.Pharmaceutical and pharmacokinetic characteristics of different types of fenofibrate nanocrystals prepared by different bottom-up approaches[J].Drug Delivery,2014,21(8):588-594.
[63]ZHANG J J,HUANG Y T,LIU D P,et al.Preparation of apigenin nanocrystals using supercritical antisolvent process for dissolution and bioavailability enhancement[J].European Journal of Pharmaceutical Sciences,2013,48(4/5):740-747.
[64]DE WAARD H,HINRICHS W L.A novel bottom-up process to produce drug nanocrystals: controlled crystallization during freeze-drying[J].Journal of Controlled Release,2008,128(2):179-183.
[65]胡盛福,宋胜杰,丁泽杰,等.药物共晶制备方法研究进展[J].浙江化工,2018,49(7):1-3,15.
[66]徐大国,蒋成君,王玉洁.药物共晶制备新技术研究进展[J].浙江化工,2019,50(2):21-26.
[67]周新波,吴素香,孙梦莹,等.中药难溶性有效成分共晶的研究进展[J].中草药,2016,47(2):336-343.
[68]谢燕.难溶性成分药物共晶的制备与评价:以杨梅素为例[C]//2017年第十一届中国药物制剂大会暨中国药学会药剂专业委员会学术年会暨国际控释协会中国分会年会暨纳米药物及纳米生物技术学术大会暨亚洲阿登制药技术研讨会论文集.上海:中国药学会,2017:2.
[69]MOSCHWITZER J.New method for the effective production of ultrafine drug nanocrystals[J].Journal of Nanoscience and Nanotechnology,2006,6(9/10):3145-3153.
[70]SALAZAR J,GHANEM A,MULLER R H.Nanocrystals: comparison of the size reduction effectiveness of a novel combinative method with conventional top-down approaches[J].European Journal of Pharmaceutics and Biopharmaceutics,2012,81(1):82-90.
[71]靳世英,袁海龙,靳士晓,等.黄芩苷纳米晶体微丸的制备及其药代动力学初步研究[J].中国中药杂志,2013,38(8):1156-1159.
[72]谢燕瑾,俞婷婷,楼炜.人参皂苷Rg3纳米晶体的制备及抗肿瘤作用[J].医药导报,2016,35(11):1186-1189.
[73]CHAUBAL M V. Conversion of nanosuspensions into dry powders by spray drying: a case study[J]. Pharmaceutical Research, 2008, 25(10): 2302-2308.
[74]ZHANG J J,LV H X,JIANG K.Enhanced bioavailability after oral and pulmonary administration of baicalein nanocrystal[J].International Journal of Pharmaceutics,2011,420(1):180-188.
[75]徐浩,高艺璇,王向涛.槲皮素纳米混悬剂的制备、表征及抗乳腺癌研究[J].中草药,2019,50(1):42-51.
[76]SHEN G, CHENG L, WANG L Q, et al. Formulation of dried lignans nanosuspension with high redispersibility to enhance stability, dissolution, and oral bioavailability[J]. Chinese Journal of Natural Medicines, 2016, 14(10): 757-768.
[77]LI Y,WANG Y,YUE P F,et al.A novel high-pressure precipitation tandem homogenization technology for drug nanocrystals production-a case study with ursodeoxycholic acid[J].Pharmaceutical Development and Technology,2014,19(6):662-670.
[78]MARTENA V, SHEGOKAR R, DI MARTINO P. Effect of four different size reduction methods on the particle size, solubility enhancement and physical stability of nicergoline nanocrystals[J]. Drug Development and Industrial Pharmacy, 2014, 40(9): 1199-1205.
[79]赵涵,戎欣玉,刘爽,等.柚皮素纳米晶体的制备及药剂学性质研究[J].中草药,2018,49(13):3026-3032.
[80]朱立俏, 盛华刚, 韩真真,等. 蟾毒灵纳米混悬液对HepG2细胞增殖及细胞摄取研究[J]. 山东中医杂志, 2018, 37(6): 517-520.
[81]崔福德.尼群地平药物结晶的尺寸对生物利用度的影响[C]//中国颗粒学会颗粒制备与处理专业委员会.颗粒学前沿问题研讨会——暨第九届全国颗粒制备与处理研讨会论文集.山东,威海:中国颗粒学会颗粒制备与处理专业委员会,2009:7.
[82]LU Y,WANG Z H,LI T L,et al. Development and evaluation of transferrin-stabilized paclitaxel nanocrystal formulation[J].Journal of Controlled Release,2014,176:76-85.
[83]MORAKUL B,SUKSIRIWORAPONG J,CHOMNAWANG M T,et al.Dissolution enhancement and in vitro performance of clarithromycin nanocrystals produced by precipitation-lyophilization-homogenization method[J].European Journal of Pharmaceutics and Biopharmaceutics,2014,88(3):886-896.
[84]SCHOLZ P,ARNTJEN A,MULLER R H.ARTcrystal process for industrial nanocrystal production-optimization of the ART MICCRA pre-milling step[J].International Journal of Pharmaceutics,2014,465(1/2):388-395.
[85]刘罗娜,李小芳,仲粒,等.以甘草酸为稳定剂制备黄芩苷固体纳米晶体[J].中草药, 2019,50(9):2057-2064.
[86]CHEN M L,JOHN M,LEE S L,et al.Development considerations for nanocrystal drug products[J].The AAPS Journal,2017,19(3):642-651.
[87]王绍花, 牛余珍, 张元元, 等. 纳米混悬技术提高中药难溶性成分溶解度的研究进展[J]. 山东中医杂志, 2018, 37(7): 619-622.