缬沙坦氨氯地平片为缬沙坦和苯磺酸氨氯地平的复方制剂,由诺华公司研发,于2007年在欧美上市,商品名为Exforge,2009年在中国上市,商品名为倍博特,适应症为原发性高血压。
氨氯地平是广泛使用的长效钙拮抗剂(calcium channel blockers,CCB),缬沙坦为血管紧张素受体拮抗剂(angiotensin receptor blocker,ARB),CCB联合ARB具有良好的协同降压作用[1-2],也是最常见的二联用药组合[3-7]。缬沙坦氨氯地平片治疗原发性高血压的Meta分析结果表明,其治疗高血压的效果优于其他药物[8]。
缬沙坦在水中几乎不溶,其原料粒度直接影响片剂的溶出速度,从而影响片剂的疗效;缬沙坦原料的静电吸附作用强,在过筛时存在明显的糊筛现象,无法通过筛分法进行粒度控制,需采用激光散射法(湿法)测定[9]。缬沙坦原料具有多晶型现象,报道有无定型和20余种晶型[10-11]。参比制剂原研缬沙坦氨氯地平片在多种溶出介质中的溶出速度不同[12]。由于缬沙坦的低溶解度、低堆密度、强静电等特殊理化性质,湿法制粒制备的缬沙坦氨氯地平片不崩解,需采用与参比制剂原研缬沙坦氨氯地平片相同的干法制粒制备工艺才能达到与原研制剂相近的体外溶出度[12-13]。
前期试验发现更换同一厂家不同批次的缬沙坦原料制备的缬沙坦氨氯地平片溶出存在显著差异,导致与原研药溶出不相似,影响了制剂开发的进度,故此拟对其原因进行研究,并提出解决方案。
1 仪器与试药
G10高效湿法混合制粒机,DP-5干法制粒机,Labcoat Ⅱ高效包衣机(深圳信宜特科技有限公司),ZPW-23旋转式压片机(上海天祺制药机械有限公司)。LC-20AD高效液相色谱仪及Labsolutions CS工作站(日本岛津公司),ZRS-8G溶出仪(天津天大天发公司),XS-105型电子分析天平(梅特勒托利多公司),BT9300激光粒度分析仪(丹东百特仪器有限公司),DX-27mini X射线衍射仪(丹东浩元仪器有限公司),YPD-300D片剂硬度仪(上海黄海药检仪器有限公司),JX-2000A型颗粒图像分析仪(成都精新粉体测试设备有限公司)。
缬沙坦原料(批1,批2,H公司),苯磺酸氨氯地平(C公司)。磷酸二氢钾、氢氧化钠均购自国药集团化学试剂有限公司,乙腈甲醇均为色谱纯,水为纯化水或超纯水。微晶纤维素、交联聚维酮、二氧化硅、硬脂酸镁(安徽山河药用辅料有限公司),欧巴代包衣粉(上海卡乐康包衣技术有限公司)。
2 方法与结果
2.1 缬沙坦氨氯地平片制备
采用2种混合方式对原辅料进行预混,考察预混方式对溶出的影响。
1)筛分混合:取缬沙坦80 g、苯磺酸氨氯地平6.94 g、微晶纤维素54.06 g、交联聚维酮20 g、胶态二氧化硅15 g、硬脂酸镁30 g预混,然后过筛,再继续混合得预混料[13]。
2)剪切混合:取1)筛分混合相同原辅料置于高效湿法混合制粒机中,搅拌转速为4 r/s,切刀转速为30 r/s,分别混合3、 7、 10、 30 min。
预混后采用干法制粒方法将原辅料用干法制粒机碾压成带状物,集成破碎、整粒。随后另取硬脂酸镁15 g与所制颗粒混合。采用直径10 mm圆形冲头压片,控制片剂硬度为70~90 N。采用高效包衣机对素片以欧巴代为包衣材料包衣。
2.2 溶出测定
取原研制剂及自制的待测片剂,按照溶出度与释放度测定法(中国药典2015年版四部通则0931第二法),以磷酸盐缓冲液(pH=4.5)1 000 mL为溶出介质,转速为50 r/min,经过5、 10、 15、 30、 60、 120 min时,取溶液15 mL,并及时补充相同温度和体积的溶出介质,弃去初滤液10 mL,精密量取续滤液2 mL,精密加入2 mL体积分数为50%(下同)的乙腈溶液,摇匀,作为供试品溶液; 另外取苯磺酸氨氯地平对照品和缬沙坦对照品适量,精密称定,加入50%的乙腈溶液溶解并定量稀释制成每1 mL中约含氨氯地平0.1 mg、缬沙坦1.6 mg的混合溶液,作为对照样品母液;精密量取对照品母液2 mL,精密加入2 mL溶出介质,摇匀,作为对照品溶液。按照高效液相色谱法测定,用十八烷基硅烷键合硅胶为填充剂;以乙腈-水-三氟乙酸(体积比为500 ∶500 ∶2)为流动相;流速为1.2 mL/min;检测波长为237 nm;柱温为40 ℃。精密量取上述2种溶液各10 μL,注入液相色谱仪,记录色谱图。按照外标法以峰面积分别计算每片中氨氯地平和缬沙坦的溶出量。
测定2批缬沙坦及不同预混工艺制备的缬沙坦氨氯地平片的溶出,列出10、30、60 min溶出数据并以此计算相似因子f2,结果见表1和表2。
预混工艺采用筛分或剪切混合方式对缬沙坦和氨氯地平的溶出无明显影响。批1缬沙坦原料制备的片剂中两组分与原研制剂缬沙坦氨氯地平片溶出相似(f2>50),而批2缬沙坦原料制备的片剂中两组分溶出均高于原研制剂缬沙坦氨氯地平片。改变筛分1~8次数或剪切时间3~30 min,对两组分的溶出均无明显影响。
表1 预混工艺及原料批次对苯磺酸氨氯地平溶出的影响
Tab.1 Effect of pre-mix process and valsartan batch on dissolution of amlodipine besylate
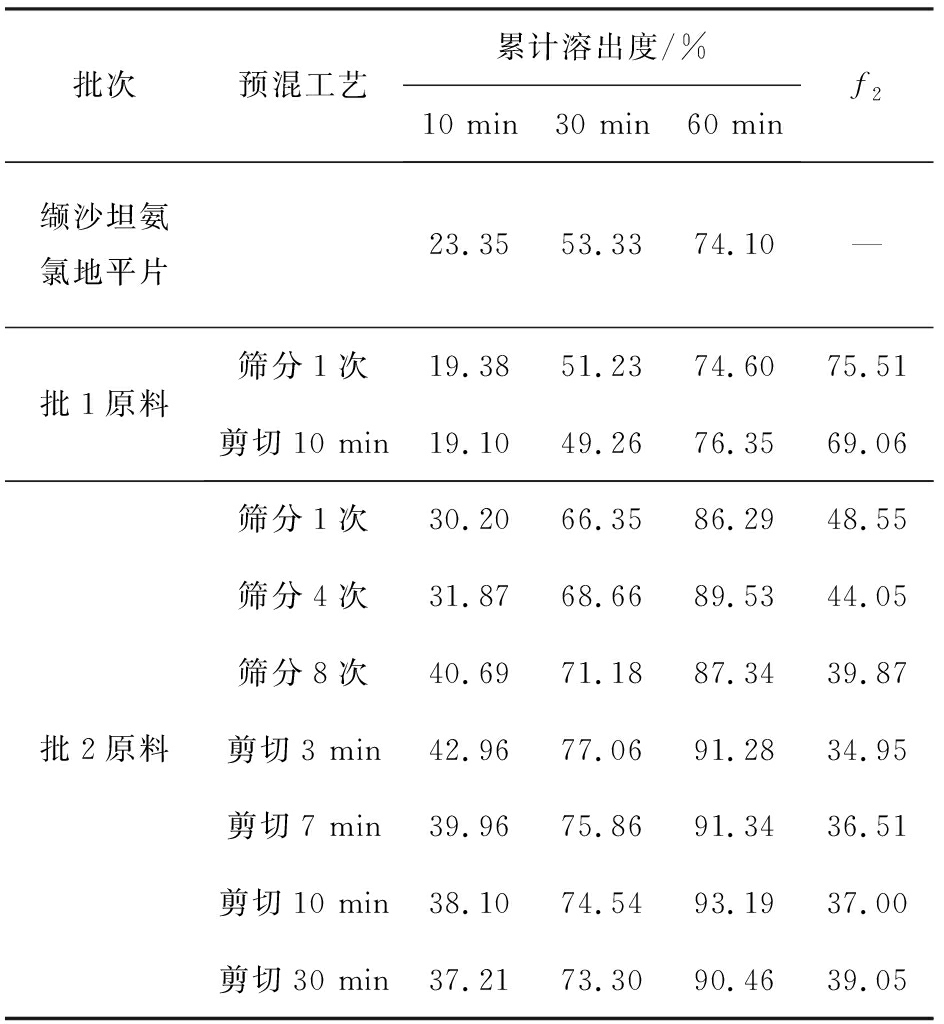
批次预混工艺累计溶出度/%10 min30 min60 minf2缬沙坦氨氯地平片23.3553.3374.10—批1原料筛分1次19.3851.2374.6075.51剪切10 min19.1049.2676.3569.06批2原料筛分1次30.2066.3586.2948.55筛分4次31.8768.6689.5344.05筛分8次40.6971.1887.3439.87剪切3 min42.9677.0691.2834.95剪切7 min39.9675.8691.3436.51剪切10 min38.1074.5493.1937.00剪切30 min37.2173.3090.4639.05
表2 预混工艺及原料批次对缬沙坦溶出的影响
Tab.2 Effect of pre-mix process and valsartan batch on dissolution of valsartan
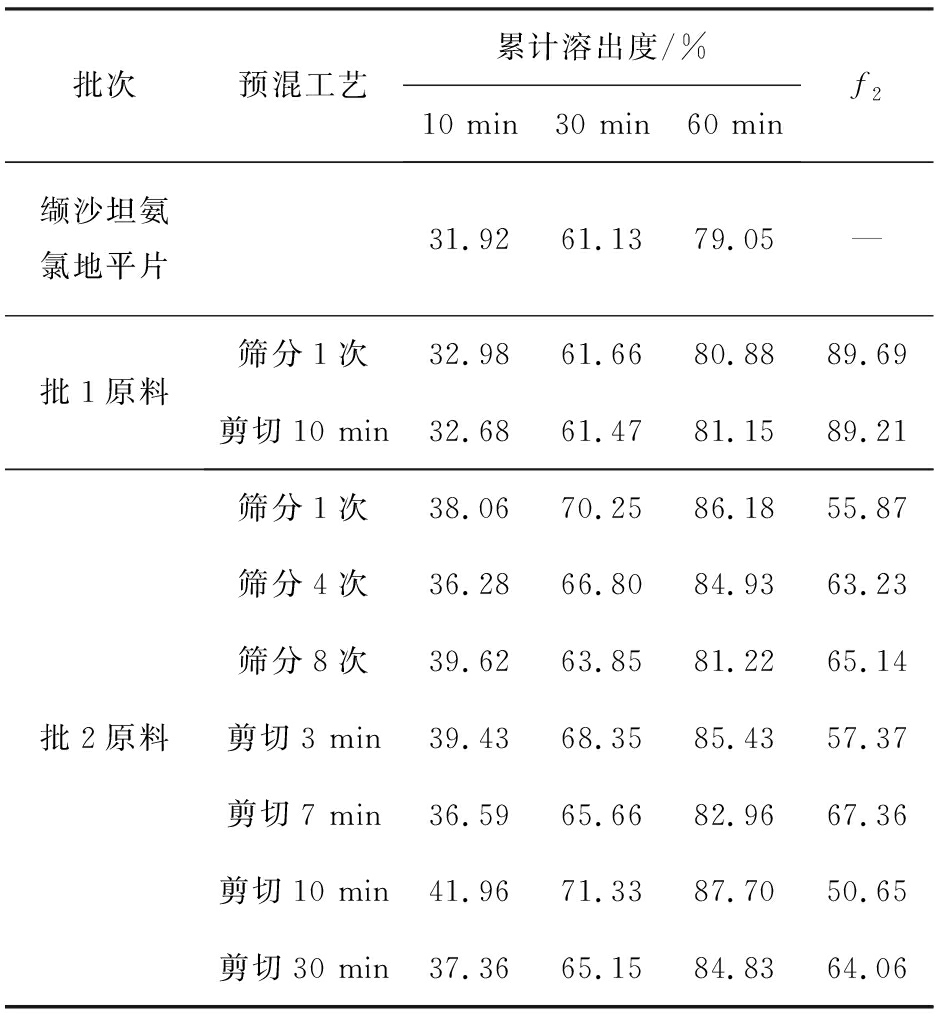
批次预混工艺累计溶出度/%10 min30 min60 minf2缬沙坦氨氯地平片31.9261.1379.05—批1原料筛分1次 32.9861.6680.8889.69剪切10 min32.6861.4781.1589.21批2原料筛分1次38.0670.2586.1855.87筛分4次36.2866.8084.9363.23筛分8次39.6263.8581.2265.14剪切3 min39.4368.3585.4357.37剪切7 min36.5965.6682.9667.36剪切10 min41.9671.3387.7050.65剪切30 min37.3665.1584.8364.06
2.3 粒径测定
称取适量缬沙坦或苯磺酸氨氯地平原料,加入分散介质,质量分数为1%(下同)的十二烷基硫酸钠(SDS)或液体石蜡,振摇并超声15 s制得混悬溶液。仪器空白背景校正后测定样品的粒径分布。结果可见,在分散介质1%的SDS和液体石蜡中缬沙坦2批原料所测粒径均无明显差异,即溶出差异无法用粒径的不同来解释。在液体石蜡中2批缬沙坦原料测得的粒径大小分别为1%的SDS下所测D50值的12.9%和8.6%,具体数值见表3。
表3 缬沙坦和苯磺酸氨氯地平在不同分散介质中的粒径分布
Tab.3 Particle size distribution of valsartan and amlodipine benzenesulfonate in different dispersion media
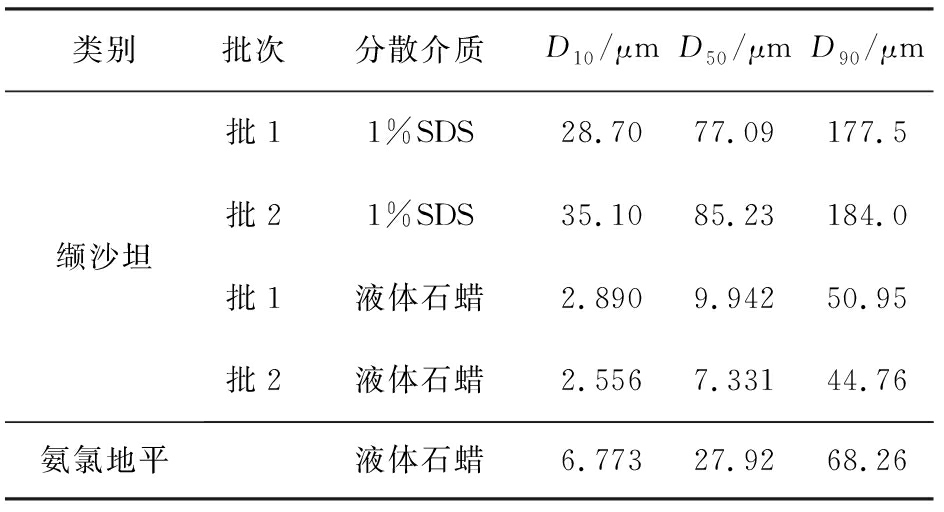
类别批次分散介质D10/μmD50/μm D90/μm 缬沙坦批11%SDS28.7077.09177.5批21%SDS35.1085.23184.0批1液体石蜡2.8909.94250.95批2液体石蜡2.5567.33144.76氨氯地平液体石蜡6.77327.9268.26
2.4 晶型
使用X射线粉末衍射(XRD)仪测定2批缬沙坦晶型,结果可见2批缬沙坦均为无定形,XRD图谱(图1)无明显差异。
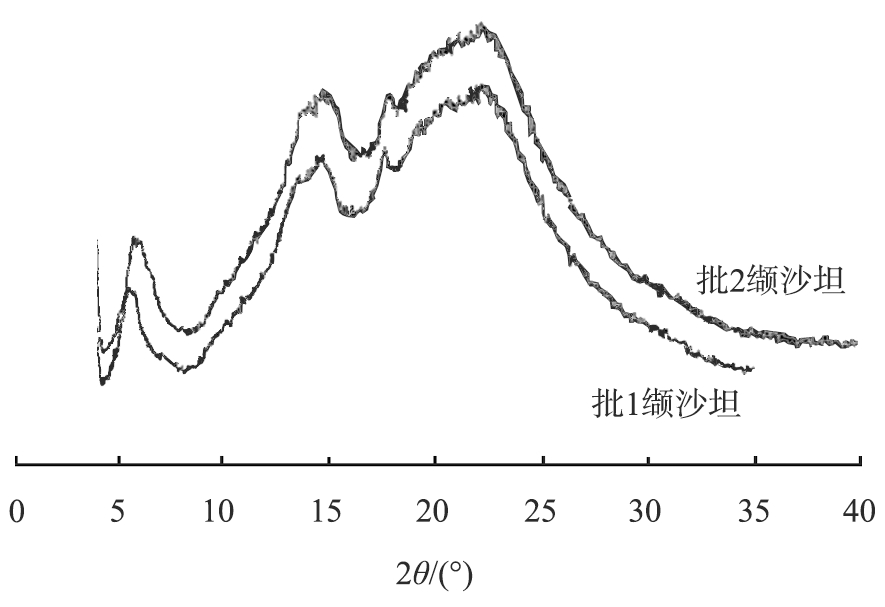
图1 2批缬沙坦原料药的XRD图谱
Fig.1 XRD diagram of two batches of valsartan
2.5 颗粒形貌光学观察
2批缬沙坦粒径、晶型无明显差异,无法解释其中缬沙坦与苯磺酸氨氯地平溶出加快的原因,因此尝试观察颗粒形貌(简称粒形)。取适量缬沙坦、苯磺酸氨氯地平及预混粉末采用颗粒图像分析仪分析,光学显微镜,放大100倍,外加LED光源拍摄反射光图像,结果见图2。 由图可见,2批缬沙坦粒形有明显差异,批1主要为树枝状,而批2主要为团球状。预混粉末的显微图显示,批1制得混合粉均匀细腻,无明显团块,氨氯地平柱状晶型得到良好包覆;而批2制得混合粉有明显缬沙坦团球。

a 批1缬沙坦粉末b 批2缬沙坦粉末c 批1缬沙坦预混料d 批2缬沙坦预混料图2 缬沙坦原料及预混料的光学显微镜图像Fig.2 Microscopy morphology of valsartan and premixture
另取缬沙坦粒径测定溶液置于载玻片上,同法测定,结果见图3。由图可见,在1%的SDS介质中,批1原料在粉末状态下的树枝状消失,批2原料粉末状态下的团球现象消失,均形成无序的粒子聚集,2批缬沙坦在1%的SDS中的粒形无明显差异,与粒径测定结果相一致。而在液体石蜡中,2批缬沙坦均形成极细颗粒,无明显聚集,2批原料间无差异。 此结果验证了液体石蜡中所测粒径约为1%SDS所测粒径1/10的现象,分析原因可能在于液体石蜡对缬沙坦润湿作用较强,颗粒间无聚集现象,所测粒径为一次颗粒的粒径,而1%的SDS中缬沙坦并不能良好分散,所测粒径为凝聚成团的颗粒粒度。
3 讨论
本研究中采用相同厂家的2批缬沙坦原料制备缬沙坦氨氯地平片,2批缬沙坦原料晶型均为无定型,与XRD图谱结果一致; 红外光谱、 熔点、 含量、 杂质等化学指标均一致; 激光粒度测定法测得粒径分布一致。 然而采用相同处方工艺制备的片剂的溶出差异却非常大,为该制剂开发工作带来极大困扰。
缬沙坦颗粒表面带有静电,易聚集,易糊筛,其粒径无法采用激光粒度测定法(干法)和筛分法测定,而应采用激光粒度测定法(湿法)进行控制[9]。 为了解决难溶性原料的疏水性问题,一般会采用加入表面活性剂和超声的方法增加颗粒表面的润湿性,使颗粒均匀分散在介质中。 但是,表面活性剂或者超声往往会使团聚颗粒破裂,因此无法判定所测粒径为原始单个颗粒粒度还是团聚颗粒的粒度[14]。
本试验中缬沙坦粒径采用1%的SDS作为分散介质超声后测定,光学显微图像证实该方法主要解决了缬沙坦疏水问题,未能使颗粒均匀分散,所测粒径为团聚粒度;而采用液体石蜡作为分散介质则解决了分散问题,所测粒径为原始单个颗粒粒度。但是本研究中不论是团聚粒径还是原始粒径,2批原料粒径均未见明显差异,粒径大小无法与溶出度建立相关性,因此还需要结合制剂工艺来研究两者的溶出度差异。
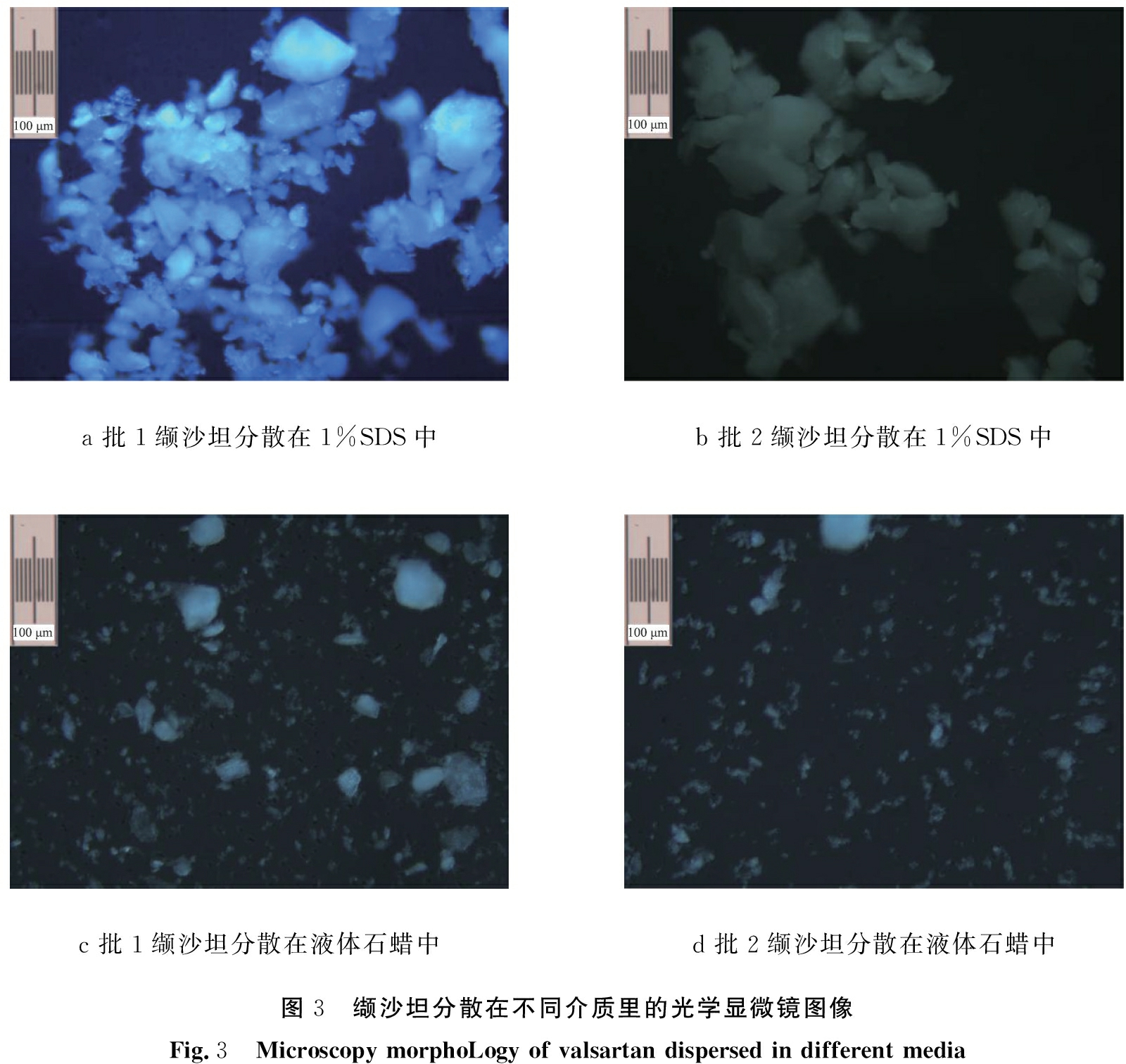
a 批1缬沙坦分散在1%SDS中b 批2缬沙坦分散在1%SDS中c 批1缬沙坦分散在液体石蜡中d 批2缬沙坦分散在液体石蜡中图3 缬沙坦分散在不同介质里的光学显微镜图像Fig.3 Microscopy morphoLogy of valsartan dispersed in different media
原料以固体状态与其他原料的混合包括对流混合、剪切混合、扩散混合3种,本研究采用了2种预混合工艺。扩散混合为粉体颗粒之间相互渗透、掺和,而剪切混合使颗粒断裂产生新的接触面,筛分相对于剪切混合和扩散混合作用力更弱。研究结果发现,采用2种预混方法后2批缬沙坦制备的片剂溶出未见差异。剪切混合切刀转速为300~3 000 r/s,制得颗粒粒径为0.17~0.83 mm(20~80目),在工艺要求的制粒成品粒度范围内[15],对于粒径D50小于0.1 mm的缬沙坦原料已无明显剪切粉碎作用,因此与筛分混合的工艺溶出效果一致。
采用光学显微镜进一步观察缬沙坦的粘结现象。由于缬沙坦及其他辅料均不透明,因此主要采用反射光观察。光学显微图像发现2批缬沙坦原料粒形存在明显差异,批1为树枝状,而批2为团球状。树枝状原料有较大的表面积,粒子相互间粘结力强,其余辅料难以完全阻断其粘结,崩解时易形成团块,溶出较慢。团球状颗粒比表面积小,易被其余辅料阻断粘结,无法形成团块,整体溶出偏快。
由此可见,2批缬沙坦原料虽然激光粒度测定法显示两者具有相同的粒径,但是具有不同的粒型,导致制剂中颗粒形态及缬沙坦原料的分散程度不同,最后导致制剂溶出速度差异。粒型为树枝状的原料制粒时团聚粘结,崩散后成大颗粒,接触溶出介质的面积小,溶出速度降低;反之粒型为团球状的原料制粒时无团聚粘结,崩散后无大颗粒,接触溶出介质的面积大,溶出速度快。
综上所述,对于难溶性药物来说,仅仅通过晶型、粒径的控制往往无法精准地控制原料质量,有必要增加粒形控制项。然而粒形控制目前尚无法量化,这是限制其广泛应用的主要缺陷。原料质量可以通过其他的方法进行控制,一是改进的粒度测定法,使得所测粒径 与制剂溶出有明确相关性;二是采用比表面积测定,建立比表面积与制剂溶出的相关性;同时也需要考虑制剂过程对粒子形态以及表面积的影响。
[1]国家卫生计生委合理用药专家委员会. 高血压合理用药指南[J]. 中国医学前沿杂志(电子版), 2017,9(7):28-126.
[2]徐向宇. 缬沙坦联合氨氯地平治疗社区老年原发高血压合并糖尿病的价值评价[J]. 当代医学, 2019,25(4):170-171.
[3]黄粤锋, 陈钰仪, 肖惠珍,等. 高血压联合治疗优化方案探讨[J]. 中外医疗, 2008,27(18):30-31.
[4]胡靖. 老年高血压患者用药情况的分析与研究[J]. 北方药学, 2017, 14(11):181-182.
[5]张妮, 刘蔚. 门诊高血压患者联合用药的调查分析[J]. 中国临床医生杂志, 2015,43(6):48-50.
[6]JIA G X, YU J M, LIN F L, et al. Investigation of drug use in newly-diagnosed hypertensive outpatients in secondary and tertiary hospitals in China[J]. Chinese Journal of Hypertension, 2013, 21(9): 843-847.
[7]林海勇. 降压药物联用方案的比较和评价[J]. 世界最新医学信息文摘, 2015,15(27):83-84.
[8]李丹, 张灵健, 刘美, 等. 复方制剂缬沙坦-氨氯地平治疗原发性高血压meta分析[J]. 中国公共卫生, 2018,34(2):305-309.
[9]耿志鹏, 姜鹰雁, 李永东, 等. 缬沙坦原料药粒度的激光散射法测定[J]. 中国医药工业杂志, 2017,48(5):716-719.
[10]张娜, 黄海伟, 林兰, 等. 心血管系统治疗药物的晶型研究进展[J]. 现代药物与临床, 2014,29(6):690-695.
[11]王清清. 缬沙坦结晶过程研究[D]. 杭州:浙江工业大学, 2016.
[12]董萱, 陆步实, 周立新, 等. 缬沙坦氨氯地平片处方工艺筛选及溶出度评价[J]. 南京工业大学学报(自然科学版), 2012, 34(4): 128-132.
[13]JOSHI Y, WAGNER R F, PUDIPEDDI M, et al. Solid dosage forms of valsartan and amlodipine and method of making same:中国:101237859[P]. 2008-08-06.
[14]陈祝康, 陈桂良, 李慧义, 等. 药物及其制剂粒度测定法探讨[J]. 中国药品标准, 2012,13(6):405-408.
[15]查国才. 湿法混合制粒的特点与高速混合制粒机的制造要求[J]. 机电信息, 2005(8):44-46.