氮、磷超标废水过量排放会造成水体富营养化、地下水污染,废水中氮、磷的深度处理是亟须解决的难题。氮、磷是有机体生长的必要元素,磷也是一种不可再生资源,因此如何在降低废水中氮、磷浓度的同时,有效回收氮、磷资源成为了废水处置的一种新思路。磷酸铵镁(MAP),俗称鸟粪石,化学式为MgNH4PO4·6H2O,中性或碱性条件下微溶于水。当溶液体系中同时存在![]() 一定条件下便会生成磷酸铵镁晶体[1]。基于这一特性,磷酸铵镁结晶法得到了广泛关注,并成功应用于多种废水的处置中[2]。该方法不仅能以沉淀的形式去除废水中的氨氮、磷酸盐,产物磷酸铵镁也是一种优良的缓释肥[3]。磷酸铵镁晶体细小、难以回收的特点制约了其工业化的发展,因此磷酸铵镁晶体异相成核、定向生长、晶粒尺度控制非常关键[4]。另一方面,磷酸铵镁结晶过程中需要合适的外加镁源,目前常用的有MgCl2、MgSO4、MgO、Mg(OH)2等,其中Mg(OH)2成本最低且自带碱性,但其在水中的溶解度较低[5],纳米结构Mg(OH)2虽具备良好的反应活性,然而粒径细小极易流失,且反应过程中易发生团聚。在大块体多孔矿物基体上原位沉积纳米级Mg(OH)2,可有效解决这一问题。已有的研究表明,合适的天然多孔矿物材料也可作为磷酸铵镁载体,是弥补其晶体细小、难以回收这一缺陷的有效方法[6-8]。
一定条件下便会生成磷酸铵镁晶体[1]。基于这一特性,磷酸铵镁结晶法得到了广泛关注,并成功应用于多种废水的处置中[2]。该方法不仅能以沉淀的形式去除废水中的氨氮、磷酸盐,产物磷酸铵镁也是一种优良的缓释肥[3]。磷酸铵镁晶体细小、难以回收的特点制约了其工业化的发展,因此磷酸铵镁晶体异相成核、定向生长、晶粒尺度控制非常关键[4]。另一方面,磷酸铵镁结晶过程中需要合适的外加镁源,目前常用的有MgCl2、MgSO4、MgO、Mg(OH)2等,其中Mg(OH)2成本最低且自带碱性,但其在水中的溶解度较低[5],纳米结构Mg(OH)2虽具备良好的反应活性,然而粒径细小极易流失,且反应过程中易发生团聚。在大块体多孔矿物基体上原位沉积纳米级Mg(OH)2,可有效解决这一问题。已有的研究表明,合适的天然多孔矿物材料也可作为磷酸铵镁载体,是弥补其晶体细小、难以回收这一缺陷的有效方法[6-8]。
海泡石(sepiolite,NSEP)是一种天然富镁硅酸盐黏土矿物,化学式为Mg8(H2O)4[Si6O15]2(OH)4·8H2O,具有层状和链状的过渡型结构特征,独特的孔道结构决定了海泡石拥有优良的吸附性能和较好的流变性能[9],是一种理想的磷酸铵镁载体。海泡石虽为富镁硅酸矿物,其自身镁反应活性较低,较难为磷酸铵镁结晶提供活性镁源,但作为原位沉积Mg(OH)2基材具有组分和结构优势,同时能作为晶种促进磷酸铵镁晶体发育[10]。
本文中以MgCl2为镁源,以氨水为沉淀剂,以十二烷基苯磺酸钠(SDBS)为模板剂,采用水热法在海泡石矿物表面原位生长纳米结构Mg(OH)2,以其同步回收废水中的氮、磷,考察各种实验条件对氮磷回收效果影响规律,并探讨其回收机制。
1 实验
1.1 原料和试剂
海泡石产自河北省易县,SiO2含量为58.6%(质量分数,下同),MgO含量为29.6%,CaO含量为7.3%。
六水氯化镁、磷酸二氢钠、氨水、盐酸(分析纯,国药集团化学试剂有限公司);十二烷基苯磺酸钠、氯化铵、氢氧化钠(分析纯,北京化学试剂厂)。
1.2 样品制作
称取5.0 g的MgCl2·6H2O于30 mL去离子水中溶解;称取5.0 g的NSEP于装有40 mL质量分数为25%氨水的烧杯中,并投加0.5 g的SDBS,置于水浴锅中室温搅拌20 min,制得海泡石悬浊液。向海泡石悬浊液中缓慢滴加MgCl2溶液,待滴加完毕,将海泡石悬浊液移入蒸压釜,置于烘箱中,160 ℃水热反应4 h,冷却、过滤,反复洗涤3~4次,干燥,制得样品,标记为MSEP。
1.3 样品表征
利用日立570型扫描电镜(日本电子株式会社)观察样品显微形貌并用能谱仪对样品进行微区成分分析;利用Hitachi H-9000NAR型透射电镜(日本电子株式会社)观察样品微观形貌;利用ASAP2020型比表面积测试仪(美国贝克曼库尔特公司)测定样品比表面积;利用D/MAX-Ⅱ型X射线衍射仪(日本电子株式会社)对样品进行物相分析;用珀金埃尔默1730型红外光谱仪(德国Bruker公司)测红外光谱。
1.4 废水中氮磷的回收
在去离子水中溶解一定质量的NH4Cl、NaH2PO4·2H2O,配置初始质量浓度为120 mg/L的![]() 溶液。称取一定质量的MSEP,投加到装有100 mL模拟废水的200 mL烧杯中,用稀HCl和NaOH调节pH值,25 ℃恒温水浴搅拌一定时间,转速为180 r/min,静置0.5 h,取上清液测试氨氮、总磷质量浓度,抽滤,沉淀产物于40 ℃烘箱中烘干。
溶液。称取一定质量的MSEP,投加到装有100 mL模拟废水的200 mL烧杯中,用稀HCl和NaOH调节pH值,25 ℃恒温水浴搅拌一定时间,转速为180 r/min,静置0.5 h,取上清液测试氨氮、总磷质量浓度,抽滤,沉淀产物于40 ℃烘箱中烘干。
1.5 数据分析
总磷质量浓度测定采用GB 11893—1989钼酸铵分光光度法;氨氮质量浓度测定采GB 11893—1989纳氏试剂分光光度法。
按式(1)、 (2)计算MSEP对模拟废水中氨氮、总磷平衡吸附容量qe和去除率R。
qe=(c0-ce)V/m,
(1)
R=[(c0-ce)/c0]×100%,
(2)
式中:qe为平衡吸附量,mg/g;c0和ce为分别为初始质量浓度和平衡质量浓度,mg/L;V为溶液体积;m为MSEP投加质量;R为去除率。
2 结果与讨论
2.1 物相及显微结构分析
图1所示为NSEP、 MSEP的XRD图谱。 其中,7.370 °(110)处为海泡石特征峰,样品伴生杂质主要为滑石,对应特征峰为9.543 °(002)和28.902 °(006),化学式为Mg3Si4O10(OH)2。 MSEP样品在18.602 °(001)、 38.049 °(011)、 50.894 °(012)、 58.722 °(110)附近新出现4处高强度衍射峰,与Mg(OH)2标准卡片(JCPDS PDF#76-0667)高度吻合,判定为Mg(OH)2特征衍射峰。
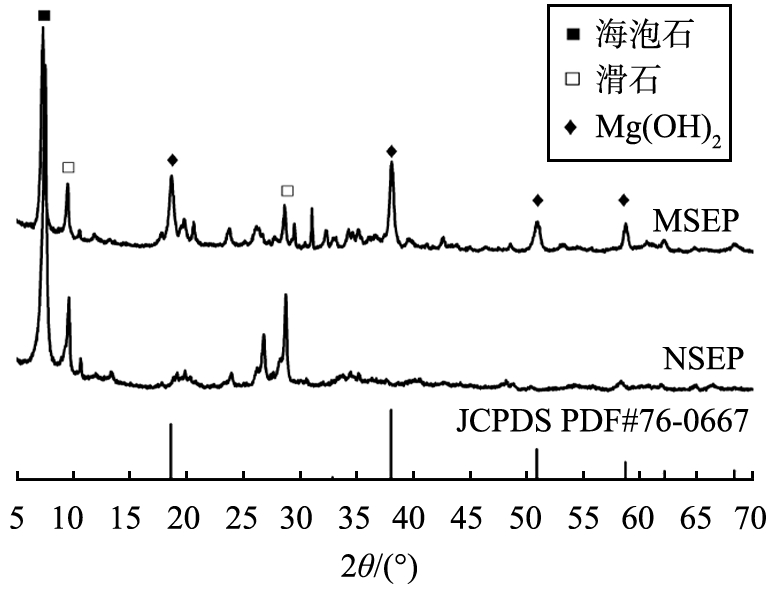
图1 NSEP、MSEP的XRD图谱
Fig.1 XRD patterns of NSEP and MSEP
图2a为天然海泡石SEM图像,海泡石纤维表面光滑,互相交叉形成纤维网络构架。 图2b为MSEP前驱体形貌,可见纤维表面负载有颗粒状团聚体,视野放大后显示该小颗粒由不规则片状体组成,这是由于常温条件下合成的Mg(OH)2极性面(011)显露较多。 图2c—d为MSEP形貌,海泡石纤维表面包覆有均匀分布的六角片状纳米结构晶体,结合图3a样品TEM图像, 清晰表现出MSEP是由Mg(OH)2原位生长于海泡石形成的纤维簇。 由于Mg(OH)2在水热环境中晶面生长速率存在差异,极性较弱晶面(001)沿六角形面方向得到充分生长,并抑制极性较强的晶面(011)生长[11],(001)晶面更易显露,因此团聚态前驱体经过溶解-重结晶过程实现结构重整,最终形成六角片状形貌。 图3b中,样品的HRTEM图像可清晰看到晶格间距不等的衍射条纹,其衍射晶面间距为0.236 0 nm,与Mg(OH)2 标准卡片(JCPDS PDF#76-0667)的(011)晶面间距相符合,其SAED衍射图案呈电子衍射环状,表明所合成Mg(OH)2纳米片为多晶结构。
图4为NSEP和MSEP氮气吸附脱等温线及其孔径分布图。由图可知,NSEP和MSEP均表现为IV型氮气吸附,具有H3滞后回环,表明存在狭缝状介孔结构,样品孔径分布均集中在0~20 nm之间。相对压力在0.9~1.0时未出现吸附平台,可归因于片状颗粒的聚集[12]。NSEP和MSEP样品比表面积分别为55.0、78.5 m2·g-1,表明海泡石纤维负载有纳米结构Mg(OH)2后变得粗糙,使得比表面积增加,有助于对氨氮、磷酸盐的吸附。

图2 NSEP、MSEP前驱体、MSEP样品SEM图像
Fig.2 SEM images of NSEP, precursor of MSEP and MSEP samples

图3 MSEP样品衍射图像
Fig.3 Diffraction images of MSEP
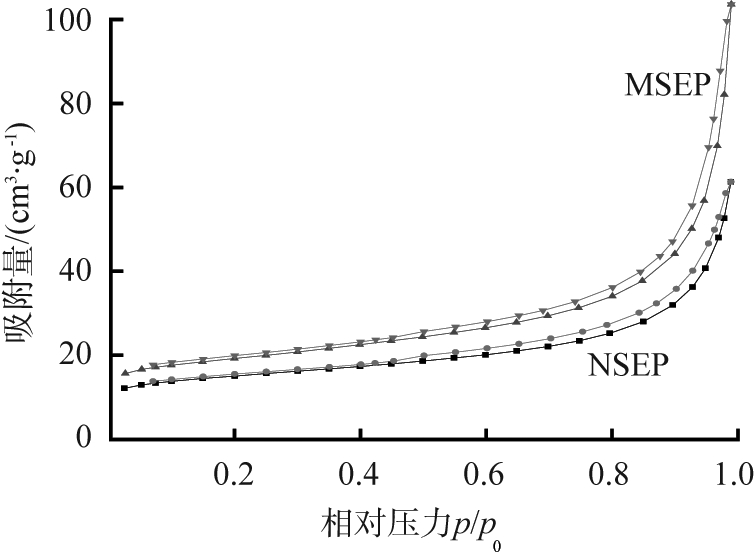
a 氮气吸附脱附等温线
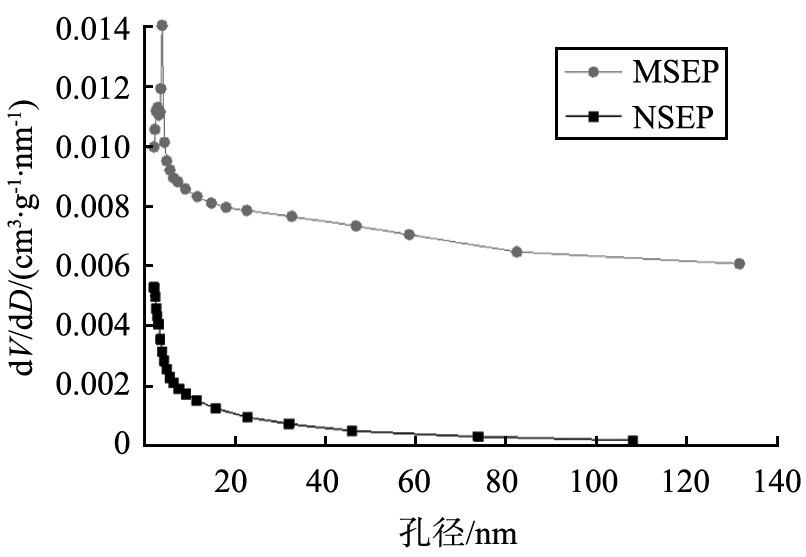
b 孔径分布
图4 NSEP和MSEP氮气吸附脱等温线及其孔径分布
Fig.4 N2 adsorption-desorption isotherms and pore-size distribution of NSEP and MSEP
2.2 MSEP回收废水中氮磷实验条件优化
2.2.1 投加量的影响
图5为在溶液初始pH值为7.5、 反应时间为40 min的条件下,MSEP投加量对平衡吸附量qe和去除率R的影响。 由图可以看出,投加量在0.2~1.0 g/L范围内,随着投加量的增加,氨氮、磷酸盐的去除率迅速增大,对应的平衡吸附量基本维持不变,投加量达到1.0 g/L之后,氨氮、磷酸盐的去除率分别达到51.8%和95.1%,此时MSEP对氨氮、磷酸盐的平衡吸附量分别为62.16、114.12 mg/g;随着投加量的继续增加,两者去除率变化不大,相应平衡吸附量则明显回落,因此MSEP的最佳投加量可确定为1.0 g/L。
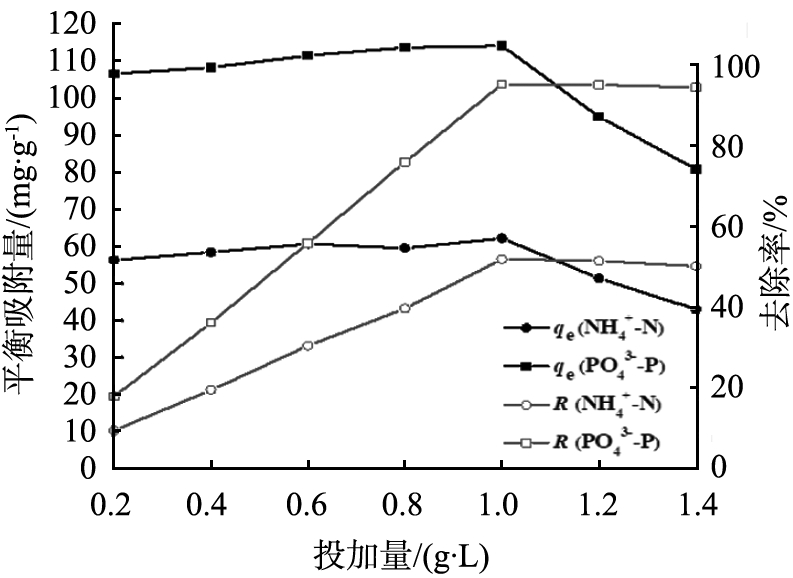
图5 MSEP投加量对平衡吸附量qe和去除率R的影响
Fig.5 Effect of MSEP dosage on equilibrium adsorption capability and removal efficiency
2.2.2 反应时间的影响
图6为在模拟废水pH值为7.5、MSEP投加量为1.0 g/L的条件下,反应时间对平衡吸附量qe的影响。由图可以看出,反应初始20 min MSEP对溶液中氨氮、磷酸盐的平衡吸附量迅速增大,20~40 min内,反应速度减缓。反应时间进行到第40 min时,MSEP对模拟废水中氨氮和磷酸盐的平衡吸附量分别为61.76、114.14 mg/g,此后随着反应时间的延长,qe趋于稳定,确定40 min为反应最佳时间。
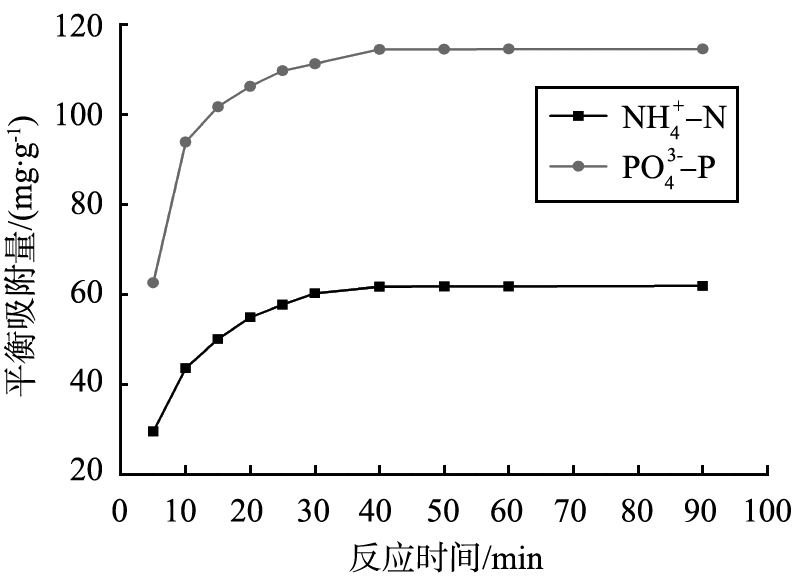
图6 反应时间对qe的影响
Fig.6 Effect of contact time on equilibrium adsorption capability
2.2.3 溶液初始pH值的影响
溶液pH值决定磷酸铵镁的溶解度和过饱和度,是影响磷酸铵镁晶体合成的关键因素,因此,存在一个使其溶解度最小的pH值范围。图7为溶液初始pH值对MSEP对模拟废水中氮磷平衡吸附量qe的影响,控制MSEP投加量为1.0 g/L,反应时间为40 min,pH值初始值设置为5.5~9.5。如图6所示,在pH值为5.5~9.5时,随着溶液初始pH值的增加,MSEP对氮磷的平衡吸附量呈先增大后减小的趋势。在pH值为6.5~8.5时,其中pH值为7.5时MSEP对氮、磷的平衡吸附量同时达最大值,此范围内MSEP对氮磷的平衡吸附量较大,平衡吸附量分别为49.32~62.52、 94.56~115.68 mg/g。

图7 溶液初始pH值对平衡吸附量qe的影响
Fig.7 Effect of initial pH on equilibrium adsorption capability
相应pH值条件下回收沉泥XRD谱图见图8。由图可见,样品中均存在海泡石和伴生杂质滑石特征峰,而Mg(OH)2特征峰消失。 在pH值为6.5、 7.5、8.5条件下,于15.809 °(020)、20.850 °(111)、21.451 °(021)、31.913 ° (040)、33.279 °(022)等处附近出现强烈的衍射峰,经对比证实为磷酸铵镁晶体特征衍射峰(JCPDS PDF#15-0762),其中以pH值为7.5条件下磷酸铵镁的特征峰相对强度最高而尖锐,证明其结晶度最好,此时MSEP中Mg(OH)2因参与磷酸铵镁合成而导致其特征峰消失。pH值为6.0和9.0时样品中磷酸铵镁衍射峰十分微弱,表明溶液初始pH值为6.5~8.5时为磷酸铵镁晶体的适宜合成条件。当pH值低于6.5时,溶液中大量存在的H+会导致其溶解度减小,而过高的pH值会导致![]() 转化成NH3[13],且Mg(OH)2更多与磷酸盐生成MgHPO4、Mg3(PO4)2等非晶形沉淀[14],从而影响磷酸铵镁结晶。大量的研究表明,磷酸铵镁合成的适宜pH值为8.0~10.0[15],而本研究中所需pH值则低于这一范围,说明MSEP自碱性较强,无需外加碱源即可合成磷酸铵镁。
转化成NH3[13],且Mg(OH)2更多与磷酸盐生成MgHPO4、Mg3(PO4)2等非晶形沉淀[14],从而影响磷酸铵镁结晶。大量的研究表明,磷酸铵镁合成的适宜pH值为8.0~10.0[15],而本研究中所需pH值则低于这一范围,说明MSEP自碱性较强,无需外加碱源即可合成磷酸铵镁。

图8 不同pH值条件下回收沉泥XRD图谱
Fig.8 XRD patterns of precipitates collected under different pH values
2.3 吸附动力学
吸附动力学能估算出MSEP对模拟废水中氮磷的吸附速率,有助于深入理解氮磷的回收机制。MSEP对氨氮、磷酸盐单位平衡吸附量随时间的变化见图6。分别采用准一级动力学模型和准二级动力学模型研究吸附过程的动力学问题,其方程分别为
ln(qe-qt)=lnqe-k1t,
(3)
(4)
式中:qt(mg/g)和qe(mg/g)分别为吸附时间为t和吸附达到平衡时单位吸附量;k1(min-1)和k2[g·(mg·min)-1]分别表示准一级和准二级吸附速率常数。通过ln(qe-qt)-t拟合直线的斜率可计算出k1和理论平衡吸附量(qe,cal),通过t/qt-t拟合直线的斜率和截距可计算出k2和平衡吸附量估值(qe,cal)。
图9分别为准一级动力学模型和准二级动力学模型拟合实验数据和回归直线的结果,以此为基础得出的拟合相关系数,见表1。 MSEP对氨氮、 磷酸盐吸附的准一级动力学模型拟合相关系数的平方R2(0.830和0.753)较小,理论平衡吸附量为24.547和27.326 mg/g,远小于实验测得的平衡吸附量,因此准一级动力学模型不适用于描述MSEP对氮磷的吸附行为;准二级动力学模型拟合相关系数的平方R2分别为0.998和0.999,理论平衡吸附量为66.01、119.33 mg/g,与实验测得的单位吸附量非常接近,因此,该吸附动力学过程符合准二级吸附动力学模型,证明MSEP对废水中氮磷的吸附过程受固液界面发生的化学反应主导。
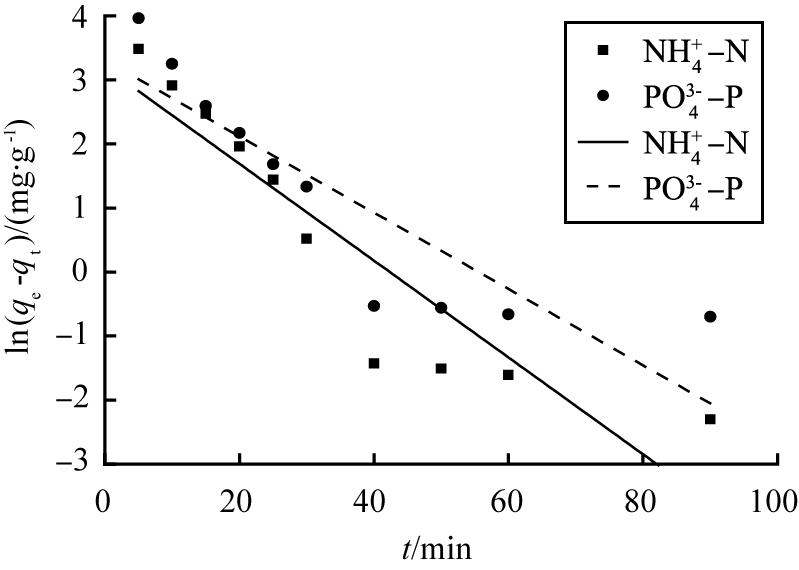
a 准一级动力学
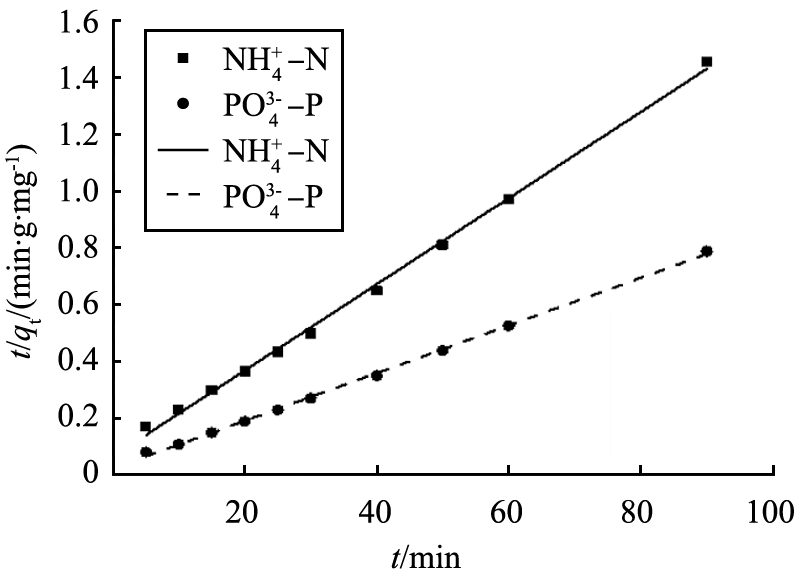
b 准二级动力学
图9 动力学模型拟合MSEP对氮磷的吸附过程
Fig.9 Kinetic model for adsorption of ammonium and phosphate by MSEP
表1 MSEP吸附氮磷的准一级动力学与准二级动力学模型拟合参数
Tab.1 Fitted kinetic parameters for adsorption ofammonium and phosphate by MSEP
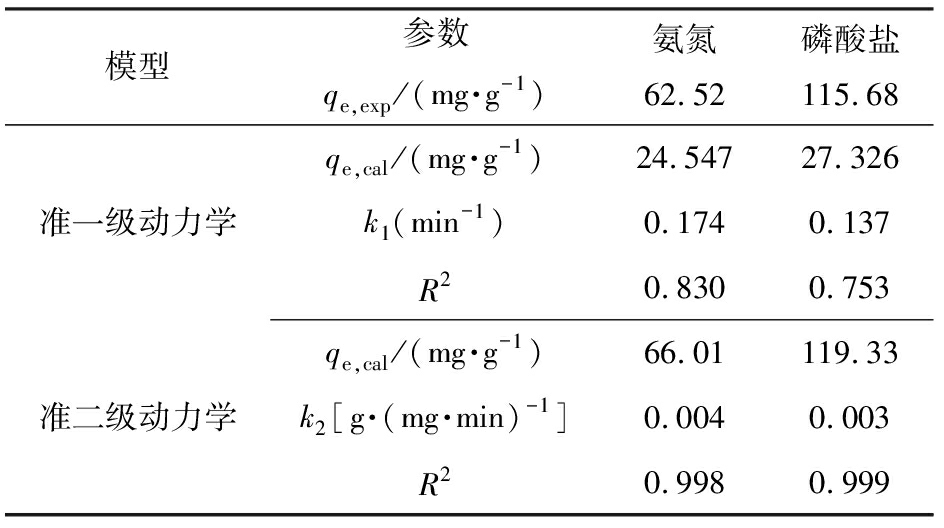
模型参数qe,exp/(mg·g-1)氨氮62.52磷酸盐115.68准一级动力学qe,cal/(mg·g-1)24.54727.326k1(min-1)0.1740.137R20.8300.753准二级动力学qe,cal/(mg·g-1)66.01119.33k2[g·(mg·min)-1]0.0040.003R20.9980.999
2.4 MSEP对模拟废水中氮磷的回收机制
MSEP对![]() 的回收机制主要为磷酸铵镁结晶法。 MSEP进入溶液体系后,表面携带大量Mg2+和OH-,见式(5),固液界面中Mg2+与
的回收机制主要为磷酸铵镁结晶法。 MSEP进入溶液体系后,表面携带大量Mg2+和OH-,见式(5),固液界面中Mg2+与![]() 处于局部过饱和状态并在适宜条件下(6.5
处于局部过饱和状态并在适宜条件下(6.5![]() 在溶液中的主要存在形式为
在溶液中的主要存在形式为![]() 和
和![]() 因此主要反应过程可见式(7)—(8),可见磷酸铵镁结晶过程中会释放H+,与式(1)中OH-中和,有利于Mg2+进一步释放,造成局部Mg2+浓度增高并促使反应(7)—(8)向右进行,直至反应达到平衡。
因此主要反应过程可见式(7)—(8),可见磷酸铵镁结晶过程中会释放H+,与式(1)中OH-中和,有利于Mg2+进一步释放,造成局部Mg2+浓度增高并促使反应(7)—(8)向右进行,直至反应达到平衡。
MSEP≡Mg(OH)2→SEP+Mg2++2OH-,
(5)
![]()
MgNH4PO4·6H2O↓,
(6)
![]()
MgNH4PO4·6H2O↓+H+,
(7)
![]()
MgNH4PO4·6H2O↓+2H+。
(8)
根据上式,磷酸铵镁合成过程中![]() 与
与![]() 按照物质的量比1∶1参与反应,而如图7所示,相应条件下(6.5
按照物质的量比1∶1参与反应,而如图7所示,相应条件下(6.5![]() 而排斥
而排斥![]() 此外,海泡石中的孔道结构也允许部分
此外,海泡石中的孔道结构也允许部分![]() 和
和![]() 进入其中。
进入其中。
图10为最佳实验条件下回收沉泥SEM、 TEM、SEM-EDS、FTIR图谱。通过SEM分析可见,海泡石纤维交叉形成的鸟巢状立体构架凸显出载体功能,通过纤维的桥接和网络捕束作用,大量长约10 μm左右的棒状晶体团聚成直径约200~300 μm的块体颗粒,可短时间内实现固液分离,弥补了磷酸铵镁晶体由于颗粒细小而易流失的缺点。此外,外加晶种能够缩短磷酸铵镁晶体形核时间并依托晶种发育,TEM分析显示,磷酸铵镁晶体被散乱的海泡石纤维紧紧包裹,同时纤维表面由于Mg(OH)2参与磷酸铵镁合成重新变得光滑,证明磷酸铵镁晶体可依托于海泡石形核长大。

a 沉泥SEM图像(2.5×102倍)

b 沉泥SEM图像(4.5×104倍)
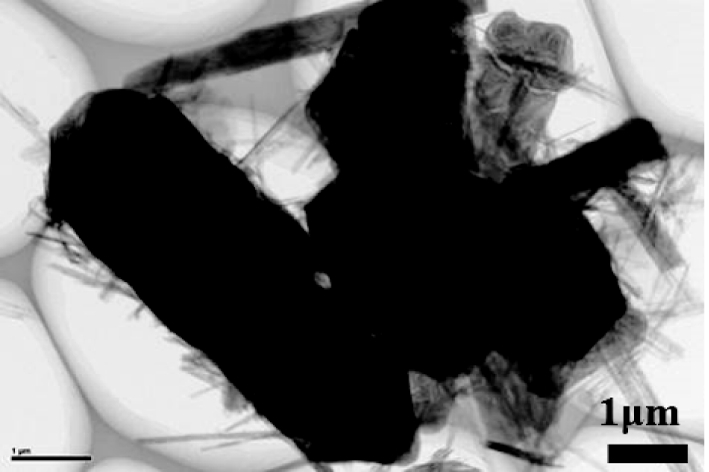
c 沉泥TEM图像
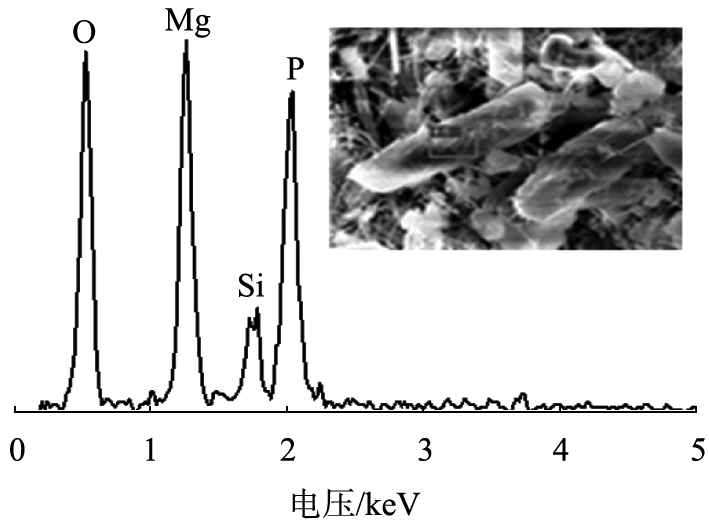
d 沉泥SEM-EDS图

e 沉泥FTIR图谱
图10 最佳实验条件下回收沉泥理化特征分析
Fig.10 Characterization of precipitates collected under optimum conditions
SEM-EDS显示该晶体的主要成分含有O、Mg、P元素,为磷酸铵镁的主要成分,FTIR图谱在波数为1 442.25、 1 006.61 cm-1处分别出现不对称弯曲![]() 特征峰和
特征峰和![]() 特征吸收峰,结合图7中pH值为7.5时回收沉泥的XRD图谱,证实MSEP对模拟废水中氨氮、磷酸盐的主要回收机制为磷酸铵镁结晶法,回收沉泥是主要组分为天然海泡石和磷酸铵镁的混合物,目前已有将海泡石作为保水保肥剂、土壤改良剂的报道[17],因此回收产物可作为优质土壤改良剂、氮磷缓释肥加以利用。
特征吸收峰,结合图7中pH值为7.5时回收沉泥的XRD图谱,证实MSEP对模拟废水中氨氮、磷酸盐的主要回收机制为磷酸铵镁结晶法,回收沉泥是主要组分为天然海泡石和磷酸铵镁的混合物,目前已有将海泡石作为保水保肥剂、土壤改良剂的报道[17],因此回收产物可作为优质土壤改良剂、氮磷缓释肥加以利用。
3 结论
1)以MgCl2为镁源,氨水为沉淀剂,SDBS为模板剂,采用水热法(温度为160 ℃,反应时间4 h)在海泡石纤维表面原位生长纳米结构Mg(OH)2。
2)样品在较宽的pH值范围(6.5~8.5)内对废水中氨氮、磷酸盐具备优异的回收能力,最高吸附量分别达62.52、 115.68 mg/g,该过程符合准二级动力学模型,主要回收机制为磷酸铵镁结晶法。
3)海泡石可作为晶种和磷酸铵镁载体,为磷酸铵镁提供形核发育场所,并实现磷酸铵镁晶体以团聚大颗粒的形式同步回收废水中氮磷。
4)样品对废水中氮磷的回收工艺绿色环保,产物海泡石-磷酸铵镁复合物具备作为优质土壤改良剂、氮磷缓释肥的应用前景。
[1]DOYLE J D, PARSONS S A. Struvite formation, control and recovery[J]. Water Research, 2002, 36(16): 3925-3940.
[2]LIU Y H, KUMAR S, KWAG J H, et al. Magnesium ammonium phosphate formation, recovery and its application as valuable resources: a review[J]. Journal of Chemical Technology & Biotechnology, 2013, 88(2):181-189.
[3]DIWANI G E, RAFIE S E, IBIARI N N E, et al. Recovery of ammonia nitrogen from industrial wastewater treatment as struvite slow releasing fertilizer[J]. Desalination, 2007, 214(1/2/3): 200-214.
[4]MEHTA C M, BATSTONE D J. Nucleation and growth kinetics of struvite crystallization[J]. Water Research, 2013, 47(8):2890-2900.
[5]ZENG L, LI X. Nutrient removal from anaerobically digested cattle manure by struvite[J]. Journal of Environmental Engineering & Science, 2006, 5(4):285-294.
[6]段金明, 方宏达, 林锦美, 等. 沸石吸附氨氮辅助鸟粪石法去除养猪废水营养物质[J]. 环境科学与技术, 2011, 34(12): 181-184.
[7]HUANG H, XIAO D, PANG R, et al. Simultaneous removal of nutrients from simulated swine wastewater by adsorption of modified zeolite combined with struvite crystallization[J]. Chemical Engineering Journal, 2014, 256(6):431-438.
[8]成雪君, 王学江, 王浩,等. 载镁天然沸石复合材料对污水中氮磷的同步回收[J]. 环境科学, 2017, 38(12):5139-5145.
[9]李国胜, 梁金生, 丁燕, 等. 海泡石矿物材料的显微结构对其吸湿性能的影响[J]. 硅酸盐学报, 2005, 33(5):604-608.
[10]MAQUEDA C, RODRIGUEZ J L P, LEBRATO J. Study of struvite precipitation in anaerobic digesters[J]. Water Research, 1994, 28(2):411-416.
[11]赵卓雅, 李祥高, 王世荣, 等. 六角片状氢氧化镁(001)晶面优先生长条件的研究[J]. 人工晶体学报, 2014, 43(7):1611-1619.
[12]SING K S W. Reporting physisorption data for gas/solid systems with special reference to the determination of surface area and porosity (recommendations 1984)[J]. Pure & Applied Chemistry, 1985, 57(4): 603-619.
[13]CORRE K S L, VALSAMIJONES E, HOBBS P, et al. Phosphorus recovery from wastewater by struvite crystallization: a review[J]. Critical Reviews in Environmental Science & Technology, 2009, 39(6):433-477.
[14]XU K, LIN F, DOU X, et al. Recovery of ammonium and phosphate from urine as value-added fertilizer using wood waste biochar loaded with magnesium oxides[J]. Journal of Cleaner Production, 2018,187:205-214.
[15]TANSEL B, LUNN G, MONJE O. Struvite formation and decomposition characteristics for ammonia and phosphorus recovery: a review of magnesium-ammonia-phosphate interactions[J]. Chemosphere, 2018, 194:504-514.
[16]CHOUYYOK W, WIACEK R J, PATTAMAKOMSAN K, et al. Phosphate removal by anion binding on functionalized nanoporous sorbents[J]. Environmental Science & Technology, 2010, 44(8):3073-3078.
[17]童潜明. 开发湖南优势矿产资源海泡石用于BB肥生产[J]. 磷肥与复肥, 2005, 20(4): 20-22.