长期过度使用不可再生的化石能源,人类正面临着日益严峻的能源危机和环境污染等问题,迫使世界各国寻找和开发新的清洁可持续的替代能源。太阳能清洁环保,储量丰富,到达地球表面的能量是目前人类实际所需能量的104倍,是一类非常有发展潜力的可再生能源,但它存在能量密度低、分布不均匀(区域性等),且具有间歇性(昼夜性、季节性等)等缺点,导致其无法直接被人类使用。同时,氢气具有燃烧值大、效率高、来源丰富(来源为水)、清洁(产物为水)、可贮藏、可运输等优点,是目前值得大力发展的一类绿色新能源。利用太阳光分解水制氢,将太阳能转化为氢能加以贮存与利用,是人类从根本上解决能源危机和环境污染问题一个最为理想而可行的途径[1-7]。
自1972年Fujishima等[3]首次报道利用TiO2半导体单晶电极和Pt对电极作用实现光解水制氢以来,引起一股Fujishima-Honda效应,物理学家、化学家与材料科学家在光解水领域开展了大量的理论与实验研究工作,一系列光催化剂如TiO2、ZnO、CdS和C3N4等纷纷被发现具有光解水制氢活性[8-12]。经过几十年的持续研究,该领域取得很大的进展。不过光生载流子的激发和迁移速率通常为飞秒到皮秒级,光生载流子在催化剂表面发生氧化还原反应的速率在亚纳秒到微秒级,光生载流子复合速率为亚皮秒到皮秒级,三者之间的不匹配造成单一结构催化剂光生载流子易复合,氧化还原产物氧气与氢气无法及时有效分离,易复合变回水。特别需要指出的是,目前已开发可用于光解水的催化剂大多只能响应紫外光或对可见光吸收率较低。然而在太阳光谱中,紫外光的能量仅占5%,可见光的能量占46%,红外光占49%。从实际应用的角度出发,开发具有高效电荷分离的宽谱太阳光响应的光催化剂是该领域发展的必然趋势[1,4]。
针对上述问题,目前人们开发了很多方法如离子掺杂、染料敏化、异质结等来改善和优化电荷传输和光吸收2个过程[7,13-14]。其中通过贵金属修饰,一方面可与半导体形成的肖特基结加速电荷的分离;另一方面,其独特表面等离子共振效应能够拓宽可见光响应范围,为光解水性能的优化提供了新的发展机遇[6,15]。
本文中从光解水的基本原理、等离子共振的基本概念与模式、等离子体金属在光解水过程中的作用、已取得的研究成果、应用存在的问题和可能的发展趋势进行阐述,希望有助于理解等离子工作机制和设计新的等离子光催化剂。
1 光解水的基本原理
图1为光解水过程和原理示意图。光解水需经历以下3个基本过程。
1) 半导体吸收能量大于带隙(hν≥Eg)的光,激发价带上的电子跃迁到导带上,产生光生电子空穴对(e-、 h+)。
2) 光生电子空穴对体相分离与迁移。
3) 光生电子空穴在半导体的表面上与水发生氧化还原反应,释放出氢气和氧气(如图1a所示)。
从热力学来讲,水分解是一个能量增大的上坡反应。半导体的能带结构必须满足热力学水分解的条件,才有可能发生水的分解反应。也就是说,半导体的带隙宽度必须等于或大于1.23 eV,且其导带和价带位置必须满足水的还原氧化电位,即半导体的导带底须比氢的还原电位更负,同时价带顶须比H2O氧化电位更正(如图1b所示)。
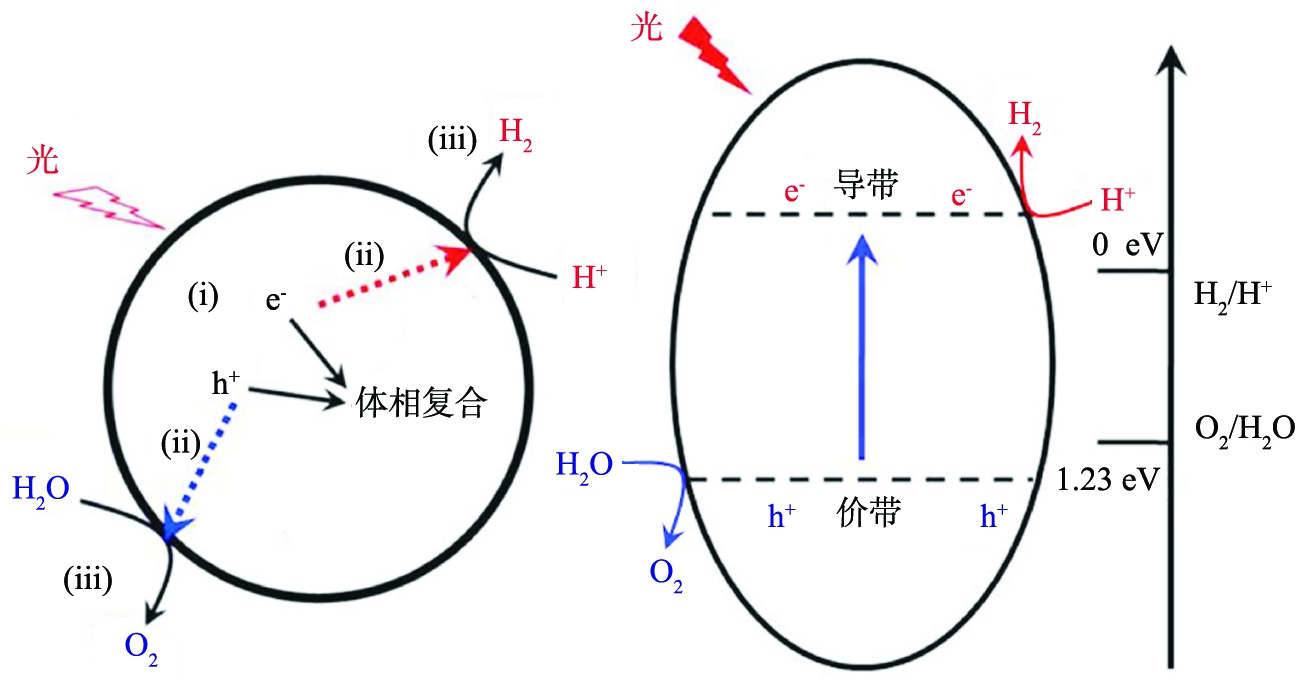
a 过程 b 原理
图1 光解水过程和原理示意图
Fig.1 Schematic diagram for reaction process and principle of water splitting
由于光生电荷在迁移过程中的能量损失和过电位的存在,因此通常光解水合适的带隙约为1.8 eV。要实现高效的光解水,在满足上述要求的前提下,半导体还应满足以下2个条件:1)半导体应拥有合适的禁带宽度,禁带宽度的范围决定了半导体吸收光能的阈值,设计半导体使之尽可能吸收更宽频的太阳光,吸收可见光甚至红外光;2)光生电子空穴对及时有效分离,并快速迁移到催化剂的表面参与还原氧化反应[1,6- 7,14]。为此,人们开展了大量的研究工作。总得起来看,均是通过调控催化剂的结构优化上述2个过程来提高光解水性能,其中有离子掺杂、染料敏化、异质结等。
2 肖特基结
虽然很多催化剂被发现具有非常合适的能带结构,但实际结果显示单一半导体的光解水性能很差,甚至于无氢气和氧气的释放。这主要是由于单一结构体相缺陷较多,且光生电子无规则迁移到表面,不仅易于发生体相复合,无法到达表面或到达表面的电荷进一步复合,难以参与还原氧化反应。为了改善光生电荷的分离迁移过程,半导体表面修饰贵金属是一种较为常用且有效的方法。这部分以n型半导体复合贵金属为例来加以说明。由于贵金属的功函数通常比n型半导体高,当两者接触后,它们表面的电荷会重新分布,半导体表面的电子会向贵金属表面跃迁,直到两者间的费米能级相等为止。这样,半导体表面空穴密度增加,与此同时,贵金属表面电子密度增大,这使得在它们之间形成一种特殊的界面,称为肖特基结。肖特基结将电子和空穴分隔于2个不同结构,有效抑制电子空穴复合,实现电荷的有序迁移,进而可提高的光解水性能[7,14]。同时,贵金属还可以优化半导体的晶型,减少半导体的团聚现象。
3 等离子共振效应
虽然光解水已经取得了很大进展,但距离实际应用还有很大的距离,亟需优化结构来提高光解水性能。各种方法被开发用于优化结构以达到这一目标,其中复合等离子金属可以同时实现高效的电荷分离和广谱的太阳光吸收,在光解水领域表现出非常迷人的发展前景[16-24]。
等离子体是由Stem教授研究组于1960年最早提出。表面等离子体的本质是在外场的作用下如光照,金属表面自由电子与外场发生强烈的相互作用,产生沿着金属表面传播的电子疏密波。当光波的频率和金属表面的自由电子集体振荡的频率相当时,会发生强烈的共振效应,这就是所谓的表面等离子共振。图2为离子共振的基本原理,等离子体共振按照工作机制的差异通常可以分为2类:1)当自由电子沿着连续的金属表面纵波方向朝外振荡,称作表面等离子体共振(surface plasmon resonance,SPP)如图2a所示。这和前述一样,通常发生在尺寸相对较大的金属颗粒或者薄膜中(通常≥50 nm);2)当金属纳米颗粒尺寸较小时,其表面的自由电子振荡频率与入射光相同时,它们之间强烈的相互作用诱发强的振荡与局域场强,将光局限在金颗粒内,这种共振称为局域表面等离子激元(localized surface plasmon resonance,LSPR)如图2b所示。LSPR跟金属纳米颗粒的成分、形貌和尺寸等密切相光,可通过调控这些参数来调节LSPR。在光催化体系中,主要是利用LSPR来优化性能。以下未作特别说明,等离子共振均指LSPR。
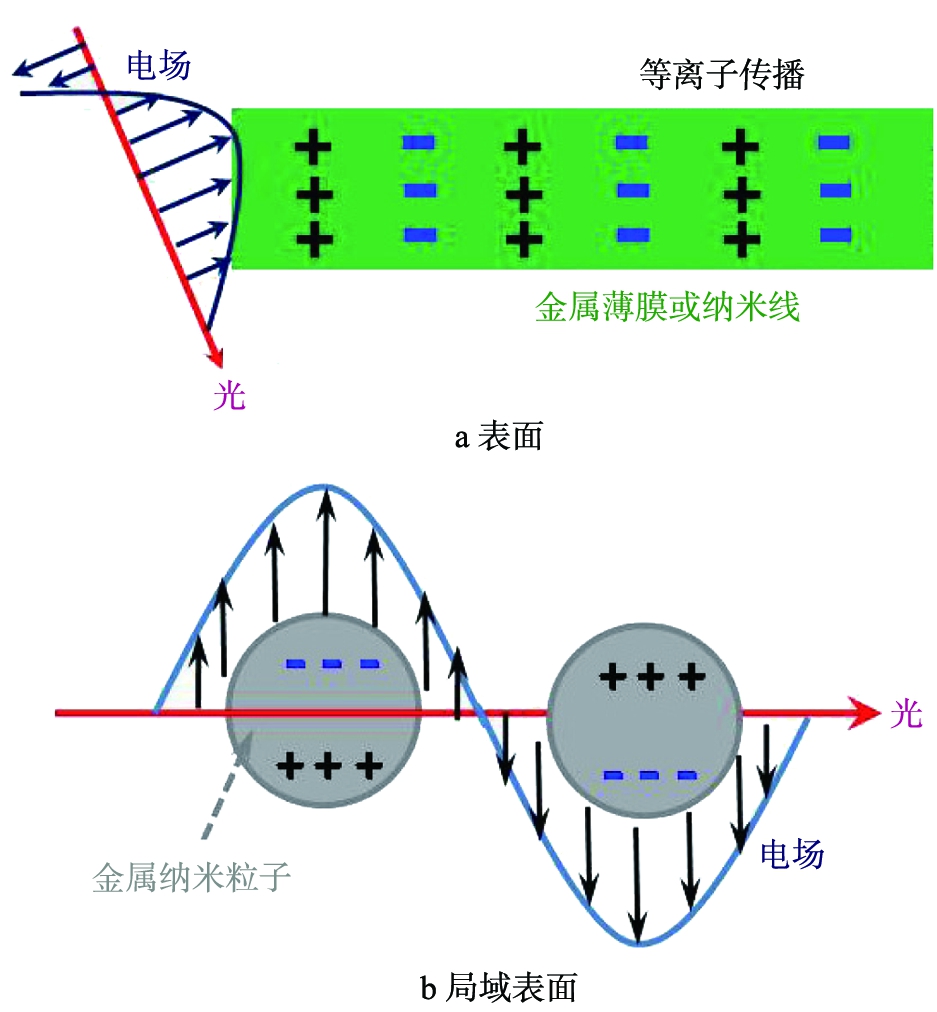
图2 等离子共振的基本原理
Fig.2 Sketches of surface and local surface plasmon resonance
在LSPR体系中,强振荡与局域场强可以促进金属纳米颗粒对光的吸收和局域电磁场增强。当半导体复合等离子体金属后,LSPR将其所浓缩的高能能量转移到半导体中,进而提高光解水性能。其光解水性能增强的机制有3种。下面以贵金属和n型半导体复合结构为例分别加以介绍。当一束光辐照到贵金属纳米时,产生强烈的表面等离子共振效应,将低密度的太阳光聚集到金属颗粒周围。随着时间的推移,这部分能量以辐射和无辐射的形式转移到半导体。典型非辐射的形式就是高能热电子传递模式。吸收振荡频率相当的光后,金属颗粒表面的自由电子会摆脱束缚,转变为高能的热电子。当热电子的能量高于复合半导体的导带底时,高能热电子越过金属和n型半导体的肖特基势垒注入到半导体的导带,而热空穴则就留在金属纳米颗粒上。由于高能热电子的能量很高,注入到半导体后仍然可以保持较高的能量,具有足够的还原性将水还原释放出氢气。因局域表面等离子共振效应,金属纳米颗粒可吸收很宽谱的太阳光,半导体复合金属纳米颗粒不仅可以拓宽光谱响应波长,而且可以提高电荷分离效率。
具有优良的等离子共振特性的贵金属纳米粒子如金、银、铜等被广泛用于光解水中[19-27],而且可以通过调节成分、结构、形貌和尺寸拓宽光谱响应范围到可见光、红外光,甚至全光谱吸收[25],但是这种机制也存在一些问题,大部分热电子未能被利用,通常以光或热的形式耗散掉。此外,肖特基电荷传输方向和热电子传输方向完全相反,造成部分热电子通过肖特基结回到金属颗粒,这显然不利于光解水反应。
贵金属纳米颗粒通过LSPR聚集的能量也可以通过非辐射衰减的方式转移能量,主要有等离子诱导的共振能量转移和场强增强效应。等离子诱导的共振能量转移就是通过等离子金属以增强电磁场和偶极子作用的形式将共振能量转移到半导体。在靠近等离子体金属的附近区域产生比吸收光更强的电磁场。也就是说,在这里等离子金属充当一个天线作用,可以聚集太阳光能。LSPR诱导的局域电磁场增强可以促进复合半导体光激发价带电子跃迁到导带。除此之外,由于强场的存在,还可以有效抑制光生电子和空穴的复合,进而提高光生电荷的利用率。同时,由于等离子金属的聚集作用,半导体的吸光距离可以缩短,因此在设计等离子体贵金属和半导体复合结构催化剂时,可以减少半导体的尺寸,可以缩短光生电荷的迁移距离,对光解水性能提高显然是非常有利的。
此外,还可以通过等离子共振的多重散射效应增加光的传播路径,进而增加光的吸收率。如果等离子体金属的共振吸收波长与太阳光的吸收与复合半导体的吸收有重叠,还可以通过共振增强半导体对光的吸收,特别是在共振峰的附近,光吸收可以较大增强。上述主要的3种模式可以单独发生作用,也可以协同发生作用,这主要取决于所设计催化剂的结构。其中热电子注入需要半导体和等离子金属紧密接触才能发生作用,相比之下后2种作用机制不需要直接接触,在一定范围内可以发生作用。有时为了避免热电子注入机制和肖特基结同时发生作用带来的抵消效应,通常会在半导体与等离子体金属之间构筑一层非导电层,这个时候,只有后2种模式发生作用。
4 等离子体光催化剂
通过贵金属和半导体形成的肖特基结,贵金属的局域表面等LSPR在可见光区域具有较强的吸收、增强的电磁场、直接热电子注入等特点,可以有效提高光解水性能[31-36]。下面介绍几类主要贵金属基催化剂在光分解水中的应用。
4.1 Au等离子体光催化剂
Au具有较强的等离子体共振效应(可以拓宽光谱响应到可见光甚至红外光)和较大的功函数(5.1~5.3 eV),相比于易氧化的金属Ag,Au具有相对较好的稳定性和光解水性能。Au纳米粒子与半导体光复合催化剂在光解水制氢方面应用引起学者们的极大研究兴趣[25-29]。
Pu等[26]首先通过水热法在FTO导电玻璃表面生长TiO2纳米棒阵列,随后将Au纳米棒和纳米球形粒子分别沉积到TiO2纳米棒表面形成AuNP-TiO2和AuNR-TiO2这2种复合结构,测试了其光学性质和光解水性能。结果显示,它们分别在波长550、710 nm处有良好的光吸收特性,进而表现出良好的可见光和可见-近红外光解水性能。进一步将Au纳米棒和纳米球形粒子同时沉积到TiO2纳米棒表面AuNP-NR-TiO2复合结构,可以实现全光谱吸收,其光解水性能进一步提高。基于先进的光谱表征和提高的性能,作者提出在可见光甚至近红外光的辐照作用下,Au纳米结构产生强的等离子共振,产生高能热电子越过肖特基势垒迁移到TiO2的导带并随后通过TiO2迁移到FTO电极,实现电荷的高分离,进而实现光谱吸收和高电荷分离效率及其提高的光解水性能。
Rosseler等[30]通过浸渍法将Au纳米颗粒负载到P25纳米颗粒表面,研究了Au含量对光解水性能的影响,并选用Pt作为参比对象,结果显示负载质量分数为0.3%的Au具有最好光解水活性。Au主要扮演助催化剂的角色。Au纳米颗粒的负载不仅抑制了光生电子空穴对复合,而且质子的光催化还原反应提供了活性位点。Au纳米颗粒过量会降低P25对光的吸收,过低会降低电荷分离效率和活性位点,这均对光解水不利。
类似的高能热电子注入的方法同样被用于提高Fe2O3光电极的光电电流及其光解水性能,取得了较好的效果[29]。这种方式需要两者紧密接触,但是,Thomann等[31]在Au与Fe2O3之间引入一层非导电层,将具有核壳结构的Au@SiO2负载在Fe2O3表面,也就是说不直接接触,同样获得较好的水分解效率,其原因是等离子共振诱导能量转移所导致。
这里有一点必须引起注意,Au与n型TiO2复合通常会在Au与TiO2之间形成肖特基势垒。正如前面所阐述,肖特基势垒有助于电子往贵金属迁移,这恰恰与热电子注入方向相反,不仅不会提高热电子的利用率,还会带来负面效应。对此,Tanaka等[32]设计并制备了Au-TiO2-NiOx的复合结构。
Au通过LPSR效应吸收可见光产生高能热电子,并注入到TiO2的导带,随后通过助催化剂NiOx将电荷转移至表面发生反应。通过这样的结构设计,大大提高热电子的利用率,极大地提高了光解水性能。这里同时利用肖特基结与等离子共振的协同效应,为设计高效光谱吸收催化材料提供很好思路。
此外还可以调控Au的结构,如构建合金粒子(Au-Cu)调控电子结构改善光吸收特性来优化等离子共振效应带来的相关作用,实现光解水性能的优化[33-34]。
4.2 Ag等离子体光催化剂
相比于Au和Cu的波长,Ag的光谱范围可在300~1 200 nm调节,在可见光区域具有优异的局域表面等离子共振特性[28,35-39],但Ag具有毒性、易氧化等缺点,这限制了其应用范围。Ag-TiO2、Ag-ZnO、Ag-Au-TiO2等复合催化剂被开发用来提高光解水性能。其性能提高的原因与Au体系的复合催化剂原理基本一致:一方面金属Ag与半导体接触形成了肖特基结,另一方面通过LSPR作用。
有一点值得注意,Ag等离子共振波长与TiO2等宽禁带半导体的光吸收具有部分重叠,通过共振可以增强本体半导体的光吸收,进而提高光解水性能,这个性质Au和Cu是不具备的。
4.3 Ag系化合物等离子体光催化剂
Ag系化合物具有很高的感光度,常被用作感光材料,但因其遇光不稳定的特性,很少被注意到可用作光催化剂。
Wang等[40]和Yi等[41]在银化合物等离子体光催化剂方面做了开创性研究工作。2008年,Wang等[40]首次利用离子交换和光还原法制备了Ag@AgCl表面等离子体光催化材料并应用于光催化领域,随后多种银系卤化物被制备出来用于光催化和光解水领域[42-45]。他们普遍认为,Ag纳米颗粒的表面等离子体共振效应造成银系卤化物在可见光区域表现出优异的光吸收性质,为光解水制氢开发了一条实现宽谱可见光吸收、高效电荷分离及其提高光催化活性的新思路。其机制是光生电子将Ag离子还原为Ag原子,并原位沉积于卤化银表面。
随后Yi等[41]发现正交相的Ag3PO4在可见光辐照下具有高效光解水产氧性能。这促使人们把目光头聚焦到银化合物等离子体光催化剂上。对其结构和形貌的调控、复合到其他半导体、开发新的体系如AgBr、AgI等被报道具有较好的可见光分解水性能[42-45]。
4.4 其他体系等离子体光催化剂
贵金属Au和Ag是目前等离子体光催化剂研究的主要材料,但是其稀缺性和高成本限制了其发展,开发具有等离子共振效应的新材料变得很有必要。
Cu和Al纳米结构逐渐走入人们的研究视野[46-50]。美国佛罗里达大学Yang等[51]先通过阳极氧化法制备了TiO2纳米管阵列,随后利用电子束蒸镀技术在其表面沉积一层厚度约10~30 nm的Al薄膜,该结构的光解水性能极大提高。通过光谱表征和性能分析,证实Al的等离子共振效应增强电磁场和产生的高能热电子是性能提高的主要原因,而且表面薄层Al2O3可阻止金属Al的进一步氧化,有利于提高该复合结构催化剂的稳定性。Lou等[46]选择Cu纳米结构作为等离子体源,制备了Cu@Cu2O-ZnO复合异质结构,同样具有较好的光解水性能。
此外Cu2-xS、MoS2和WO3-x等材料被发现也具有强烈的等离子共振效应,但目前用于光解水或光催化的相关报道仍然较少[52-54]。
5 总结
本文中介绍了光解水的工作原理、肖特基结的特点、等离子共振的基本原理与作用机制,综述了近年来贵金属基光催化剂的研究进展。一方面贵金属的功函较大,与半导体接触后,形成肖特基结,有效促进光生电荷的分离,提高光催化效率;另一方面其具有等离子体共振效应,可有效提高入射光的吸收,拓宽光谱响应范围,促进电荷载体的激发,在光解水应用方面表现出巨大的发展前景。
仍有一些问题需关注和进一步解决。
1)贵金属的价格较高,地球上储量较少,一方面需减少其用量,如合金化、构建复合结构,另一方亟需开发新的廉价的替代等离子体材料。
2)大部分热电子未能被较好利用,需要开发操纵其迁移的新策略。
3)等离子共振在光解水的作用机制还不是很明确,虽然先进的表征技术已可给出一些信息,但是捕捉其电荷的迁移过程十分困难,亟需开发新的原位光谱技术。
随着贵金属基半导体光催化体系的深入研究和了解,精度更高、更先进的光谱技术的出现,结合理论计算,相信贵金属光解水使用过程中这些问题会逐步得到解决,将扮演更为重要的角色并发挥更大作用。
[1]YOUNGBLOOD W J, LEE S H A, MAEDA K, et al. Visible light water splitting using dye-sensitized oxide semiconductors[J]. Accounts of Chemical Research, 2009, 42(12): 1966-1973.
[2]WANG J H, CUI W, LIU Q, et al. Recent progress in cobalt-based heterogeneous catalysts for electrochemical water splitting[J]. Advanced Materials, 2016, 28(2): 215-230.
[3]FUJISHIMA A, HONDA K, Electrochemical photolysis of water at a semiconductor electrode[J]. Nature,1972, 238(5358): 37-38.
[4]JOYA K S, JOYA Y F, OCAKOGLU K, et al. Water-splitting catalysis and solar fuel devices: artificial leaves on the move[J]. Angewandte Chemie-International Edition, 2013, 52(40): 10426-10437.
[5]KANG D, KIM T W, KUBOTA S R, et al. Electrochemical synthesis of photoelectrodes and catalysts for use in solar water splitting[J]. Chemical Reviews, 2015, 115(23): 12839-12887.
[6]PHAM T A, PING Y, GALLI G. Modelling heterogeneous interfaces for solar water splitting[J]. Nature Materials, 2017, 16(4): 401-408.
[7]CHEN S S, TAKATA T, DOMEN K. Particulate photocatalysts for overall water splitting[J]. Nature Reviews Materials, 2017, 2(10): 17050,1-17.
[8]XIE M Z, FU X D, JING L Q, et al. Long-lived, visible-light-excited charge carriers of TiO2/BiVO4 nanocomposites and their unexpected photoactivity for water splitting[J]. Advanced Energy Materials, 2014, 4(5): 1300995,1-6.
[9]CHE W, CHENG W R, YAO T, et al. Fast photoelectron transfer in (C-ring)-C3N4 plane heterostructural nanosheets for overall water splitting[J]. Journal of the American Chemical Society, 2017, 139(8): 3021-3026.
[10]OHNO T, BAI L, HISATOMI T, et al. Photocatalytic water splitting using modified GaN:ZnO solid solution under visible light: long-time operation and regeneration of activity[J]. Journal of the American Chemical Society, 2012, 134(19): 8254-8259.
[11]WANG G M, WANG H Y, LING Y C, et al. Hydrogen-treated TiO2 nanowire arrays for photoelectrochemical water splitting[J]. Nano Letters, 2011, 11(7): 3026-3033.
[12]YANG X Y, WOLCOTT A, WANG G M, et al. Nitrogen-doped ZnO nanowire arrays for photoelectrochemical water splitting[J]. Nano Letters, 2009, 9(6): 2331-2336.
[13]KISCH H. Semiconductor photocatalysis mechanistic and synthetic aspects[J]. Angewandte Chemie-International Edition, 2013, 52(3): 812-847.
[14]CHEN X B, SHEN S H, GUO L J, et al. Semiconductor-based photocatalytic hydrogen generation[J]. Chemical Reviews, 2010, 110(11): 6503-6570.
[15]LINIC S, CHRISTOPHER P, INGRAM D B. Plasmonic-metal nanostructures for efficient conversion of solar to chemical energy[J]. Nature Materials, 2011, 10(12): 911-921.
[16]MA L, CHEN K, NAN F, et al. Improved hydrogen production of Au-Pt-CdS hetero-nanostructures by efficient plasmon-induced multipathway electron transfer[J]. Advanced Functional Materials, 2016, 26(33): 6076-6083.
[17]XIAO J D, HAN L L, LUO J, et al. Integration of plasmonic effects and schottky junctions into metal-organic framework composites: steering charge flow for enhanced visible-light photocatalysis[J]. Angewandte Chemie-International Edition, 2018, 57(4): 1103-1107.
[18]ZHANG Y C, HE S, GUO W X, et al. Surface-plasmon-driven hot electron photochemistry[J]. Chemical Reviews, 2018, 118(6): 2927-2954.
[19]SHAIK F, PEER I, JAIN P K, et al. Plasmon-enhanced multicarrier photocatalysis[J]. Nano Letters, 2018, 18(7): 4370-4376.
[20]WAN D Y, ZHAO Y L, CAI Y, et al. Electron transport and visible light absorption in a plasmonic photocatalyst based on strontium niobate[J]. Nature Communications, 2017, 8(15070):1-9.
[21]MUBEEN S, LEE J, SINGH N, et al. An autonomous photosynthetic device in which all charge carriers derive from surface plasmons[J]. Nature Nanotechnology, 2013, 8(4): 247-251.
[22]QIAN Z X, GINGER D S. Reversibly reconfigurable colloidal plasmonic nanomaterials[J]. Journal of the American Chemical Society, 2017, 139(15): 5266-5276.
[23]ASLAM U, RAO V G, CHAVEZ S, et al. Catalytic conversion of solar to chemical energy on plasmonic metal nanostructures[J]. Nature Catalysis, 2018, 1(9): 656-665.
[24]BRONGERSMA M L, HALAS N J, NORDLANDER P. Plasmon-induced hot carrier science and technology[J]. Nature Nanotechnology, 2015, 10(1): 25-34.
[25]YU X, SHAVEL A, AN X, et al. Cu2ZnSnS4-Pt and Cu2ZnSnS4-Au heterostructured nanoparticles for photocatalytic water splitting and pollutant degradation[J]. Journal of the American Chemical Society, 2014, 136(26): 9236-9239.
[26]PU Y C, WANG G M, CHANG K D, et al. Au Nanostructure-decorated TiO2 nanowires exhibiting photoactivity across entire UV-visible region for photoelectrochemical water splitting[J]. Nano Letters, 2013, 13(8): 3817-3823.
[27]DESARIO P A, PIETRON J J, DEVANTIER D E, et al. Plasmonic enhancement of visible-light water splitting with Au-TiO2 composite aerogels[J]. Nanoscale, 2013, 5(17): 8073-8083.
[28]ERWIN W R, COPPOLA A, ZARICK H F, et al. Plasmon enhanced water splitting mediated by hybrid bimetallic Au-Ag core-shell nanostructures[J]. Nanoscale, 2014, 6(21): 12626-12634.
[29]THIMSEN E, LE FORMAL F, GRATZEL M, et al. Influence of plasmonic Au nanoparticles on the photoactivity of Fe2O3 electrodes for water splitting[J]. Nano Letters, 2011, 11(1): 35-43.
[30]ROSSELER O, SHANKAR M V, DU M K-L, et al. Solar light photocatalytic hydrogen production from water over Pt and Au/TiO2(anatase/rutile) photocatalysts: influence of noble metal and porogen promotion[J]. Journal of Catalysis, 2010, 269(1): 179-190.
[31]THOMANN I, PINAUD B A, CHEN Z B, et al. Plasmon enhanced solar-to-fuel energy conversion[J]. Nano Letters, 2011, 11(8): 3440-3446.
[32]TANAKA A, TERAMURA K, HOSOKAWA S, et al. Visible light-induced water splitting in an aqueous suspension of a plasmonic Au/TiO2 photocatalyst with metal co-catalysts[J]. Chemical Science, 2017, 8(4): 2574-2580.
[33]LIU M, ZHOU W, WANG T, et al. High performance Au-Cu alloy for enhanced visible-light water splitting driven by coinage metals[J]. Chemical Communications, 2016, 52(25): 4694-4697.
[34]MELVIN A A, ILLATH K, DAS T, et al. M-Au/TiO2 (M=Ag, Pd, and Pt) nanophotocatalyst for overall solar water splitting: role of interfaces[J]. Nanoscale, 2015, 7(32): 13477-13488.
[35]ZHAO X H, WANG P, YAN Z X, et al. Ag nanoparticles decorated CuO nanowire arrays for efficient plasmon enhanced photoelectrochemical water splitting[J]. Chemical Physics Letters, 2014, 609(8):59-64.
[36]KUMAR D, SINGH S, KHARE N. Plasmonic Ag nanoparticles decorated NaNbO3 nanorods for efficient photoelectrochemical water splitting[J]. International Journal of Hydrogen Energy, 2018, 43(17): 8198-8205.
[37]PATRA K K, GOPINATH C S. Bimetallic and plasmonic Ag-Au on TiO2 for solar water splitting: an active nanocomposite for entire visible-light-region absorption[J]. ChemCatChem, 2016, 8(20): 3294-3301.
[38]MAIJENBURG A W, VEERBEEK J, DE PUTTER R, et al. Electrochemical synthesis of coaxial TiO2-Ag nanowires and their application in photocatalytic water splitting[J]. Journal of Materials Chemistry A, 2014, 2(8): 2648-2656.
[39]BASU M, NAZIR R, MAHALA C, et al. Ag2S/Ag Heterostructure: a promising electrocatalyst for the hydrogen evolution reaction[J]. Langmuir, 2017, 33(13): 3178-3186.
[40]WANG P, HUANG B B, QIN X Y, et al. Ag@AgCl: A highly efficient and stable photocatalyst active under visible light[J]. Angewandte Chemie-International Edition, 2008, 47(41): 7931-7933.
[41]YI Z, YE J H, KIKUGAWA N, et al. An orthophosphate semiconductor with photooxidation properties under visible-light irradiation[J]. Nature Materials, 2010, 9(7): 559-564.
[42]AN C, WANG J, LIU J, et al. Hollow AgI:Ag nanoframes as solar photocatalysts for hydrogen generation from water reduction[J]. ChemSusChem, 2013, 6(10): 1931-1937.
[43]REDDY V R, CURRAO A, CALZAFERRI G. Zeolite A and zeolite L monolayers modified with AgCl as photocatalyst for water oxidation to O2[J]. Journal of Materials Chemistry, 2007, 17(34): 3603-3609.
[44]ZHU Q, WANG W S, LIN L, et al. Facile synthesis of the novel Ag3VO4/AgBr/Ag plasmonic photocatalyst with enhanced photocatalytic activity and stability[J]. Journal of Physical Chemistry C, 2013, 117(11): 5894-5900.
[45]LOU Z, HUANG B, MA X, et al. A 3D AgCl Hierarchical superstructure synthesized by a wet chemical oxidation method[J]. Chemistry-A European Journal, 2012, 18(50): 16090-16096.
[46]LOU Y B, ZHANG Y K, CHENG L, et al. A stable plasmonic Cu@Cu2O/ZnO heterojunction for enhanced photocatalytic hydrogen generation[J]. Chem Sus Chem, 2018, 11(9): 1505-1511.
[47]KAR P, ZHANG Y, MAHDI N, et al. Heterojunctions of mixed phase TiO2 nanotubes with Cu, CuPt, and Pt nanoparticles: interfacial band alignment and visible light photoelectrochemical activity[J]. Nanotechnology, 2018, 29(1):014002.
[48]KUM J M, PARK Y J, KIM H J, et al. Plasmon-enhanced photocatalytic hydrogen production over visible-light responsive Cu/TiO2[J]. Nanotechnology, 2015, 26(12): 125402,1-5.
[49]SPETTER D, TAHIR M N, HILGERT J, et al. Solvothermal synthesis of molybdenum-tungsten oxides and their application for photoelectrochemical water splitting[J]. ACS Sustainable Chemistry & Engineering, 2018, 6(10): 12641-12649.
[50]LI Z, SHI L, FRANKLIN D, et al. Drastic enhancement of photoelectrochemical water splitting performance over plasmonic Al@TiO2 heterostructured nanocavity arrays[J]. Nano Energy, 2018, 51:400-407.
[51]YANG J, LIANG Y J, LI K, et al. New reaction pathway induced by the synergistic effects of Bi plasmon and La3+ doping for efficient visible light photocatalytic reaction on BiOCl[J]. Applied Surface Science, 2018, 458:769-780.
[52]ALAM R, LABINE M, KARWACKI C J, et al. Modulation of Cu2-xS nanocrystal plasmon resonance through reversible photoinduced electron transfer[J]. ACS Nano, 2016, 10(2): 2880-2886.
[53]KALANUR S S, SEO H. Synthesis of CuxS thin films with tunable localized surface plasmon resonances[J]. Chemistry Select, 2018, 3(21): 5920-5926.
[54]SAVARIRAJ A D, KIM H J, KARUPPANAN S, et al. Phase transformation and evolution of localized surface plasmon resonance in Cu2-xS thin films deposited at 60 ℃[J]. Journal of Physical Chemistry C, 2017, 121(45): 25440-25446.