导电填料对提升导电胶、导电涂料、导电浆料的性能具有重要影响。目前导电填料多以金、银、铜等金属粉末为主,其中金粉成本高昂,应用受到限制;银粉产品性能优良,应用较广,但银粉价格亦高且在高温高湿环境下易产生“迁移”;铜粉价格较低,导电性与银相近,但在高温下易氧化,应用较为有限[1-2]。银包覆铜粉既可解决银的迁移问题,又可提高铜粉的导电性和抗氧化性能,相对于单一银粉成本也较低,是当前研发的热点[3-5]。
银包覆铜粉的制备方法主要包括球磨法、熔融雾化法和化学镀法。球磨法是在球磨机中研磨一定配比的铜、银混合粉末,使其发生塑性变形,实现银对铜粉的包覆。此法处理时间较短,易实现大批量生产,但银消耗量大,使得成本提高[6]。熔融雾化法[7]是将铜、银的熔融液加热变成喷雾使其微粉化,在凝固过程中利用偏析现象制取复合粉体。此法制备的银包覆铜粉包覆层薄而致密,包覆效果好,但制备工艺复杂,成本过高[8]。
化学镀法因其工艺简单、成本低等优势,发展成制备银包覆铜粉的主流方法[9]。化学镀法制备银包覆铜粉主要包括3个体系,即氨水体系、胺烯类化合物体系以及EDTA体系。在氨水体系中制备银包覆铜粉,一次镀银包覆率低,镀层表面呈点缀状,且抗氧化性能、导电性等较差[10]。通过以氨水调节pH值多次镀银、使用葡萄糖等还原剂、敏化活化法以及螯合萃取法等方式可提高包覆率[11-16]。在胺烯类化合物体系中,银胺配离子的键间结合力居中时适宜,过大时置换反应难以进行,过小则还原得到的银以颗粒形式单独存在,影响镀层厚度,因此该体系需多次镀银才能得到包覆效果较好的银包覆铜粉[17-18]。在 EDTA 体系中,Komasa 等[19]、施泽民等[20]、刘志杰等[21]等在银量少、弱还原剂存在的条件下进行化学镀制备得到了银包覆铜粉,但是其导电性能较差,且表面不光滑。宋曰海等[22]以EDTA为络合剂,并添加一定浓度的还原剂进行化学镀制备的银包覆铜粉颗粒表面不光滑,而且有呈“孤岛”状的银凸起。
针对以上所述问题,本文中研究如何运用简单工艺方法制备出形貌良好、包覆层致密的银包覆铜粉。
1 实验
1.1 试剂与仪器
试剂:铜粉(实验室自制)[23]、硫酸(化学纯)、无水乙醇(优级纯)、去离子水、硝酸银、乙二胺四乙酸(EDTA)、聚乙烯吡咯烷酮(PVP)、1,4-丁炔二醇、碳酸钠、硝酸、氢氧化钠、N2(99.99%)、H2(99.99%)。除括号标注外,其余试剂均为分析纯。
仪器:电子天平(AL204,博特勒-托利多仪器有限公司)、水循环式真空泵(SHZ-DIII,巩义市予华仪器有限责任公司)、管式炉(GSL-1600X,合肥科晶材料技术有限公司)、恒温槽(DC-0515,陕西鹏展科技有限公司)、鼓风干燥箱(806-01B,黄石市恒丰医疗器械有限公司)、酸度计(pHSS-003,SUNYEE Inc.)、蠕动泵(BT100-2J,LongerPump Inc.)、搅拌器(S212,上海鸿经生物仪器制造有限公司)、超声波清洗器(KQ3200B,昆山市超声仪器有限公司)、离心机(TG16-WS,湖南赛特湘仪有限公司)等。
1.2 步骤
1)铜粉预处理:在氮气气氛中,将适量铜粉在管式炉中300℃下加热7 h使有机物分解,再通入氢气还原并将分解后的碳氧化物及其他产物排出管式炉,随炉冷却后得到铜粉,储存、待用。
2)取10 g经预处理的铜粉经稀硫酸(60 mL)清洗一次、去离子水清洗2次后滤干,分散于50 mL无水乙醇和50 mL去离子水混合液中。配制包含0.2 g分散剂聚乙烯吡咯烷酮(以Ag的质量分数为10%计算)、0.4 g整平剂1,4-丁炔二醇(以Ag的质量分数为20%计算)的混合水溶液200 mL,其中100 mL加入上述混合液,另100 mL加入于银盐溶液中。
3)EDTA分散于碳酸钠溶液(碳酸钠质量浓度为60 g/L,溶液体积为200 mL)中,控制搅拌速度为20 r/min,反应温度为0~2℃。用硝酸和氢氧化钠溶液调节溶液pH为11。银盐溶液:以Ag的质量分数为20%计算(以Cu量计算,2 g Ag即3.149 4 g硝酸银)配成溶液500 mL,以3.758 3 mL/min的速度泵入反应器中,同时反应器进行机械搅拌(转速为300 r/min)。泵入结束后,陈化1 h,反应溶液静置后进行洗涤(去离子水洗3遍,无水乙醇洗2遍),于50~60℃烘箱烘干,将得到产品存放于干燥皿中。在其他条件相同情况下,控制EDTA和AgNO3的物质的量比 M 分别为 1∶4、1∶2、1∶1、1∶1/2、1∶1/4、1∶1/6 时分别制备产品,对应产品编号为 1#、2#、3#、4#、5#、6#。
1.3 样品表征
采用X射线衍射测试仪XRD(RIGAKU-TTRIII Cu靶)对包覆前后粉体的物相和晶体结构进行表征;采用扫描电镜SEM(JSM-6360LV)观察形貌、粒度及团聚状态;采用能谱仪EDS(GENESIS 60S)半定量分析银包覆铜粉中银、铜含量;采用物镜球差校正场发射透射电镜STEM(Titan G2 60-300 FEI)观察微观形貌;采用同步热分析仪(SDT Q600 V8.0 in USA)对银包覆铜粉的抗氧化性和热稳定性进行分析;采用比表面及空隙分析仪(ASAP2020HD88 in USA)测定粉体的比表面积。
2 结果与分析
2.1 粉体形貌
图1 是基体铜粉、活化后铜粉和不同物质的量比下银包覆铜粉的扫描电镜图像。如图1a所示,基体铜粉分散性很好,表面光滑,粒径约2.5 μm。如图1b所示,经高温还原除碳及酸化后,铜粉表面变得粗糙。产品表面形貌随着EDTA和AgNO3的物质的量比的变化而变化。
如图 1c、1d 所示,当物质的量比 M<1∶1 时,镀银后的铜粉表面的银以类似针状生长在铜粉表面,分布不均匀且包覆不完全,镀银后有银颗粒的大量析出。如图 1e、1f所示,当 1∶1≤M<1∶1/4 时,镀银后的铜粉表面的银以颗粒状态紧密地包覆在铜粉表面,银包覆铜粉颗粒间无团聚现象,分散性良好,并且铜粉表面的银颗粒析出现象得到改善。
如图1g所示,当M=1∶1/4时,镀银后的铜粉表面几乎不存在银的析出,未有铜的裸露表面,说明银镀层较厚,实现了较为完整、致密、均匀的包覆。如图1h所示,当M>1∶1/4,银包覆铜粉颗粒表面包覆不均匀并呈多孔状,说明在一定范围内EDTA量越多,包覆效果越好,EDTA量过多反而会影响包覆效果。

图1 初始铜粉、活化后铜粉、不同物质的量比(M)下银包覆铜粉的SEM图像
Fig.1 SEM images of starting copper powder,activated copper powder and silver coated copper powder with different EDTA/AgNO3molar ratio M
上述现象可以用体系中EDTA和阳离子的配位作用来解释,EDTA与Cu2+、Ag+都是以1配位结合,并且 EDTA 与 Cu2+的累积常数(lg β=18.7)大于与 Ag+的累积常数(lg β=7.32)[24]。当 EDTA 用量少时,EDTA 主要是与铜离子结合促进化学反应,反应式为
正向进行,使得异相形核和均相形核同时进行,银核生长速度也很慢。
当EDTA用量合适时,EDTA会与银离子配位结合,使得体系中游离银离子的浓度变低,银核主要以异相形核方式进行,从而降低银形核速率,有利于银在铜粉表面上的包覆。当EDTA用量过多时,Ag的生长速率会很慢,先沉积在铜粉表面的银与铜生成微电池,从而增加Ag在点缀镀层部位沉积的概率,使沉积的Ag更加不均匀,导致基体铜粉表面侵蚀,产品表面不均匀。
2.2 晶体结构
图2 为基体铜粉和银包覆铜粉的X射线衍射图谱。扫描条件为:铜靶 Cu(K1),起始角 2θ=10 °,终止角2θ=80 °,扫描速度 10(°)/min,电压 40 kV,电流 250 mA。
由图2可观察到,对照XRD标准谱(Cu:JCPDS 04-0836,Ag:JCPDS 04-0783),包覆前只出现铜的特征峰,分别位于 2θ=43.3、50.4、74.1 °;包覆后出现铜的衍射峰和银的衍射峰,未见氧化银、氧化铜及氧化亚铜的衍射峰,说明本实验产品中铜、银共存。
EDTA和AgNO3的不同物质的量比条件下制备的6组产品的峰强度与图1中银包覆铜粉的表面形貌相对应。金属银本身对X射线穿透有很大影响(穿透衰减),在铜粉表面镀层银,X射线必须穿过银层2次方能获得铜衍射峰的相关数据,故所有银包覆铜粉的铜衍射峰的强度明显减弱,从而说明银在铜粉前驱体上形成了有效包覆。
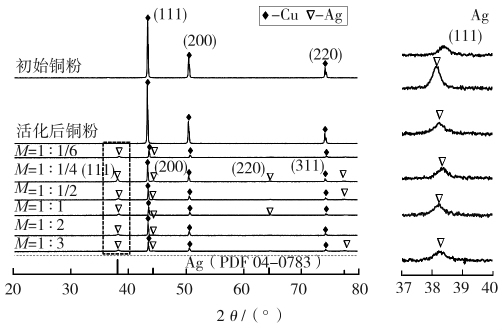
图2 基体铜粉和银包覆铜粉的X射线衍射图谱
Fig.2 XRD patterns of copper powder and silver coated copper powder
金属铜属于面心立方晶系,因布拉格方程
对应立方晶系,某晶面(h k l)的晶面间距d值与晶格常数a的关系为
代入布拉格方程得到
令 N=h2+k2+l2,则有
式中:N为一系列整数,![]() 故有特征比例函数式
故有特征比例函数式
再根据公式(4)可计算出相应的晶格常数a。
对基体铜粉和6组银包覆铜粉在同一台X射线衍射仪上进行步进慢扫,扫描条件为:起始角2θ=30°,终止角 2θ=120 °,步进为 0.001 °,停留时间为 1 s。得到的7组衍射图谱使用Jade处理,去掉仪器误差,再用全谱拟合法来进行晶胞精修,得到7组衍射数据,如表1所示。标准PDF卡片04-0836铜的晶格常数是a=b=c=3.615。
由表1可知,基体铜粉的晶格常数值为3.614 7;当M=1∶1/4时,铜的晶格常数值为3.613 1,小于其他M值条件下的晶格常数值3.615 5。由此推测得知:晶格常数使得铜晶界面的相互作用更强,使铜和银结合的更紧密。根据计算可知银的晶格常数也会发生一定的变化,此外,仪器对不同样品检测所产生的误差会有细微差别,所以,这2个原因共同导致银的X射线衍射峰发生了一定量的偏移。
表1 基体铜粉和银包覆铜粉的衍射数据
Tab.1 Diffraction data of copper powders and silver coated copper powders
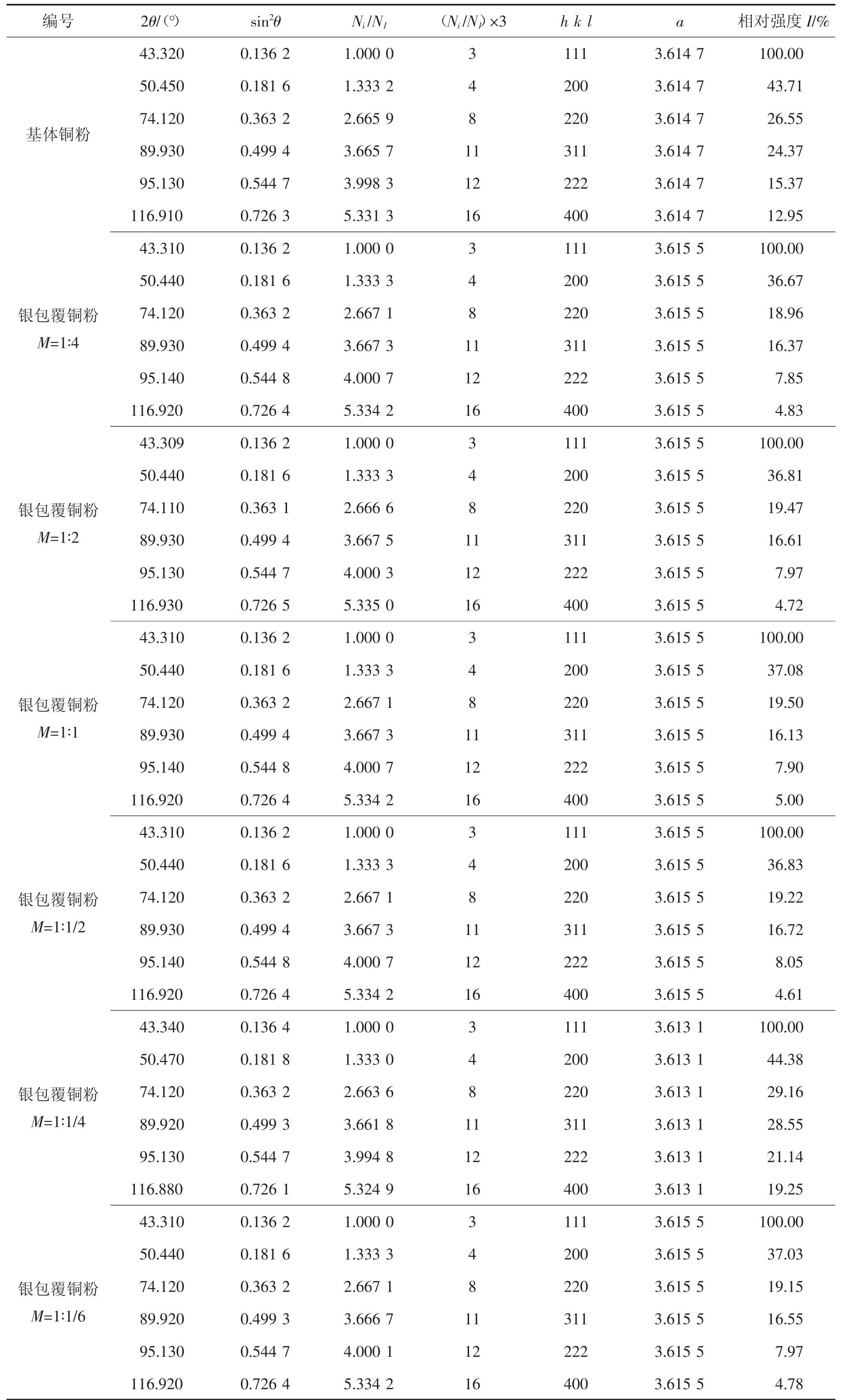
编号2θ/(°)sin2θNi/N1(Ni/N1)×3h k la相对强度I/%基体铜粉43.320 0.136 2 1.000 0 3 111 3.614 7 100.00 50.450 0.181 6 1.333 2 4 200 3.614 7 43.71 74.120 0.363 2 2.665 9 8 220 3.614 7 26.55 89.930 0.499 4 3.665 7 11 311 3.614 7 24.37 95.130 0.544 7 3.998 3 12 222 3.614 7 15.37 116.910 0.726 3 5.331 3 16 400 3.614 7 12.95银包覆铜粉M=1∶4银包覆铜粉M=1∶2银包覆铜粉M=1∶1银包覆铜粉M=1∶1/2银包覆铜粉M=1∶1/4银包覆铜粉M=1∶1/6 43.310 0.136 2 1.000 0 3 111 3.615 5 100.00 50.440 0.181 6 1.333 3 4 200 3.615 5 36.67 74.120 0.363 2 2.667 1 8 220 3.615 5 18.96 89.930 0.499 4 3.667 3 11 311 3.615 5 16.37 95.140 0.544 8 4.000 7 12 222 3.615 5 7.85 116.920 0.726 4 5.334 2 16 400 3.615 5 4.83 43.309 0.136 2 1.000 0 3 111 3.615 5 100.00 50.440 0.181 6 1.333 3 4 200 3.615 5 36.81 74.110 0.363 1 2.666 6 8 220 3.615 5 19.47 89.930 0.499 4 3.667 5 11 311 3.615 5 16.61 95.130 0.544 7 4.000 3 12 222 3.615 5 7.97 116.930 0.726 5 5.335 0 16 400 3.615 5 4.72 43.310 0.136 2 1.000 0 3 111 3.615 5 100.00 50.440 0.181 6 1.333 3 4 200 3.615 5 37.08 74.120 0.363 2 2.667 1 8 220 3.615 5 19.50 89.930 0.499 4 3.667 3 11 311 3.615 5 16.13 95.140 0.544 8 4.000 7 12 222 3.615 5 7.90 116.920 0.726 4 5.334 2 16 400 3.615 5 5.00 43.310 0.136 2 1.000 0 3 111 3.615 5 100.00 50.440 0.181 6 1.333 3 4 200 3.615 5 36.83 74.120 0.363 2 2.667 1 8 220 3.615 5 19.22 89.930 0.499 4 3.667 3 11 311 3.615 5 16.72 95.140 0.544 8 4.000 7 12 222 3.615 5 8.05 116.920 0.726 4 5.334 2 16 400 3.615 5 4.61 43.340 0.136 4 1.000 0 3 111 3.613 1 100.00 50.470 0.181 8 1.333 0 4 200 3.613 1 44.38 74.120 0.363 2 2.663 6 8 220 3.613 1 29.16 89.920 0.499 3 3.661 8 11 311 3.613 1 28.55 95.130 0.544 7 3.994 8 12 222 3.613 1 21.14 116.880 0.726 1 5.324 9 16 400 3.613 1 19.25 43.310 0.136 2 1.000 0 3 111 3.615 5 100.00 50.440 0.181 6 1.333 3 4 200 3.615 5 37.03 74.120 0.363 2 2.667 1 8 220 3.615 5 19.15 89.920 0.499 3 3.666 7 11 311 3.615 5 16.55 95.130 0.544 7 4.000 1 12 222 3.615 5 7.97 116.920 0.726 4 5.334 2 16 400 3.615 5 4.78
2.3 化学组成
扫描电镜和X射线衍射结果分析表明在活化后的铜粉表面上成功镀上了一层银。利用STEM-EDS来分析检测镀银层质量,银包覆铜粉(M=1∶1/4)的化学组成分析结果如图3所示。
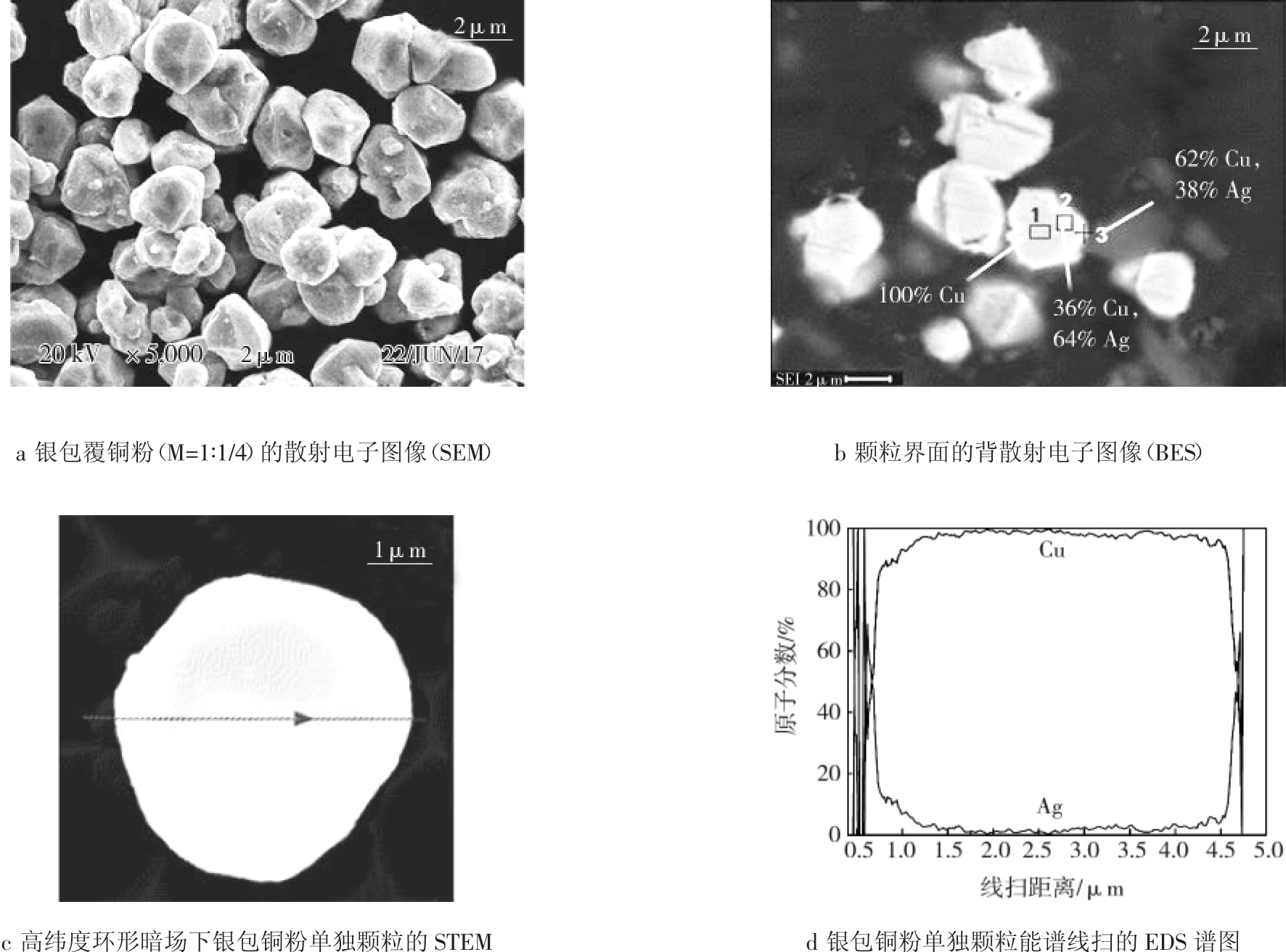
图3 银包覆铜粉(M=1∶1/4)的化学组成分析
Fig.3 Chemical composition analysis of silver coated copper powder(M=1∶1/4)
图3 a为M=1∶1/4下所制得的银包覆铜粉的散射电子图像(SEM),可看出银包覆铜粉颗粒分散性良好;图3b是3a中产品经镶样、剖样后的背散射电子图像(BES),其中暗色部分是树脂,亮色部分是银、铜两相,横剖后的粉体颗粒最外一圈至中间,颜色由亮变暗,说明银含量逐渐变低[25],与图上标出的银铜含量变化趋势相符合;图3c为高纬度环形暗场下银包铜粉单独颗粒的STEM,可估算包覆后粉体的颗粒直径约为2.5 μm。进行能谱线扫的EDS谱图如图3d所示,颗粒中心主要部分为铜,颗粒边缘银含量达到最高,镀银层厚度推算可达100~150 nm。
2.4 抗氧化性
将铜粉和银包覆铜粉进行热重分析。分析条件为:在空气氛围下,用Al2O3小坩埚装载,以10℃/min的加热速度加热至800℃,铜粉和银包覆铜粉的热重曲线如图4所示。
铜、银都会与空气中的氧气发生反应,但Ag2O在300℃时分解,粉体的质量增加来源于铜的氧化而不是银的氧化。
从图4中曲线可看出,在同等条件下基体铜粉质量增加总量最高,可达到125%;活化后的铜粉质量增加总量几乎没变化;而银包覆铜粉质量增加总量都小于基体铜粉,其值都低于120%,说明所镀银提高了初始铜粉的抗氧化性。
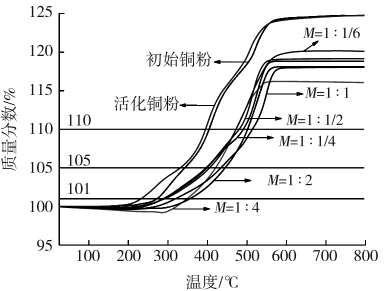
图4 铜粉和银包覆铜粉的热重曲线
Fig.4 TGA curves of Cu powder and silver coated copper powder
同等加速速率下,加热至400℃,保温5 h,基体铜粉和银包覆铜粉的抗氧化性及基础金属性质的检测结果如图5所示,质量增加趋势与图4一致,且完全氧化时间也加长;相同条件下测定产品的BET比表面积值与表面形貌相吻合。当M=1∶1/4时,EDTA与铜粉悬浮液直接混合下制备的银包覆铜粉较其他物质的量比下制备的粉末颗粒表面更为光滑,银镀层更为均匀致密,故其BET比面积最小。当M<1∶1时,由于大量银的析出、或银包覆铜粉颗粒表面上的镀银层太薄、甚至大部分为裸露的基体铜粉,导致银包覆铜粉中银所占质量比(Ag/(Ag+Cu))较小,检测结果与抗氧化性相吻合。
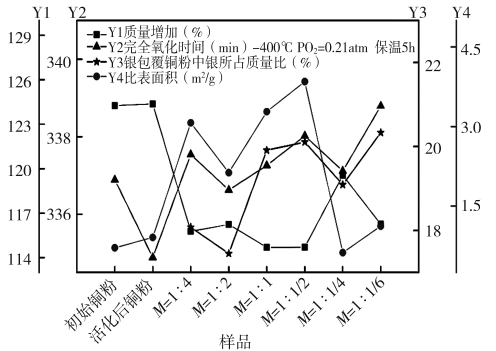
图5 基体铜粉和银包覆铜粉的抗氧化性及基础金属性质的检测结果
Fig.5 Anti-oxdation and founder mental property tests of silver coated copper powder
3 结论
1)在EDTA体系中,其他条件相同时,EDTA和AgNO3的物质的量比M=1∶1/4时制备的银包覆铜粉表面形貌最好,且镀银层厚度可达100~150 nm。此外,在一定范围内,包覆效果随EDTA用量的增多而变好。
2)通过对制得的银包覆铜粉热重分析等表明,其抗氧化性优于基体铜粉。
[1]LEE H H,CHOU K S,SHIH Z W.Effect of nano-sized silver particles on there resistivity of polymeric conductive adhesives[J].International Journal of Adhesion & Adhesives,2005,25(5):437-441.
[2]CHOI E B,LEE J H.Ethylene glycol-based Ag plating for the wet chemical fabrication of one micrometer Cu/Ag core/shell particles[J].Journal of Alloys & Compounds,2015,643:S231-S235.
[3]李雅丽,付新,刘娟.电子浆料银包铜微粉的制备、表征及性能研究[J].化工新型材料,2013,41(1):112-114.
[4]CHANG K K,LEE G J,MIN K L,et al.A novel method to prepare Cu@Ag core shell nanoparticles for printed flexible electronics[J].Powder Technology,2014,263(5):1-6.
[5]孟德荣.超细银包铜粉的工艺研究[D].北京:北京有色金属研究总院,2017.
[6]朱晓云,杨勇.片状镀银铜粉的制备及性能研究[J].昆明理工大学学报(自然科学版),2001,26(6):118-120.
[7]吴全兴.银铜梯度功能粉末制备导电浆料[J].中国材料进展,1995(3):18-19.
[8]PAN J Y,ZHU X Y,GUO Z C.Preparation status and applications of silver-coated copper powder used in electronics industries[J].Electroplating & Finishing,2006,25(6):49-53.
[9]XU X,LUO X,ZHUANG H,et al.Electroless silver coating on fine copper powder and its effects on oxidation resistance[J].Material Letters,2003,57(24):3987-3991.
[10]孙春桃,吴士筠.纳米银包覆铜粉体的制备及其导电性能研究[J].化学与生物工程,2003,20(6):27-28.
[11]高保娇,蒋红梅,张忠兴.用银氨溶液对微米级铜粉镀银反应机理的研究[J].无机化学学报,2000,16(4):669-674.
[12]吴秀华,赵斌.直接还原法制备超细铜银双金属粉及性能研究[J].无机化学学报,2002,18(6):597-601.
[13]徐锐,周康根,胡敏艺.水合肼液相还原法制备超细铜粉反应机理研究[J].稀有金属材料与工程,2008,37(5):905-908.
[14]SCHAEFERS S,RAST L,STANISHEVSKY A.Electroless silver plating on spin-coated silver nanoparticle seed layers[J].Materials Letters,2006,60(5):706-709.
[15]毛倩瑾,于彩霞,周美玲.Cu/Ag复合电磁屏蔽涂料的研究[J].涂料工业,2004,34(4):8-10.
[16]曹晓国,张海燕,黄惠平.微米级铜银双金属粉的制备及其抗氧化性研究[J].材料导报,2006,20(10):151-153.
[17]谭富彬,蔡云卓,赵玲,等.铜粉末化学镀银及其性能[J].贵金属,2000,21(3):8-11.
[18]吴懿平,吴大海,袁忠发,等.镀银铜粉导电胶的研究[J].电子元件与材料,2005,36(4):32-35.
[19]KOMASAN,YUGAWAU,MOROT.Silver-coated copper powder:JP 61003802 A [P/OL].1986-01-09[2017-08-19].https://www4.j-platpat.inpit.go.jp/eng/tokujitsu/tkbs_en/TKBS_EN_GM301_Detailed.action.
[20]施泽民,钱峰,徐子仁,等.电磁屏蔽导电涂料用铜粉的制备方法:1130553 A[P].1996-09-11.
[21]刘志杰,赵斌,张宗涛,等.超细核壳铜-银双金属粉的制备[J].无机化学学报,1996,12(1):30-34.
[22]宋曰海,马丽杰.置换还原法制备银包铜粉工艺及性能研究[J].电镀与精饰,2013,35(6):7-9.
[23]刘志宏,李玉虎,李启厚,等.一种单分散高结晶度铜粉的制备方法:101274370A[P].2008-10-01.
[24]DEAN J A.Lange’s handbook of chemistry[M].New York:Science Press,1999.
[25]NANCY.扫描电镜在材料分析中的应用(三)[EB/OL].2010-07-20[2017-09-01].http://www.microimage.com.cn/xwjs/2010/0720/article2030.html