氧化石墨是在石墨表面或层间插入大量羰基、羟基、羧基、环氧基等含氧官能团而形成的含有共价键的石墨层间化合物,其结构如图1所示。
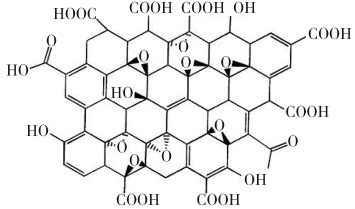
图1 氧化石墨的结构模型
Fig.1 Structural model of graphite oxide
氧化石墨的组成与氧化程度有关。同时由于各种极性官能团的引入,因此也赋予了氧化石墨一系列新的特性[1]。氧化石墨具有很多优异的性能,例如:其层面的热导率和电导率比片层轴向之间的大的多;比表面积比石墨更大,化学活性也比石墨强得多;表面性能体现出亲水性,能与水性物质较好地融合;适宜使用的温度范围很广,尤其是当外加压力和温度发生交变时,其密封性能不易失效[2-4]。除此之外,较大的层间距使其容易与高分子化合物复合[5];作为化学还原法制备石墨烯的中间产物,也使它的用途更广泛。
本文中综述了国内外石墨氧化技术的发展,包括制备方法、氧化原理及产品性能,分类总结了氧化石墨(或氧化石墨烯,GO)在不同领域内的应用,对其产业化生产技术进行了展望,以促进氧化石墨、氧化石墨烯和石墨烯的进一步研究与发展。
2 氧化石墨的制备
目前国内外关于氧化石墨的制备方法主要分2类,即化学氧化法和电化学氧化法。化学氧化法即采用强氧化剂对石墨进行处理,其主要优点为反应过程易控制,操作方便,选择性高;缺点为大多数氧化剂价格昂贵,对环境存在污染。电化学氧化法主要是通过电极材料的作用产生超氧自由基(·O2)、羟基自由基(·OH)等活性基团[6]来氧化石墨。该过程发生在水中,且不需另加催化剂,避免了二次污染,能耗虽高,但可控性强,条件温和。
2.1 化学氧化法
2.1.1 Brodie法
1859年Brodie[7]首次制备了氧化石墨。过程如下:将石墨与3倍量的氯酸钾混合,加入足量发烟硝酸浸没后,60℃水浴加热反应3 d,加水洗涤并干燥,重复氧化步骤4次左右,即可得到氧化石墨。
反应过程中KClO3与HNO3作用形成活性氧化剂ClO2,石墨先被HNO3氧化,接着又被ClO2进一步氧化成氧化石墨,ClO2则被还原为Cl2。
由于氧化剂ClO2化学性质不稳定且有毒,反应过程危险性较大,而且反应需要多次重复才能达到一定的氧化程度,因此该法反应时间长,操作复杂。优点是石墨氧化程度可通过氧化时间进行控制,合成的氧化石墨结构比较规整,晶体虽然很薄,但片层尺寸较大。
2.1.2 Staudenmaier法
Staudenmaier[8]在发烟硝酸中添加了浓硫酸作为混酸体系,仍采用氯酸钾作为氧化剂对石墨进行了氧化。方法如下:将浓硫酸与浓硝酸以体积比3:1混合,加入石墨搅拌均匀,缓慢加入氯酸钾,在冰水浴中反应4 d。反应完成后加入大量去离子水室温下静置,沉淀即为氧化石墨。
反应过程中,浓酸与氯酸钾反应生成的ClO2气体仍是主要的氧化剂,其在石墨的碳基底上将石墨碳氧化为羟基和环氧基,在边缘位置氧化为羰基和羧基。这一过程完成后,加入大量水时,水分子可插入氧化石墨的片层间,氧化石墨会发生进一步扩张,形成蓬松的物质。
该法优点为混酸的氧化性比发烟硝酸更强,也可通过控制反应时间来控制产物的氧化程度,但对反应温度的要求高,需维持在0℃进行,此外反应周期仍较长。另外此过程产生的有毒气体Cl2较多,产物的洗涤需大量的水,对环境造成了污染。
2.1.3 Hummers法及其改良
Hummers等 [9]采用浓硫酸体系对石墨进行了氧化,主要通过程序升温的方式来进行。过程如下:将石墨、硝酸钠和浓硫酸在冰水浴中混合均匀,缓慢加入高锰酸钾,在35℃水浴中反应30 min,可观察到混合物变成棕灰色黏稠物。随后加入去离子水,在98℃油浴中反应15 min,再次观察到体系变为褐色。反应结束后,加入去离子水和双氧水至混合物变金黄色,洗涤干燥即可得氧化石墨。
反应原理[10]描述如下:低温阶段主要是石墨边缘的氧化和![]() 的插层,打开了石墨的碳层结构;中温阶段石墨片层中心继续被KMnO4氧化,氧原子和碳原子以共价键结合,石墨的六元环被破坏;高温阶段,加入的大量水与浓硫酸混合,水分子和水中的OH-插入石墨的层间,脱去含硫基团。
的插层,打开了石墨的碳层结构;中温阶段石墨片层中心继续被KMnO4氧化,氧原子和碳原子以共价键结合,石墨的六元环被破坏;高温阶段,加入的大量水与浓硫酸混合,水分子和水中的OH-插入石墨的层间,脱去含硫基团。
Hummers法的优点是用高锰酸钾代替氯酸钾作为氧化剂,提高了石墨的氧化程度,并且减少了有毒气体的产生[11]。另外由于该法反应时间短,工艺简单,因此目前应用比较广泛,产品的氧化程度可由颜色区分,氧化程度较高时是金黄色,氧化程度较低时颜色介于绿色和黑色之间。该法的缺点是制备过程产生了不溶于水的锰残余物而难以提纯,因此限制了其在电子设备领域的应用。
2.1.4 其他方法
Chandra等[12]使用重铬酸钾作为氧化剂对石墨进行了氧化,先在冰水浴中反应4 h后再室温下反应5 d,会看到体系由初始的橙红色转变为深黄色,又变为深绿色。室温反应完成后升温至98℃,缓慢加入稀硫酸反应3 h,最后降至室温下再反应2 h即可制得氧化石墨。将氧化剂用重铬酸钾替代后,其可作为反应过程中的指示剂,便于观察反应进行的程度;氧化过程中生成的CrO3可溶于水,制得的产品易提纯;且紫外分析结果表明氧化石墨中的共轭双键结构完整,优于高锰酸钾氧化的产品。但该法持续时间长,反应过程中需注意控温。
Marcano等[13]在Hummers法的基础上,使用浓硫酸和磷酸的混酸体系进行了氧化反应,将反应物加热至50℃反应12 h,反应完成后冷却至室温,加入冰水和双氧水,洗涤干燥即可制得氧化石墨。该法的氧化剂用量较大,优点是体系的温度变化不大,而且磷酸的存在使得在石墨基底上,2个邻位二醇与磷酸之间形成了五元环状的磷酸酯基,因此基底平面破坏更小,形成的氧化石墨结构更规整;环氧基含量明显提高,产品含69%被氧化的碳,高于Hummers法所制(含质量分数61%被氧化的碳)。
Lavin-Lopez等[14]在Marcano法的基础上将反应时间缩短至3 h,只用高锰酸钾作氧化剂进行反应,结果表明,缩短反应时间后氧化石墨的缺陷增大,由于缺少了高温阶段层间杂质基团的解离;因此氧化石墨产品中含硫量较高,但产品的比表面积较大(28 m2/g),热稳定性良好,氧化程度很高(氧元素与碳元素的质量比为1.35),且氧化方法不影响石墨的结晶域,并大大缩短了反应时间,减少了能量消耗,其形貌如图2所示。

图2 Lopez所制备典型的氧化石墨SEM图像
Fig.2 Representative SEM image corresponding graphite oxide synthesized by Lopez
2.2 电化学氧化法
由于电化学法方法简单,处理时间短,操作简便易控制[15],规模易扩大,不使用危险化学试剂,无需大量的清洗步骤,因此大大简化了石墨的氧化技术,是一种具有发展前途的绿色工艺。
2.2.1 水溶液电解质
Liu等[16]在硫酸、磷酸等酸性电解液中,以石墨棒为阴、阳极,采用交替电流的方法,同时对两电极进行了电化学氧化,反应过程如图3所示。
其所制备的氧化石墨横向尺寸为1~5 μm,厚度为3~6 nm,缺陷较小(ID/IG=0.71),可作为无金属催化剂用于氧化还原反应,在碱性溶液中表现出了优异的电催化活性以及毒性耐受性。反应过程如下:起始加+1 V的电压3~5 min,润湿电极表面,便于阳极附近电荷的积累及离子插层。后调电压至+7 V,持续5~8 min,这一阶段作为阳极的石墨片将被氧化。随后将电极调换,原阴极石墨片即发生氧化。反应几分钟后即可观察到电解液颜色由透明变为黑色。通过这种交替的偏压可使两边的电极均被氧化,提高了电极利用率。
Parvez等[17]在电解液为无机盐水溶液,阳极为石墨片电极,阴极为铂电极的体系中,选取(NH4)2SO4、Na2SO4和K2SO4等pH值为中性的盐作为电解质,采用+10 V的直流电源进行了电化学反应,电解过程石墨片电极变化如图4所示。
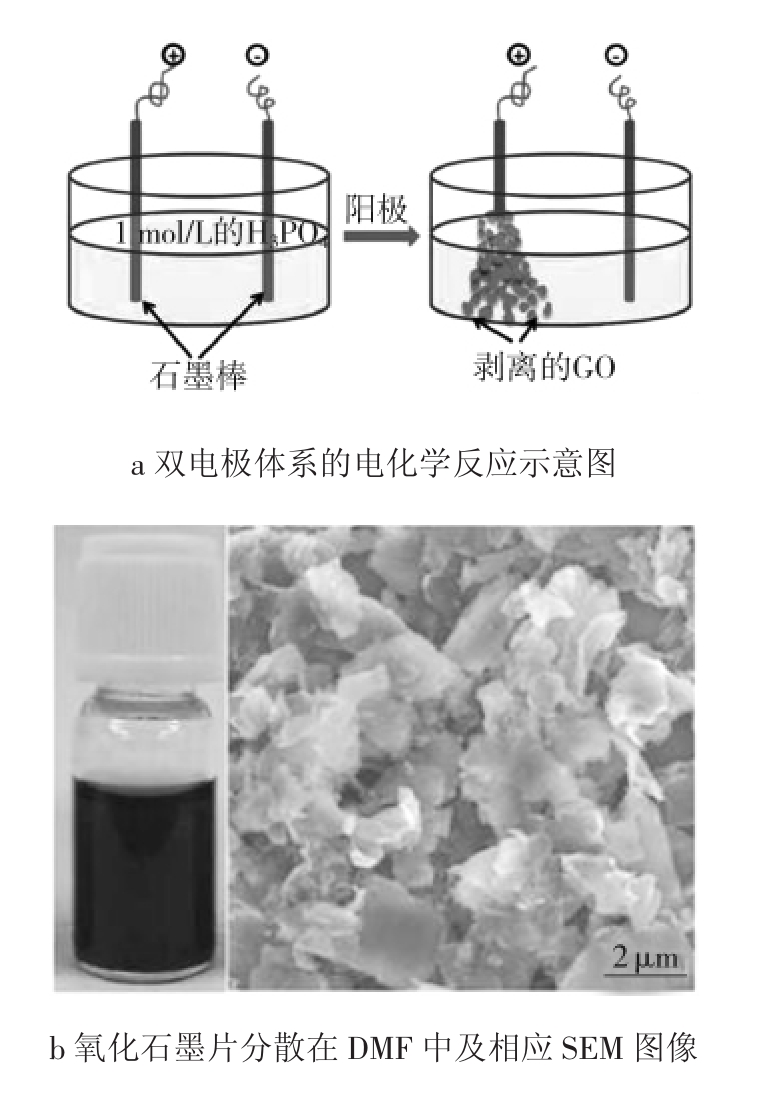
图3 水溶液电解质反应
Fig.3 Reaction in aqueous electrolyte
3~5 min即可制备得到氧化程度较低(氧碳元素质量比为17.2)、片层尺寸较大(平均尺寸18.7 μm)、层数较少的氧化石墨,其产率高,产品具有显著的空穴迁移率,导电性高,以此制备的超级电容器性能良好。其电化学氧化剥离机理描述如下:首先,利用电极上产生的偏压在阴极还原水,产生强亲核试剂OH-,使其进攻石墨的边缘位置,导致石墨边缘的去极化及膨胀,使水分子和![]() 插层进去;其电解会产生SO2、O2等气体,这些气体进一步将石墨片层间距扩大,从而导致了石墨的氧化及剥离。
插层进去;其电解会产生SO2、O2等气体,这些气体进一步将石墨片层间距扩大,从而导致了石墨的氧化及剥离。
Ambrosi等[18]分别在 H2SO4、Na2SO4和 LiClO4电解质溶液中,以阳极为石墨片电极,阴极为铂电极的体系中对石墨进行了氧化和剥离。结果表明,所得产品氧碳元素质量比为4、片层尺寸为3~10 μm,平均厚度为2.8 nm,ID/IG=1,在H2SO4电解液中制备的产品具有最快的异构电子转移速率,Na2SO4电解液中制备的产品比电容最高,是制备超级电容器最好的材料,而LiClO4电解液中制备的产品含氧量最高,表明电化学法可作为制备氧化石墨的一种有效的方法以取代目前较危险的化学方法。
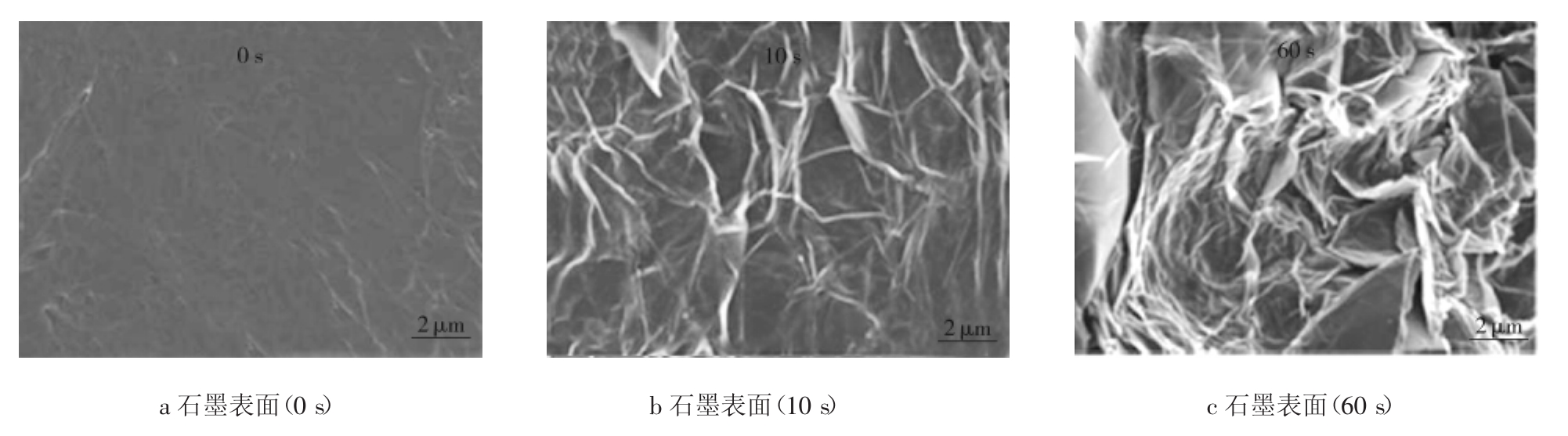

图4 (NH4)2SO4电解液中不同电解时间得到石墨电极SEM图像
Fig.4 SEM images of graphite foil in aqueous (NH4)2SO4electrolyte solution for different electrolysis time
Yu等[19]采用石墨粉末为原料,电解液选择H2SO4和饱和的Na2SO4,阳极为特制的涂覆钛的混合金属氧化物(MMO),阴极为铂电极,进行了电化学氧化过程,实验装置如图5所示。
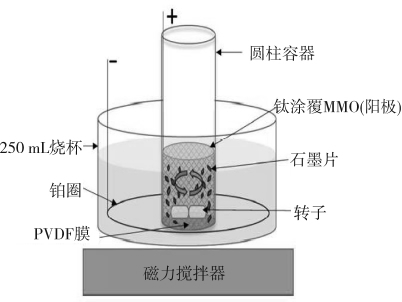
图5 机械辅助的电化学反应示意图
Fig.5 Schematic drawing of mechanically assisted electrochemical reaction setup
对工作电极加0.6 A直流电源24 h后完成电化学反应过程,制备得到的氧化石墨片层大小约为1~10 μm,平均厚度为 1.5 nm,层间距为 0.875 nm,含氧官能团中羧基较少,在有机溶剂中稳定性好,热还原条件温和,还原后导电率高,可用于热敏性纳米导电材料,电解液亦可重复使用。其反应原理描述如下:阳极在与金属接触的石墨上产生了电压,促进了![]() 的插层,同时阳极附近水的电解产生了O2或O3,而O3分解的羟基自由基在石墨的边缘位置首先氧化产生了含氧官能团,打开石墨的边界层后又进一步促进了与水分子的插层,使石墨基板开始氧化。连续的搅拌使石墨片不断与MMO钛网接触,从而可以不断氧化和剥离。
的插层,同时阳极附近水的电解产生了O2或O3,而O3分解的羟基自由基在石墨的边缘位置首先氧化产生了含氧官能团,打开石墨的边界层后又进一步促进了与水分子的插层,使石墨基板开始氧化。连续的搅拌使石墨片不断与MMO钛网接触,从而可以不断氧化和剥离。
2.2.2 离子液体电解质
离子液体固有的电导率、难挥发性及低蒸汽压,使其在纳米粒子的合成中具有广泛用途。Singh等[20]采用三电极体系,工作电极为石墨棒,参比电极和辅助电极均为Pt,在离子液体——三乙基磺双(三氟甲基磺酰)亚胺中进行了石墨的电化学氧化过程,反应过程如图6所示。
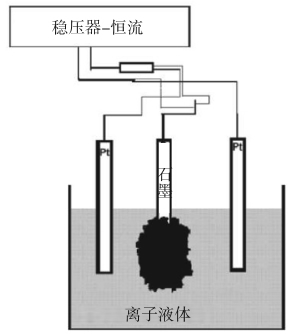
图6 三电极体系的电化学反应示意图
Fig.6 Schematic illustration of electrochemical reaction for three electrode
具体操作过程为:首先加0 V的静电电位120 s润湿电极,使离子液体温和地插入石墨棒的晶界中,然后加+8 V的电压保持600 s即可制得氧化石墨,产品缺陷较小(ID/IG=0.75),可用于制备实时无标记的表面等离子共振光学检测器感应生物毒剂,其结构如图7所示。

图7 离子液体电解质中电解反应SEM图像
Fig 7 SEM images of graphite and graphite oxide in ionic liquid
Najafabadi等[21]使用石墨棒为阳极,Pt为阴极,在7 V的电压下,采用离子液体和乙腈体积比为1∶50的电解液进行了电解反应,选取4种离子液体——EMII BF4、EMIM BTA、N1114 BTA、BMPyrr BTA 进行了平行实验,实验结果表明:反应速度最快的BMPyrr BTA电解液中,4 h内即有86%的石墨完成了氧化和剥离过程。BTA具有强氧化性,其在反应过程中发挥的作用类似于![]() 与传统的水溶液电解质相比,离子液体作电解液时可重复使用,反应效率也更高。
与传统的水溶液电解质相比,离子液体作电解液时可重复使用,反应效率也更高。
3 氧化石墨(烯)的应用
3.1 模板材料
氧化石墨经过剥离可制备得到GO。由于结构上存在大量的活性位点,因此可用作模板制备复合材料,增大基体材料的比表面积,增强热稳定性,提高机械性能。
Shul等[22]将氧化石墨与二氧化钛复合,增大了二氧化钛的比表面积,将其吸收光谱扩展至可见光和红外光区域,在光催化反应中大大提高了催化效率。姚成立等 [23]发现GO结构上羧基官能团可与金属离子(如Ca2+)配位成为晶体的成核位点,因此GO常被用作特殊模板来诱导碳酸钙(CaCO3)、羟基磷灰石(HA)等无机物的矿化合成以及贝壳状无机-有机杂化材料的仿生合成,为制备特殊功能的有机(无机)功能材料提供方向和基础。杨建国等[24]将十六烷基三甲基溴化铵通过离子交换的方式插入氧化石墨,制备得到聚苯乙烯-氧化石墨纳米复合材料。热重分析发现,其热稳定性明显优于聚苯乙烯(PS)和普通石墨粉复合的PS材料。Han等[25]通过将氧化石墨和微晶纤维素的碱性水溶液浇铸在玻璃板上,制备得到了厚度约0.8 mm的复合膜。检测结果表明,复合膜中纤维素和氧化石墨混合均匀,热稳定性和机械性能明显优于纯纤维素。
3.2 废水处理
氧化石墨和氧化石墨烯基复合材料对废水中的有机污染物,放射性核素和金属离子具有强吸附力。
Travlou等[26]制备了一种氧化石墨-壳聚糖复合材料用于去除活性黑5染料。研究表明,壳聚糖可以大量组装在GO层的表面,并在吸附过程中有效提高吸附面积。Wu等[27]制备了铝基-氧化石墨复合材料,该材料孔隙体积和比表面积均很大,对甲基橙的吸附量达400 mg/g,是一种有发展前途的吸附性材料。Wang等[28]从静态法、表面络合模型、光谱分析和理论计算等4个方面讨论了氧化石墨烯和石墨烯基纳米材料对废水中放射性核素的作用机理。研究发现,在pH值较大的情况下,放射性核素在GO表面上负载量增大,形成复合物沉淀。将纳米铁负载在GO表面上,该纳米颗粒可将表面吸附的放射性核素从高价态降为低价态,这对于在自然环境中固定 U(VI)、Tc(VII)或其他种类的高价放射性核素是至关重要的。Romanchuk等[29]研究了在污水(包括酸性污水,pH<2)中GO对锕系元素的吸附机理及吸附动力学。随着GO片的纳米颗粒聚集,阳离子与GO发生凝聚,由此可以除去。研究发现,在从模拟核废料中去除超铀元素时GO比常规的吸附剂如膨润土和活性炭更有效。
3.3 脱盐作用
淡水稀缺已经升级为全球性问题,而充分确保淡水可用的有效技术之一是脱盐。GO具有的亲水性以及能提供大量功能反应位点在脱盐应用中已经取得了一定的进展。良好的机械性能和易于制备的特点,也使其易于工业化。
Nicola等[30]对脱盐过程进行了分子动态模拟,发现GO膜可100%隔绝盐分,且具有优异的水渗透性。虽然GO膜厚度薄(约10 nm),但是其渗透力可媲美双倍的反渗透膜技术。Feng等[31]使用1,4-苯二异氰酸酯(PDI)作为交联剂制备了GO分散液,并采用真空抽滤的方法,在PDI改性的α-Al2O3管上制备了微米厚度的GO框架膜。采用三维结构的膜,可以降低传质阻力,显著提高水通量。Tan等[32]为解决GO脱盐过程中的电负性和易溶胀问题,开发了一种新的电渗析系统,通过添加截留介质来解决传统电渗析系统的膜污染,实现了高效脱盐。其设计的系统更适用于GO分散体脱盐,截留带电粒子以保证阴离子交换膜的连续工作,为GO的大规模使用和带电胶体分散体的脱盐提供了重要的技术依据。除了脱盐作用外,GO膜还可被用于分离丁醇-水体系。Chen等[33]采用热处理法制备了GO膜,研究结果表明,GO膜的分离效率高,膜的重复使用性强,是通过PV工艺进行丁醇脱水的有效分离材料。
3.4 生物材料
GO表面各种官能团使其易与生物分子直接相互作用,从而进行化学修饰,是一种应用前景广阔的生物医用材料。
Lu等[34]首次研究了GO对DNA和蛋白质的选择性检测,研究发现:GO和染料标记的DNA作用可导致染料荧光消失。而当有目标DNA存在时,GO将释放DNA,恢复染料的荧光。与碳纳米管相比,在生物传感器中,GO生产规模大、成本低、灵敏性强,应用潜力更大。另外,石墨材料对细菌具有强烈的细胞毒性。为了更好地了解其抗菌机制,Liu等[35]比较了4种类型的材料(石墨(Gt)、氧化石墨(GtO)、氧化石墨烯和还原型氧化石墨烯(rGO))对大肠杆菌的抗菌活性。研究表明,抗菌作用是由膜和氧化应激引起的。抗菌机制分3步,细胞在石墨材料上的沉积,细胞与材料接触引起膜应力,随后无超氧化物阴离子参与的氧化。结果表明,在相同浓度和环境下,GO抗菌活性最高。Andrea等[36]在碱性环境中通过芳族取代将3-十五氟庚基,5-全氟苯基-1,2,4-恶二唑(FOX)分子附着在 GO上,复合物纳米片(GOF)可作为氧气储存器,结果显示,在生理条件下,GO和FOX的协同作用可增强氧气吸收和释放能力,用于血管化组织再生期间的细胞氧合作用,此外,GOF还显示出了超高的细胞相容性。
3.5 电池材料
氧化石墨的导电性与其含氧官能团和层间距有关。Mohammad等[37]研究发现,在含氧官能团中,当羧基官能团增多时,氧化石墨层间距增大,活化能降低,电导率增加。基于此,可以通过改变氧化石墨或其他层状材料的层间距来调节其导电性。
Li等[38]成功制备了石墨/氧化石墨复合电极用于钒氧化还原液流电池。研究表明,当石墨电极中加入质量分数为3%氧化石墨时,由于氧化石墨比表面积更大以及其结构上存在大量含氧官能团,因此电极的电化学性能得到显著提高,复合电极上的氧化还原电流峰值增加了2倍,氧化还原对的电荷转移电阻也大大降低。Xu等 [39]通过溶剂热法合成了纳米结构的MoO2-氧化石墨复合材料。XRD和TEM分析表明,随着氧化石墨含量的增加,在复合材料中,Mo的存在形式由MoO3棒变为MoO2纳米棒,进一步转化为MoO2纳米颗粒,均匀分布在氧化石墨表面。MoO2和氧化石墨之间的协同反应,使得合材料的可逆容量、放电容量和循环性能皆有所提高,添加质量分数为10%的氧化石墨后的复合物在100 mA/g的电流密度和800 mA/g的电流密度下循环30次后,其可逆容量仍可达720、560 mA·h/g。Bi等[40]合成了一种新型的氧化石墨烯(GO),其中主要含氧基团是羟基,含氧质量分数为46.85%,远高于Hummers法制备的GO(质量分数为27.97%),氧元素增加会大大改善电化学赝电容,因此在脉冲激光器件中使用时稳定性良好,光学转换效率可达11.3%,可作为潜在的光电子材料开发使用。
4 结论与展望
在制备方面,氧化石墨烯进行还原处理可得到石墨烯,石墨烯作为单层碳原子构成的二维纳米材料,具有良好的导电、导热和力学性能,其优异的性能决定了石墨烯在能源、化学等诸多领域有着广阔的应用前景。作为制备石墨烯的第一步反应,氧化石墨的合成技术能否产业化生产以及产品纯度对石墨烯等材料的广泛应用起着决定性作用,除此之外,制备成本低廉,过程无污染,产品易净化处理也是其主要的发展方向。
在应用方面,由于氧化石墨、氧化石墨烯和石墨烯在复合材料领域的快速发展,因此其应用范围也随之变广。对于不同的目标产物,有针对性地设计功能化的复合材料,从而实现对目标物的高效作用,将使得石墨产品在复合材料领域具有更为广阔的发展空间。
参考文献(References):
[1]HE H Y,KLINOWSKI J,FORSTER M,et al.A new structural model for graphite oxide[J].Chemical Physics Letters,1998,287(1):53-56.
[2]HAMWI A,MARCHAND V.Some chemical and electrochemical properties of graphite oxide[J].Journal of Physics and Chemistry Solids,1996,87(6):867-872.
[3]苏育志,刘成波,张瑞芬,等.氧化石墨的合成及其结构研究[J].广州师院学报(自然科学版),1999,21(3):55-59.
[4]LERF A,HE H Y,FORSTER M,et al.Structure of graphite oxide revisited[J].Journal of Physics and Chemistry:B,1998,102(23):4477-4482.
[5]周文明,贺蕴秋.氧化石墨插层纳米复合材料的制备研究进展[J].材料导报,2007,21(A3):204-206.
[6]雷阳明,申哲民,贾金平,等.电化学氧化法和高铁混凝法处理染料废水研究[J].环境科学与技术,2006,29(2):75-77.
[7]BRODIE B C.On the atomic weight of graphite[J].Philosophical Transactions of the Royal Society of London,1859,149:249-259.
[8]STRUDENMAIER L.Verfahren zur darstellung der graphitsaure[J].Berichte der Deutschen Chemischen Gesellschaft,1898,31,1481-1487.
[9]HUMMERS J W S,OFFEMAN R E.Preparation of graphitic oxide[J].Journal of American Chemical Society,1958,80:1339.
[10]傅玲.氧化石墨和聚吡咯/氧化石墨纳米复合材料的制备、表征及应用研究[D].北京:北京化工大学,2005.
[11]普罗姆B,日诺兹J,马蒂R,等.氧化石墨的制备方法及其用途:CN 104817070 A[P].2015-08-05.
[12]CHANDRA S, SAHU S, PRAMANIK P.A novelsynthesis of graphene by dichromate oxidation[J].Materials Science and Engineering:B,2010,167(3):133-136.
[13]MARCANO D C,KOSYNKIN D V,BERLIN J M,et al.Improved synthesis of graphene oxide[J].ACS Nano,2010,4(8):4806-4814.
[14]LAVIN-LOPEZ M P,ROMERO A,GARRIDO J,et al.Influence of different improved Hummers method modifications on the characteristics of graphite oxide in order to make a more easily scalable method[J].Industrial&Engineering Chemistry Research,2016,55(50):12836-12847.
[15]翁文桂,陈国华,吴大军,等.石墨电化学氧化制备纳米粒子及其表征[J].华侨大学学报,2002,23(4):361-365.
[16]LIU J L,YANG H P,ZHEN S G,et al.A green approach to the synthesis of high-quality graphene oxide flakes via electrochemical exfoliation of pencil core[J].RSC Advances,2013,3(29):11745-11750.
[17]PARVEZ K,WU Z S,LI R J,et al.Exfoliation of graphite into graphene in aqueous Solutions of inorganic salts[J].Journal of American Chemical society,2014,136(16):6083-6091.
[18]AMBROSI A,PUMERA M.Electrochemically exfoliated graphene and graphene oxide forenergy storage and electrochemistry applications[J].Chemistry A European Journal,2016,22(1):153-159.
[19]YU P,TIAN Z M,LOWE S E,et al.Mechanically-assisted electrochemical production of graphene oxide[J].Chemistry of Materials,2016,28(22):8429-8438.
[20]SINGH V V,GUPTA G,BATRA A,et al.Greener electrochemical synthesis of high quality graphene nanosheets directly from pencil and its SPR sensing application[J].Advanced Functional Materials,2012,22(11):2352-2362.
[21]NAJAFABADI A T,GYENGE E.High-yield graphene production by electrochemical exfoliation of graphite:novel ionic liquid(IL)-acetonitrile electrolyte with low IL content[J].Carbon,2014,71:58-69.
[22]SHUL’GA Y M,ARBUZOV A A,KABACHKOV E N,et al.Composite formed upon the ultrasonication of an aqueous suspension of graphite oxide titanium dioxide[J].Russian Journal of Physical Chemistry:A,2017,91(1):189-194.
[23]姚成立,金涛,齐春霞,等.氧化石墨烯在仿生合成中的应用及研究[J].分析测试学报,2016,35(2):249-256.
[24]杨建国,牛文新,李建设,等.聚苯乙烯/氧化石墨纳米复合材料的制备与性能[J].高分子材料科学与工程,2005,21(5):55-58.
[25]HAN D L,YAN L F,CHEN W F,et al.Cellulose/graphite oxide composite films with improved mechanical properties over a wide range of temperature[J].Carbohydrate Polymers,2011,83(2):966-972.
[26]TRAVLOU N A,KYZAS G Z,LAZARIDIS N K,et al.Graphite oxide/chitosan composite for reactive dye removal[J].Chemical Engineering Journal,2013,217:256-265.
[27]WU S C,YU L L,XIAO F F,et al.Synthesis of aluminum-based MOF/graphite oxide composite and enhanced removal of methyl orange[J].Journal of Alloys and Compounds,2017,724(15):625-632.
[28]WANG X X,YU S J,JIN J,et al.Application of graphene oxides and graphene oxide-based nanomaterials in radionuclide removal from aqueous solutions[J].Science Bulletin,2016,20:1583-1593.
[29]ROMANCHUK A Y,SLESAREV A S,KALMYKOV S N,et al.Graphene oxide for effective radionuclide removal[J].Physical Chemistry Chemical Physics,2013,15(7):2321-2327.
[30]NICOLA A,SUMPTER B G,MEUNIER V.Tunable water desalination across graphene oxide framework membranes[J].Physical Chemistry Chemical Physics,2014,16(18):8646-8654.
[31]FENGB,XUK,HUANGAS.Covalentsynthesisofthree-dimensional graphene oxide framework (GOF) membrane forseawater desalination[J].Desalination,2016,394:123-130.
[32]TAN W,HAO R X,LIU Y,et al.Desalination of graphite oxide by electrodialysis[J].Desalination,2016,385:53-57.
[33]CHEN X F,LIU G P,ZHANG H Y,et al.Fabrication of graphene oxide composite membranes and their application for pervaporation dehydration of butanol[J].Science Bulletin,2015,23(7):1102-1109.
[34]LU C H,YANG H H,ZHU C L,et al.A graphene platform for sensing biomolecules[J].Angewandte Chemie,2009,48(26):4785-4787.
[35]LIU S B,ZENG T H,HOFMANN M,et al.Antibacterial activity of graphite,graphite oxide,graphene oxide,and reduced graphene oxide:membrane and oxidative stress[J].ACS Nano,2011,5(9):6971-6980.
[36]MAIO A,SCAFFARO R,LENTINI L,et al.Perfluorocarbonsgraphene oxide nanoplatforms as biocompatible oxygen reservoirs[J].Chemical Engineering Journal,2018,334:54-65.
[37]KARIM M R,ISLAM M S,HATAKEYAMA K,et al.Effect of interlayer distance and oxygen content on proton conductivity of graphite oxide[J].The Journal of Physical Chemistry:C,2016,120(38):21976-21982.
[38]LI W Y,LIU J G,YAN C W.Graphite-graphite oxide composite electrode for vanadium redox flow battery[J].Electrochimica Acta,2011,56(14):5290-5294.
[39]XU Y,YI R,YUAN B,et al.High capacity MoO2/graphite oxide composite anode for lithium-ion atteries[J].Journal of Physical Chemistry Letters,2012,3(3):309-314.
[40]BI J J,WANG Z Z,CUI Y P.A new type of graphene oxide and its application in laser devices[J].Optical Materials,2017,66:277-280.